钟俊, 赵佩莹, 杨洵, 陈亚飞, 王迪芬
(1.贵州省骨科医院 重症医学科, 贵州 贵阳 550002; 2.遵义医学院附属贵航300医院 重症医学科, 贵州 贵阳 550009)
脓毒症是以宿主对感染的反应失调致全身炎症反应综合征,临床主要表现为器官循环、代谢功能障碍,是重症医学可关注的重点及热点问题。在临床上,心肌损害是脓毒症最典型及严重结果,同时也是导致脓毒症患者预后不良甚至死亡的重要原因之一。脓毒症对患者心肌损害主要通过心肌能量改变、炎症介质对心肌细胞损害及血管内皮的损伤、补体C5a激活致心肌缺血性损伤及自主神经系统的影响等[1]。今年的研究认为,在脓毒症早期,大量氧自由基形成诱发的氧化应激损伤及“炎症因子风暴”造成大量心肌细胞损伤[2-3],因此抗氧化应激及抗炎为脓毒症的临床治疗指出新的路径。维生素C具有显着的抗氧化、抗炎功能,本研究以120例脓毒症患者为研究对象,探讨维生素C在患者心肌损伤干预中的作用和机制。
1 资料与方法
1.1 临床资料
纳入2019年1月—2020年12月收治的120例脓毒症患者为研究对象,所有患者均经临床检查确诊,诊断标准根据第3版脓毒症与脓毒性休克定义的国际共识(Sepsis-3)对于疑似感染患者进行快速序贯器官衰竭评分(qSOFA),意识改变、收缩压≤100 mmHg、呼吸频率≥22次/min,符合以上两项即疑似脓毒症,qSOFA评分≥2分即可诊断脓毒症[4]。所有患者均有授权家属签署知情同意,研究获得医院伦理委员会批准。病例纳入标准:(1)18~76岁;(2)住院存活时间超过48 h、病历资料完整;(3)入院近期(入院前2周内)无维生素C使用史。排除标准:(1)入住重症监护病房(ICU)后24 h内死亡、对本研究所采用的药物禁忌症者;(2)预计生存时间<96 h;(3)非感染性原因所致全身炎症反应综合征 (SIRS)或伴器官衰竭(外伤、肿瘤等);(4)妊娠期、哺乳期妇女;(5)有激素或免疫抑制药物长期应用史者、研究期间未能连续用药者;(6)排除心肌梗死或者其他原因导致的心肌损害的患者。
1.2 治疗方法
采用随机数字表法将120例患者均分为治疗组和对照组,参照 《拯救脓毒症运动Bundle》(2018年版)上指南推荐的标准治疗方法开展常规治疗,两组患者选择广谱抗生素抗感染,早期液体复苏,积极治疗基础原发病,机械通气,应用血管活性药物,镇痛镇静,肠内营养支持及其他对症支持等治疗。治疗组患者入ICU当天,取总剂量为50 mg/(kg·d)的维生素C,均分4份,与5%的葡萄糖溶液配制成30 mL/份的混合溶液,每6 h微量泵静脉泵入,30 min内匀速输注完成,应用疗程直至患者转出ICU。对照组60例患者开展与治疗组相同的常规治疗;对照组采用相同剂量的0.9%氯化钠溶液,均分成4份,与5%的葡萄糖溶液配制成30 mL/份的混合溶液,每6 h微量泵静脉泵入,30 min内匀速输注完成,应用疗程直至患者转出ICU。
1.3 观察指标
1.3.1一般资料 收集两组患者性别、年龄、疾病谱,急性生理与慢性健康状况采用急性生理与慢性健康状况评分系统Ⅱ (APACHE Ⅱ评分)及序贯器官衰竭检测评分(SOFA)进行对比。APACHE Ⅱ评分由A、B、C项3部分组成,A项为急性生理评分(APS)共12项,前11项由临床最常用的生命体征、血常规、血生化、血气分析指标构成,第12项为格拉斯哥评分;B 项为年龄评分,44 岁以下为0 分、45~54 岁为2 分、55~64 岁为3 分、65~74 岁为 5分、75岁以上为6 分;C 项即慢性健康评分,凡有重要器官或系统功能严重障碍或衰竭的慢性疾病,如行急诊手术或未行手术治疗者加5分,择期手术者加 2分)。SOFA评分由患者氧合指数、是否进行呼吸支持、血小板数量、胆红素水平、平均动脉压、格拉斯哥评分及患者肾功能情况进行评估。
1.3.2临床效果 于治疗前、治疗2周后,根据患者基础体征和APACHE Ⅱ评分 的改善效果、机械通气时间、住院时间及28 d死亡率对两组患者临床效果进行评价。
1.3.3炎症反应指标于治疗前及治疗 2周时分别采集两组患者空腹肘静脉血5 mL,离心(离心半径3 cm,转速2 000 r/min,时间10 min)分离血清后,采用酶联免疫吸附实验法(ELISA)检测白细胞介素-6(interleukin-6、IL-6)、白细胞介素-10(interleukin、IL-10及肿瘤坏死因子-α(tumor necrosis factor-α、TNF-α)等炎症反应指标。
1.3.4氧化应激反应指标 按1.3.3项下方法采集两组患者血清标本,采用硝酸还原醇法检测一氧化氮(nitric oxide、NO)、黄嘌呤氧化酶法检测超氧化物歧化酶(superoxide dismutase、SOD)、硫代巴比妥酸法检测丙二醛(malondialdehyde、MDA)等氧化应激反应指标。
1.3.5心肌损伤标志物 按1.3.3项下方法采集两组患者血清标本,采用全自动化学发光免疫分析法检测B型脑利钠肽前体(N terminal pro B type natriuretic peptide、NT-proBNP)、抗体免疫抑制法检测肌钙蛋白 T(troponin T、cTnT)、免疫化学法检测心肌酶(creatine kinase-MB、CK-MB)等心肌损伤标志物。
1.4 统计学方法
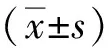
2 结果
2.1 一般资料
两组脓毒症患者性别、年龄、疾病谱、急性生理与慢性健康状况等一般病历资料比较,差异无统计学意义(P>0.05)。见表1。
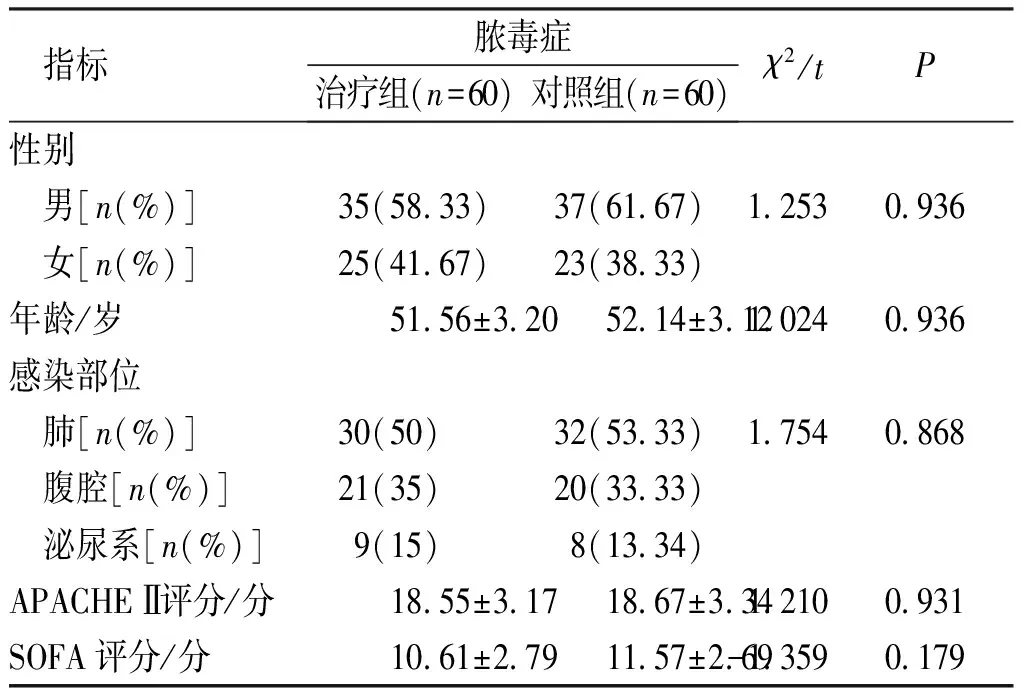
表1 两组脓毒症患者一般资料比较Tab.1 Comparison of general data of patients with sepsis between both groups
2.2 临床效果
两组患者治疗前APACHE Ⅱ评分比较,差异无统计学意义(P>0.05);治疗后,治疗组患者APACHE Ⅱ评分低于对照组,差异有统计学意义(P<0.05);治疗组在机械通气时间、住ICU时间及28 d死亡率等方面均低于对照组,差异有统计学意义(P<0.05)。见表2。
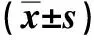
表2 两组脓毒症患者治疗后临床效果比较Tab.2 Comparison of clinical effects between both
2.3 血清IL-6、IL-10及TNF-α水平
两组脓毒症患者治疗前血清IL-6、IL-10及TNF-α比较,差异无统计学意义(P>0.05);治疗后,治疗组患者血清IL-6、TNF-α低于对照组、IL-10高于对照组,差异有统计学意义(P<0.05)。见表3。
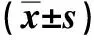
表3 两组脓毒症患者治疗前后血清IL-6、 IL-10及TNF-α水平Tab.3 Serum levels of IL-6, IL-10, and TNF-α between both groups before and after
2.4 血清NO、SOD及MDA水平
两组脓毒症患者治疗前血清NO、SOD及MDA比较,差异无统计学意义,(P>0.05);治疗后,治疗组患者血清NO、MDA均低于对照组、SOD高于对照组,差异有统计学意义(P<0.05)。见表4。
2.5 心肌损伤标志物血清NT-proBNP、cTnT及CK-MB
两组脓毒症患者治疗前血清NT-proBNP、cTnT及CK-MB比较,差异无统计学意义(P>0.05);治疗后,治疗组患者血清NT-proBNP、cTnT及CK-MB均低于对照组,差异有统计学意义(P<0.05)。见表5。
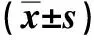
表4 两组脓毒症患者治疗前后血清NO、 SOD及MDA比较Tab.4 Comparison of serum NO, SOD, and MDA between both groups before and after
3 讨论
探讨脓毒症患者心肌损伤的病理机制,并在此基础上寻找早期预防心肌受损的治疗靶点成为目前重症医学领域研究的前沿热点。脓毒症心肌病是以左心室舒张及射血分数抑制为特点的可逆性心肌功能不全,临床上可使用超声对心脏功能做出评价,同时在脓毒症时,由于内毒素等原因可造成心肌细胞损伤,从而使得脓毒症患者血中心肌标记物升高,但其升高数值与心肌梗塞等原因导致的心肌损害有着明显差异[7]。维生素C作为人体所需
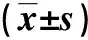
表5 两组脓毒症患者治疗前后血清NT-proBNP、cTnT及CK-MB水平Tab.5 Levels of serum Nt-probNP, cTnT, and CK-MB between two groups before and after
的微量元素,其不仅具有显着的抗氧化作用,同时也具有明显的炎症反应抑制作用,在机体多种生物合成和代谢过程中发挥了重要的参与作用[8]。从目前研究现状来看,国内外动物实验及临床基础研究中,关于维生素C对脓毒症干预效果的研究及预防心肌损伤作用机制的研究文献较少,因此本研究具有一定的创新性。在研究方法上,采用病例对照研究的设计,治疗组治疗组患者开展常规治疗+维生素C干预,对照组对照组患者开展常规治疗+0.9%氯化钠干预,研究结果显示,维生素C干预可有效改善脓毒症患者机体的氧化应激反应。在多种病理因素的相互作用下,脓毒症患者机体尤其是心肌组织中发现有过量氧自由基的产生,其激活的氧化应激反应是引起心肌细胞凋亡、坏死的重要病理条件[9];同时,大量研究报道证实,氧化应激反应是造成心血管系统结构功能异常的主要原因之一,可诱发以心肌梗死、心肌病等多种心血管疾病[10]。因此,抗氧化应激成为脓毒症患者心肌损伤干预的重要靶点。SOD为抗氧化应激指标,NO、MDA过氧化损伤指标,本研究中,治疗后治疗组患者血清NO、MDA均低于对照组(P<0.05), SOD高于对照组(P<0.05),即通过维生素C的干预可有效改善脓毒症患者机体的氧化应激反应。维生素C作为抗氧化剂已被临床熟知,而在脓毒症治疗中其抗氧化应激作用对心肌损伤的改善机理主要可以概括为以下几点:一是维生素C可通过对内皮型一氧化氮合酶(eNOS)活性的增强,促进机体内皮型NO的大量生成,从而提高血管内皮功能,预防心肌损伤;二是维生素C可通过对毛细血管内皮细胞信号通路的调节而对机体氧化损伤发挥抑制作用,并保护血管内皮细胞,预防心肌损伤;三是维生素 C可通过对内源性血管活性物质合成的促进,抑制血管内皮细胞的凋亡,危害心血管系统结构的正常,预防心肌损伤[11-12]。
维生素C干预可有效改善脓毒症患者机体的炎症反应。临床上,随着脓毒症病情的发展,激发“炎症因子风暴”, 炎症细胞因子对机体整体及心肌局部组织的浸润,激活肌成纤维细胞,导致心肌组织不良的纤维化重塑,成为心肌细胞凋亡及心肌损伤的重要病理途径[13]。IL-6、TNF-α为反映机体炎症反应的重要细胞因子,而IL-10为抗炎细胞因子,本研究中,治疗后;治疗组患者血清IL-6、TNF-α均低于对照组(P<0.05), IL-10高于对照组(P<0.05),即维生素C干预可有效改善脓毒症患者机体的炎症反应。脓毒症患者特异性的免疫抑制是导致机体免疫失调及炎症反应加剧的重要因素,而维生素C不仅具有抗感染及抑制炎症反应的作用,且能够通过对机体细胞免疫的调节而发挥抗炎作用[14]。因此,脓毒症患者通过维生素C的早期干预可有效抑制机体炎症反应,改善心肌损伤。
维生素C干预可有效改善脓毒症患者的心肌损伤,提高临床治疗效果。NT-proBNP是心肌细胞在应激刺激下产生的心脏激素,是诊断心肌损伤最广泛的生物标志物;cTnT是评估心肌损伤的“金标准”;CK-MB是诊断心肌功能的重要指标。本研究中,治疗后治疗组患者血清NT-proBNP、cTnT、CK-MB均低于对照组(P<0.05)。且治疗组患者在临床效果:机械通气时间、住ICU时间及28 d死亡率等方面优于对照组(P<0.05)。即脓毒症患者在维生素C的干预下,可通过对氧化应激反应及炎症反应的对抗而预防、改善心肌损伤,促进临床治疗效果得到有效提高[15-16]。
综上,在脓毒症治疗中实施维生素C干预可有效提高临床疗效,减轻患者心肌损伤,其作用机制或与维生素C的抗炎及抗氧化应激作用机理有关。



