席敏, 李小多, 孙广, 张海龙, 谢南子, 周琴,, 蒋红梅, 张云东*
(1.贵州医科大学 医学检验学院, 贵州 贵阳 550000; 2.安顺市人民医院 医学检验科, 贵州 安顺 561000; 3.安顺市人民医院 病理科, 贵州 安顺 561000)
宫颈癌(cervical cancer, CC)是女性常见的恶性肿瘤,其发病率与死亡率在全球女性肿瘤中排名第4[1]。在中国,CC发病率在女性肿瘤中位居第2,每年约有新发病例13万,占世界CC新发病例的28%[2]。虽然我国占全世界CC的比例有的下降,但因人口基数大、筛查普及率低,CC仍然严重威胁着我国女性健康[3]。CC的发生、发展与人乳头瘤病毒(human papilloma virus, HPV)感染、多个性伴侣等因素有关[4],但其中HPV病毒感染是引起宫颈病变的最重要因子。根据致癌潜力,将HPV病毒分为高危型和低危型[5],流行病学与分子证据表明,高危型HPV(high risk HPV, HR-HPV)持续性感染是宫颈高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL)及CC主要致病因素[6]。女性一生均有机会感染HPV,当免疫力低下时,机体不容易清除病毒,会造成持续性感染,从而进展为宫颈病变,导致HPV分型检测、液基薄层细胞学(thinprep cytologic test, TCT)、阴道镜及组织病理学活检均可能有异常病理现象[7]。HPV感染有地域性特点,有荟萃分析显示,我国HPV感染最常见的类型HPV16、HPV18、HPV52、HPV53及HPV58[8];Chen等[9]研究结果显示贵州省HPV感染的类型依次为HPV52、HPV16、HPV58、HPV53及HPV39;约70%的CC由HPV16、HPV18型感染引起[10]。但在中国,CC前病变及CC中常见的类型为HPV16、HPV52及HPV58[11]。因此,HPV52和HPV58型感染在宫颈病变地位逐渐凸显出来。流行病学研究表明,HPV病毒突变在不同的地理位置和人群不同[7, 12],HPV52型有A、B、C及D四个谱系,B谱系主要分布在亚洲,C系在美洲和亚洲相对较多,D系在亚洲和非洲较少[13]。HPV不同谱系与不同突变导致宫颈病变的风险不同,HPV52型B系与宫颈高级别病变相关[14]。HPV的E6、E7区是主要的致癌因子,目前研究主要集中于HPV16和HPV18型E6、E7区核苷酸多态性,HPV52、HPV58主要分布于中国[15],但目前关于HPV52和HPV58型E6、E7区单核苷酸多态性(single nucleotide polymorphism,SNP)情况研究较少。本研究通过分析贵州省安顺地区HPV流行病学特征及HPV52、HPV58型的E6、E7区的SNP,以期为本地区HPV的感染防治、高级别宫颈病变筛查与诊断及针对性的疫苗研究提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1标本来源 选取2020年6月—2021年12月医院门诊、住院及体检患者中行HPV分型检测者,要求采样前24 h无性生活、非月经期及采样前3 d未冲洗阴道与阴道内用药。共纳入检测者10 774例,年龄15~86岁、平均(41±10.94)岁,取所有受检者宫颈脱落细胞作为细胞标本来源,取其中HR-HPV阳性且有组织病理学活检指征的298例受检者的宫颈组织为组织标本来源。本研究获得医院伦理委员会批准(〔2022〕专6号)。
1.1.2主要试剂与仪器 HR-HPV分型核酸测定试剂盒(深圳亚能生物有限公司);实时荧光定量PCR仪(瑞士罗氏公司),HPV杂交仪(深圳亚能生物有限公司),干式金属浴恒温器(西安天隆科技有限公司),漩涡振荡器(江苏康健医疗用品有限公司),高速离心机(美国Thermo Fisher)。
1.2 研究方法
1.2.1HPV DNA提取 专业妇科医生使用专用样本刷取所有检测者宫颈脱落细胞,保存于专用细胞保存液样本管中,标本采集后保存于2~8 ℃,24 h内完成检测。使用漩涡振荡器充分震荡摇匀标本细胞保存液,使宫颈脱落细胞充分混匀于细胞保存液中,一次性吸管吸取液体0.5 mL转移至 1.5 mL EP 管中,13 000 r/min离心10 min;吸掉上清液,沉淀物中加 HPV-DNA裂解液50 μL,充分混匀,100 ℃金属浴10 min;13 000 r/min离心10 min,保留上清液待用。
1.2.2聚合酶链式反应(polymerase chain reaction,PCR)扩增 HPV反应试剂取出恢复室温,取出PCR扩增试剂,900 r/min离心10 s,移液枪转移至PCR仪配套的8联管中,做好标记,加HPV DNA上清液5 μL,每次实验各设置1个阴性质控与阳性质控,900 r/min离心10 s,进行PCR扩增。扩增条件设置:50 ℃ 15 min、 95 ℃ 10 min、 94 ℃ 30 s 、42 ℃ 90 s、 72 ℃ 30 s ,72 ℃ 5 min ,共循环40次。
1.2.3变性、杂交及结果判读变性 95 ℃预变性10 min,转入冰水混合物中放置5 min,置于2~8 ℃冰箱中备用。扩增产物变性之后在按照HPV杂交仪标准操作程序完成,基本步骤:杂交→洗膜→孵育→摇洗→洗膜→显色→判读。阴性对照膜条的内标(internal control,IC)出现蓝色斑点,阳性对照膜条在相应HPV基因型位点与IC点均出现蓝色斑点,以及标本对应的每一张膜条IC位点出现蓝色斑点,表明本次实验有效。可检测17种高危型:HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV53、HPV56、HPV58、HPV59、HPV66、HPV68、HPV73及HPV82;6种低危型:HPV6、HPV11、HPV42、HPV43、HPV81、HPV83。
1.2.4组织病理学活检 取HR-HPV阳性且有组织病理学活检指征受检者的宫颈组织标本进行苏木精-伊红染色(hematoxylin and eosin staining,HE)。阅片由2位中级以上临床病理医师共同阅片,按照2014年WHO女性生殖系统肿瘤标准分为正常或慢性炎症、子宫颈低级别鳞状上皮内瘤变[low-grade squamous intraepithelial lesion,LSIL,即原宫颈上皮内瘤变1(cervical intraepithelial neoplasia,CIN1)]、HSIL(原CIN2 和部分 CIN3)及 CC(鳞癌、腺癌)[16]。
1.2.5基因测序 取“1.2.1”项下已提取好的HPV52、HPV58型DNA,低温冰冻运输至生工生物工程(上海)股份有限公司进行测序分析。使用 Snapgene 将测序获得的 HPV52、HPV58型单一阳性样本E6基因和 E7基因序列与HPV52、HPV58 参考序列(HPV52 GenBank 登录号NC_001592;HPV58 GenBank 登录号 D90400.1)进行比对,分析序列突变情况与氨基酸变异情况。采用 MEGA11软件的 Align by ClustalW 对本研究中获得的 E6/E7 基因变异组序列与 HPV52 E6/E7变异谱系的参考基因组序列进行比对,参数设置为默认值。HPV52参考基因组序列:A1为X74481,A2为HQ537739,B1为HQ537740,B2为HQ537743,C1为HQ537744,C2为HQ537746,D为HQ537748[17]。HPV58型参考基因组序列:A1为D90400.1;A2为:HQ537752,A3为HQ537758,B1为537762,B2为537764,C为537774,D1为537768,D2为537770[17]。邻接法构建系统发育树,参数设置选择 Kimura2-parameter 模型,Bootstrap 值为1 000,其他参数设置为默认值。PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/)在线预测氨基酸序列二级结构。
1.3 统计学分析
采用SPSS 23.0对数据进行统计分析,计数资料用例数(百分比)[n(%)]表示。
2 结果
2.1 HR-HPV感染的一般特点
HPV分型检测患者中HR-HPV感染阳性2 194例,阳性率为20.36%(2194/10774);以单一感染为主(14.0%,1509/10774),混合感染占6.36%(685/10774);HR-HPV感染亚型分布结果显示(图1),由高到低依次为HPV52(6.11%)、HPV16(3.59%)、HPV58(3.04%)、HPV53(2.31%)及HPV51(1.95%)。
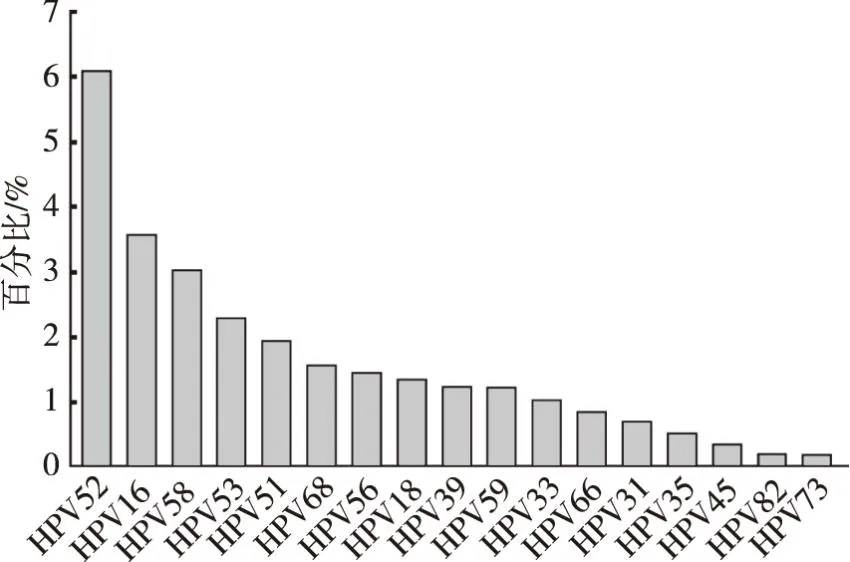
图1 HPV分型检测者的HR-HPV亚型分布Fig.1 HR-HPV subtype distribution of HPV typed tester
2.2 HR-HPV感染的年龄特点
HR-HPV分型检测者中年龄≤20岁组HR-HPV感染阳性率最高(36.36%),其次是年龄>61岁组(32.30%)。见表1。
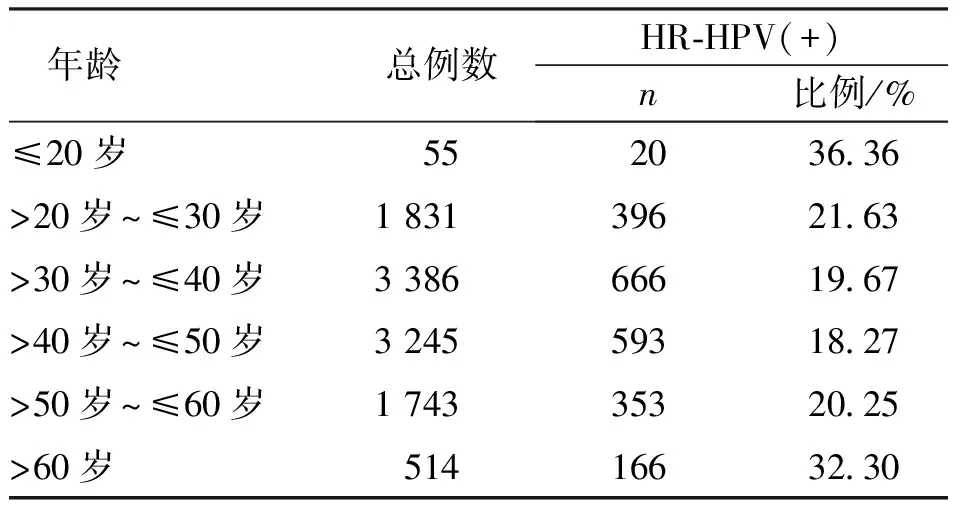
表1 HPV分型检测者中HR-HPV感染分布的年龄特点Tab.1 Age characteristics of the distribution of HR-HPV infection in HPV testing
2.3 HR-HPV感染的宫颈病变类型特点
选取同时行HPV分型检测与组织病理活检的检测者298例,宫颈病变中HR-HPV阳性最多的为HPV16型94例(CC 46例、HSIL 43例及LSIL6例),依次为HPV52型49例(CC 8例、HSIL 33例及LSIL8例)、HPV58型34例(CC 5例、HSIL 23例及LSIL3例)及HPV18型18例(CC 8例、HSIL 9例及LSIL8例)。见表2。
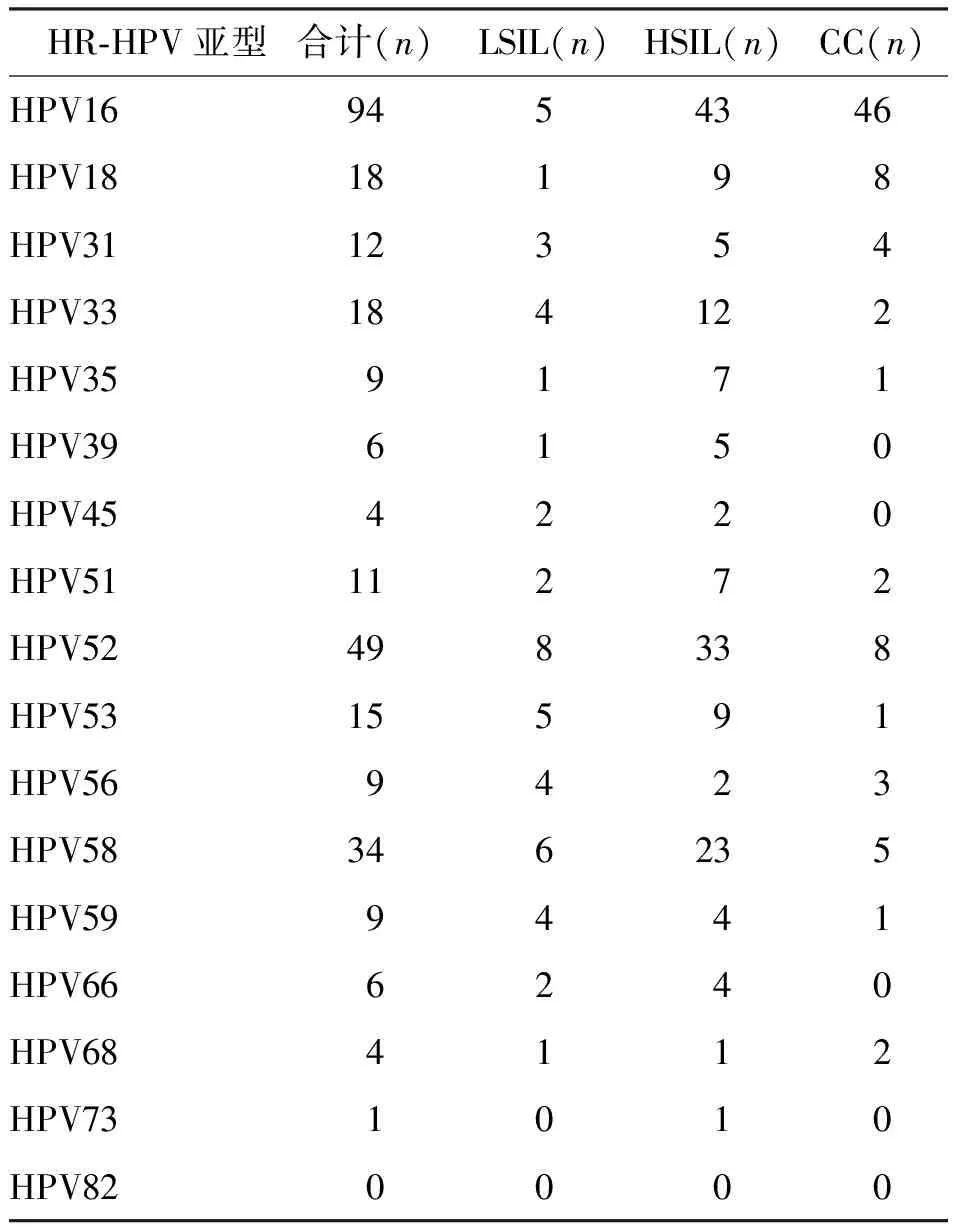
表2 HPV分型检测者中 HR-HPV感染的宫颈病变类型特点Tab.2 Characteristics of cervical lesion types of HR-HPV infection in HPV typing subjects
2.4 HPV52型E6、E7区的基因序列分析
根据测序结果,与 HPV52 型参考序列(NC_001592)比对结果显示,HPV52 E6/E7 基因突变率为 100.00%(30/30)。根据 E6/E7 基因序列突变差异性分组,30条序列被分为 6 个不同的变异组(52AS01~52AS06),52AS01基因突变组分布频数最高66.67%(20/30),其次是52AS02基因突变组20%(6/30)。E6基因共有7个单核苷酸突变,A125T、A294G是新的突变位点,A294T(M65G)、A378G、置前(K93G)、A379G(K93R)是非同义突变,其余突变位点是同义突变,突变位点最高的是G350T、A379G,突变率为100.00%(30/30);E7基因共有3个单核苷酸突变,均为同义突变,其中突变频率最高的位点是C751T、A801G ,突变率为100.00%(30/30),T666C是一种新的突变。E6、E7序列氨基酸二级结构未发生突变。见表3。
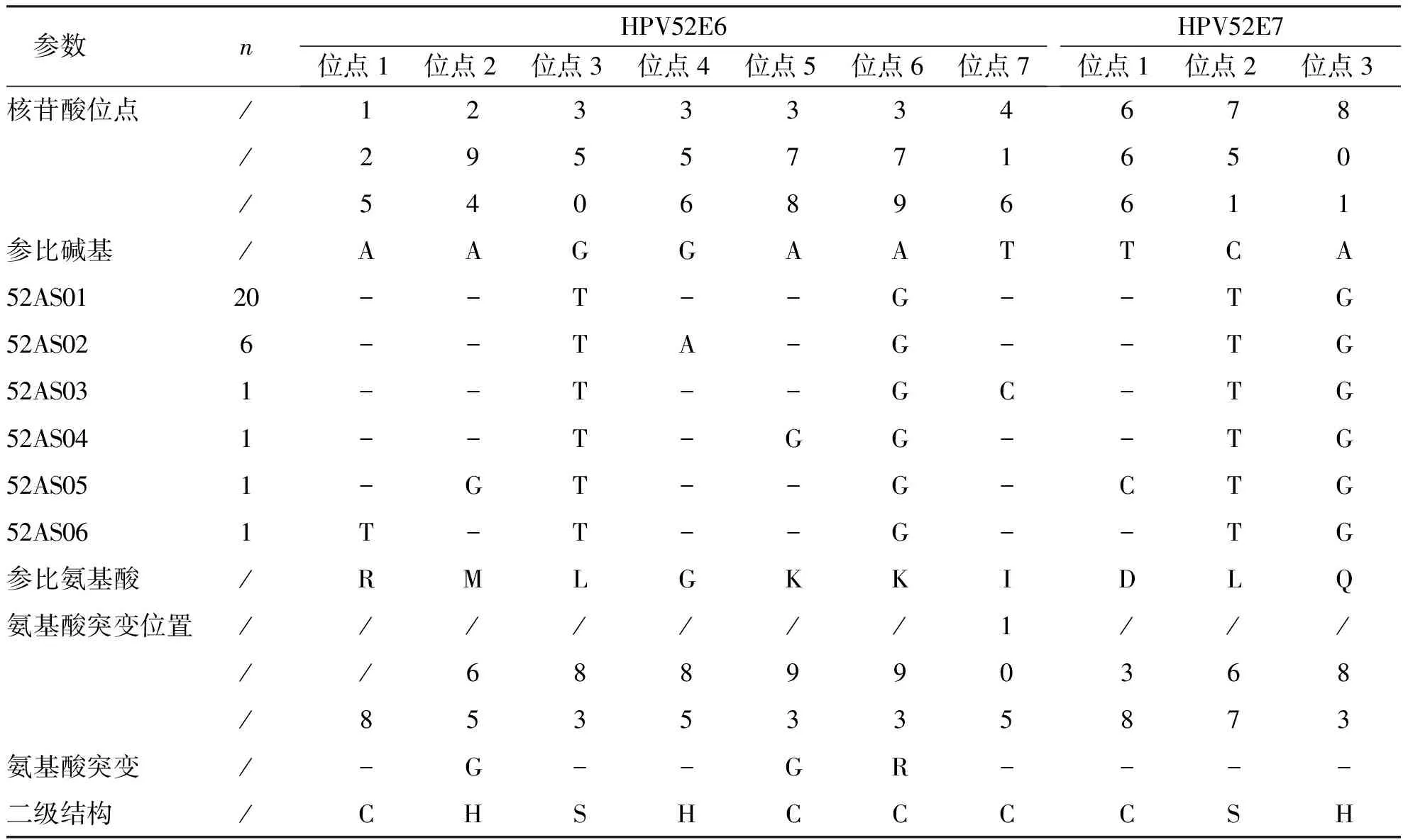
表3 HPV52 E6/E7 核苷酸突变及氨基酸二级结构预测分析Tab.3 Analysis of HPV52 E6/E7 nucleotide mutations and amino acid secondary structure prediction
2.5 HPV58型 E6、E7区基因序列分析
根据测序结果,与 HPV58型 参考序列(D90400.1)比对结果显示,有6例HPV58型序列未发生突变,HPV58 E6/E7 基因突变率为 72.72%(16/22)。根据 HPV58型E6/E7 基因序列突变差异性分组,22条序列被分为 7 个不同的变异组(58AS01~58AS06),58AS01基因突变组分布频数最高37.5%(6/16),其次是58AS02基因突变组18.75%(3/16)。E6基因共有3个单核苷酸突变,C321T、A388C是非同义突变,突变位点最高的是C307T,突变率为62.5%(10/16);E7基因共有8个单核苷酸突变,C632T、G694A、G760A、G761A、T803C、G806A为非同义突变,其中突变频率最高的位点是T744G突变率为81.25%(13/16),其次是G694A、G761A突变率为37.5%(6/16)。E6、E7序列氨基酸二级结构未发生改变。见表4。
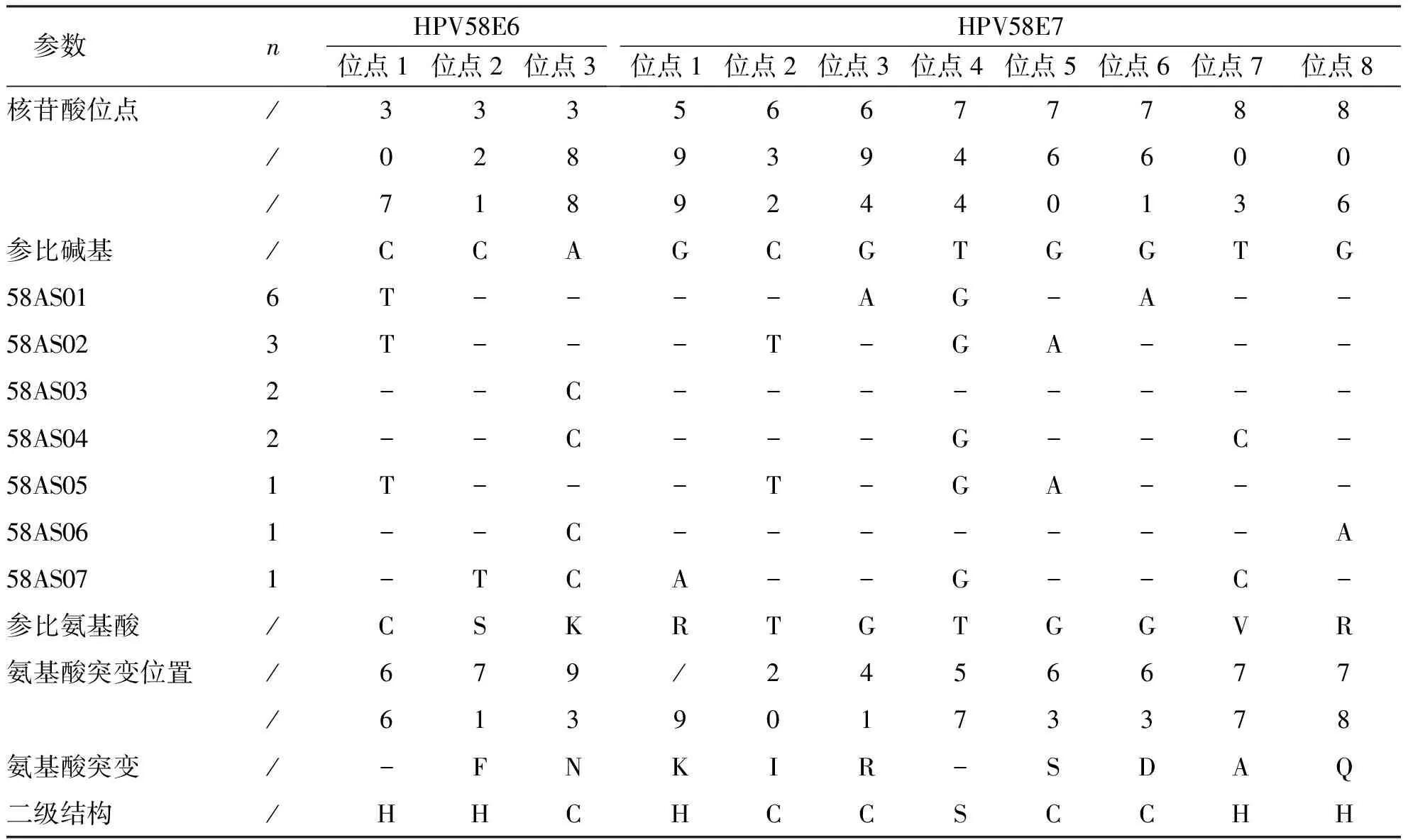
表4 HPV58 E6/E7 核苷酸突变分析及氨基酸二级结构预测分析Tab.4 Analysis of HPV58 E6/E7 nucleotide mutations and predicted amino acid secondary structure
2.6 系统进化树
基因序列系统发育树结果表明(图2),安顺地区 HPV52型 E6/E7 基因突变序列均分布于B谱系,未检测到 A、C及D谱系;安顺地区 HPV58 型E6/E7 基因突变序列均分布于A谱系,未检测到 B、C 及D谱系。
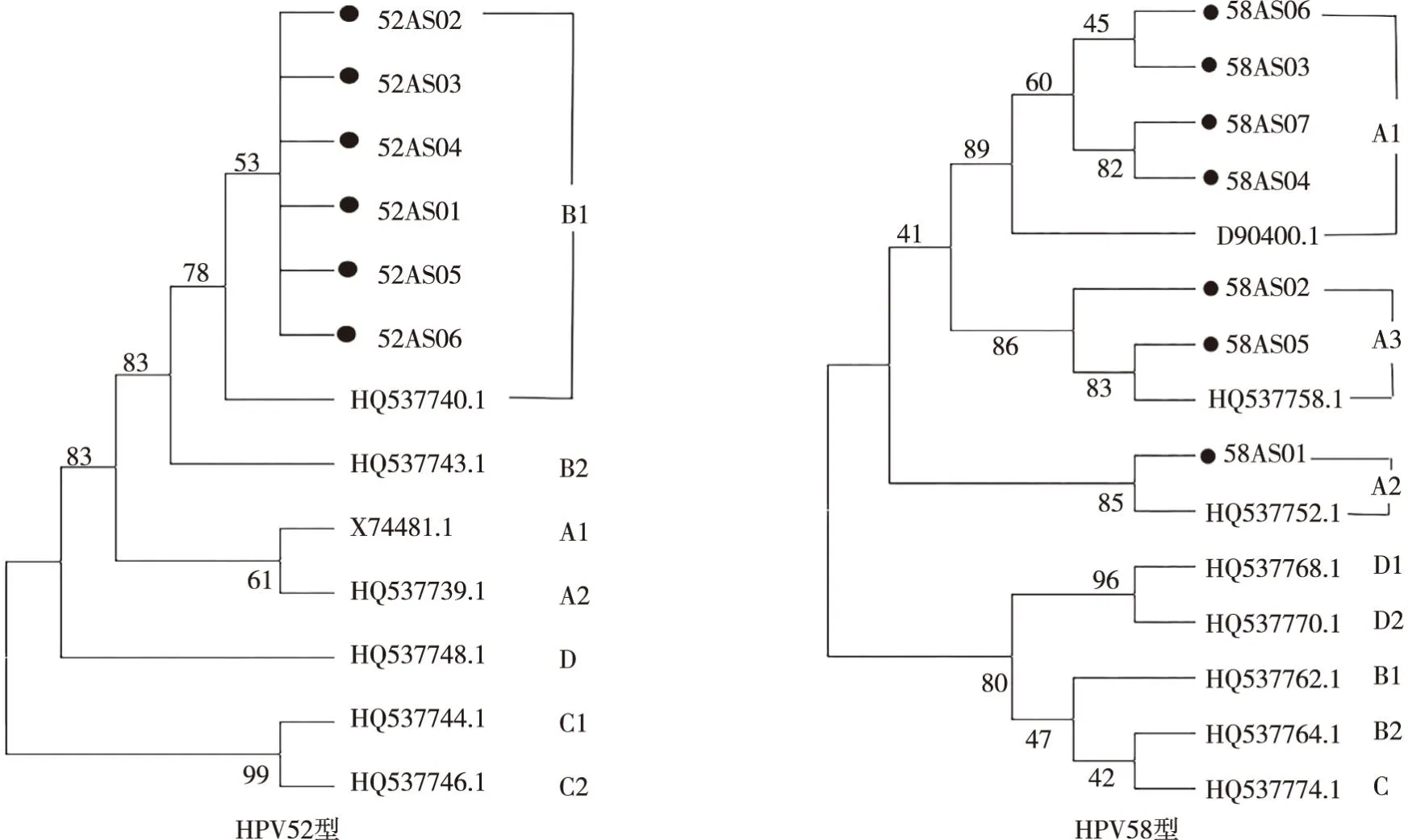
注:圆点表示HPV52、HPV58突变不同序列,其余为相应不同的参考序列。
3 讨论
CC的发生发展是由CC前病变逐渐演变而来,由癌前病变发展大约10年时间,这个时间窗为早期筛查和临床干预提供了黄金时机[18]。约99%的CC合并HR-HPV感染[19]。大量队列研究已证实,HPV-DNA分型检测是用于细胞学阶段主要的筛查手段[20]。
本研究结果显示,本地区HR-HPV感染以单一感染为主,感染阳性率20.36%,较本省HPV感染率15.37%偏高[9]。可能与本研究纳入的人群主要是门诊患者有关。HPV感染频数依次为 HPV52、HPV16、HPV58、HPV53及HPV51,与本省的HPV感染优势型别HPV52、HPV16、HPV58、HPV53、HPV59基本一致[9],提示本地区CC疫苗接种应以覆盖这几型为主。HR-HPV感染年龄感染呈U字形分布,阳性率最高的为≤20岁组,可能与该年龄免疫系统尚未完全建立,以及性生活过早导致一过性感染;其次>60岁组,可能与该阶段患者免疫能力下降,对HPV病毒清除能力下降。考虑该年龄阶段免疫状况,所以该年龄阶段女性需要加强筛查。
本地区检测者HR-HPV基因型主要是HPV16、HPV52、HPV58及HPV18型。HPV16型是宫颈病变的最主要致病亚型,HPV52、HPV58型是宫颈病变中次之的优势型别,这与贵阳地区其他研究结果基本一致[21]。王丽等[22]也报道HPV16、HPV52、HPV58型感染与宫颈病变密切相关。美国阴道镜病理学会建议,HPV16、HPV18型阳性者直接转入阴道镜检查,而HPV52、HPV58型阳性者结合TCT检查异常时,被建议转入阴道镜检查并取组织活检进行病理诊断,因此,对于HPV52、HPV58型既是本地区感染的优势型别同时又是宫颈病变的危险型别,建议本地区HPV52、HPV58型感染人群应作为重点关注人群,加强筛查管理,避免漏诊及延缓诊断。
HPV16、HPV18型是已经明确了的CC的主要致病因子,因此,本研究只选取安顺地区流行的HPV52和HPV58型病例样本进行E6/E7基因测序,期望找到其在本地区致癌力强的原因。结果显示,HPV52型E6区的A125T、A294G 是新发现的突变,最常见的突变A379G(K93R)是非同义突变,其K93R与宫颈高级别病变有关[23-24],而E7区的T666C也是一个新发现的突变位点。HPV58型的E6、E7区均未发现新的突变位点,但是其突变的频率较高,16例发现突变位点,共发现11个核苷酸突变位点。其中HPV58型在E7区,非同义突变C632T(T20I)/G760A(G63S)会导致较高风险患CC[25]。HPV基因突变序列有地域性差异,本地区HPV52型突变序列均属于B2系,未发现A、C、D系,HPV58型基因序列均分布于A系,亦有研究表明,与A系相比,B系会增加罹患CC的风险[26]。因此,本地区HPV52和HPV58型导致CC风险较高,可能与本地区HPV52、HPV58 E6/E7区单核苷酸突变有关。
本研究HPV52、HPV58型基因测序样本量少,虽不能完全代表本地区SNP与流行株的谱系分布,但能一定程度上体现本地区HPV基因多态性,后续研究中还需要收集大量样本进行测序,为本地区的HPV感染防治和CC的预防提供帮助。



