刘文瞻,蔡启亮,吴宝军,杨思维,姚智力,侯泽楷,孙彬栩
前列腺癌已成为欧美国家男性最常见的泌尿生殖系统肿瘤[1-2],在我国呈逐年快速升高趋势[3]。雄激素在前列腺癌的发生和进展过程中发挥重要作用,而雄激素剥夺治疗被认为是前列腺癌的标准药物疗法[4]。尽管各种内分泌治疗药物不断更新,但经过18~36个月内分泌治疗后,大多数患者仍将逐渐发展为去势抵抗性前列腺癌[5],且长期服药造成了身体不良反应不断加重[6]。中草药中的单体物质研究已成为抗癌药物研究的热点[7]。染料木黄酮是大豆提取物中的主要活性成分之一,已被证实具有雌激素样活性,可调节细胞周期、诱导细胞凋亡、调节信号通路以及抗肿瘤作用[8-10]。目前,染料木黄酮在前列腺癌中的作用研究报道较少,染料木黄酮抑制前列腺癌细胞增殖、迁移和转移的具体机制尚未完全阐明。本研究拟探讨染料木黄酮对前列腺癌细胞增殖、迁移和侵袭能力的影响及其具体分子机制。
1 材料与方法
1.1 主要材料与试剂 前列腺癌细胞株LNCaP 和CWR22RV1 购自中国科学院上海生命科学研究院细胞资源中心;染料木黄酮购于Sigma-Aldrich,纯度≥98%;RPMI 1640培养基、胎牛血清(FBS)、胰蛋白酶购自美国GIBCO BRL 公司;兔抗人E-钙黏蛋白(E-Cadherin)、N-钙黏蛋白(NCadherin)、波形蛋白(Vimentin)、CD44、Oct4、GAPDH 单克隆抗体和辣根过氧化物酶(HRP)标记的羊抗兔二抗购自英国Abcam 公司;Transwell 小室购自美国Corning Incorporated 公司;倒置显微镜购自日本OLYMPUS公司;MTT试剂盒购自美国Ameresco公司;酶标仪购自美国Bio-Tek公司,蛋白电泳仪购自美国Bio-Rad公司。
1.2 细胞培养与分组 LNCaP和CWR22RV1细胞接种于含10%FBS的RPMI 1640培养基中,置于5%CO2和37 ℃孵育箱中贴壁培养。细胞生长至融合度为85%时传代,稳定传3代后,取对数生长期细胞进行实验。细胞分为对照组(RPMI 1640常规培养)和实验组(50 μmol/L染料木黄酮处理)。
1.3 噻唑蓝(MTT)法检测细胞增殖抑制情况 对数生长期的2 组细胞经胰蛋白酶消化后,用含10%FBS 的RPMI 1640重悬细胞,调整成单细胞悬液。以2×104个/孔的密度将上述细胞接种于96 孔培养板中,每孔加入MTT 溶液20 μL,培养4 h 后弃培养液,每孔加入150 μL DMSO,室温避光孵育10 min后用酶标仪检测各孔490 nm波长处光密度(OD)值。
1.4 细胞划痕实验检测各组细胞迁移 取对数生长期的LNCaP 和CWR22RV1 细胞接种至12 孔板内,使细胞增殖至融合度为90%,使用无菌0.2 mL移液器套头笔直在细胞上划出一条痕,用PBS清洗3次去除细胞碎片。实验组加入1 mL含50 μmol/L 染料木黄酮的RPMI 1640 培养基,对照孔中加入不含染料木黄酮的RPMI 1640 培养基。在划痕后0 h 和72 h 拍照,在每条伤痕上随机取3 个地方,用Image-Pro Plus软件测量直径后取平均值,计算创面闭合指数。创面闭合指数=(0 h直径-72 h直径)/0 h直径×100%。
1.5 Transwell 实验检测各组细胞侵袭 将对数生长期的LNCaP 和CWR22RV1 细胞饥饿孵育24 h,加胰酶消化,用无血清的RPMI 1640 培养基稀释使其细胞为5×105个/mL。实验组Transwell上室以基质胶包被后加入200 μL含50 μmol/L染料木黄酮的单细胞悬液,下室加入600 μL含20%FBS的完全培养基,对照组上室加入200 μL单细胞悬液。置于37 ℃、5%CO2、95%湿度的恒温培养箱中培养24 h,取出小室,弃去旧的培养基,PBS多次润洗,4%多聚甲醛溶液固定30 min,结晶紫避光染15 min,PBS再次润洗,用棉签拭去小室内未穿过膜的细胞。在显微镜下随机读取5个视野观察并拍照,计数穿膜细胞,取平均值,实验重复3次。
1.6 Western blot 检测E-Cadherin、N-Cadherin、Vimentin、CD44、Oct4 蛋白表达 2 组细胞分组处理72 h 后用PBS 清洗,加入裂解液和蛋白酶抑制剂的混合物,冰上裂解30 min,收集细胞于EP 管。4 ℃下12 000×g离心20 min,取上清液。BCA 法测定蛋白定量,定量后分装保存于-80 ℃待用。制备SDS-聚丙烯酰胺凝胶并以恒压80 V,20 min后120 V 进行蛋白分离电泳1 h,100 V 恒压湿转1.5 h,PVDF 膜浸入5%脱脂奶粉中封闭,室温缓慢振荡1 h;TBST 洗膜3 次,每次5 min;加入一抗(兔抗人E-Cadherin、N-Cadherin、Vimentin、CD44、Oct4、β-actin、GAPDH 单克隆抗体,均按1∶1 000 稀释),4 ℃摇床孵育过夜;隔日,TBST 洗膜3 次,每次5 min;加入二抗(1∶4 000)室温孵育1.5 h;HRP 标记的羊抗兔IgG 二抗(1∶3 000)孵育1 h,TBST洗膜3次,每次10 min;凝胶成像仪曝光成像,Image J 软件进行灰度分析,以目的条带灰度值和βactin、GAPDH 条带灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.7 统计学方法 采用SPSS 22.0 进行数据分析,符合正态分布计量资料以均数±标准差(±s)表示。2组间均数比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 染料木黄酮对前列腺癌细胞增殖的影响 MTT 检测结果显示,实验组LNCaP 和CWR22RV1 细胞经染料木黄酮处理24、48、72 h 后,细胞增殖活性低于对照组(P<0.05),见表1。
Tab.1 Effect of genistein on proliferative activity of LNCaP and CWR22RV1 cells表1 染料木黄酮对LNCaP和CWR22RV1细胞增殖活性的影响(n=3,OD490,±s)
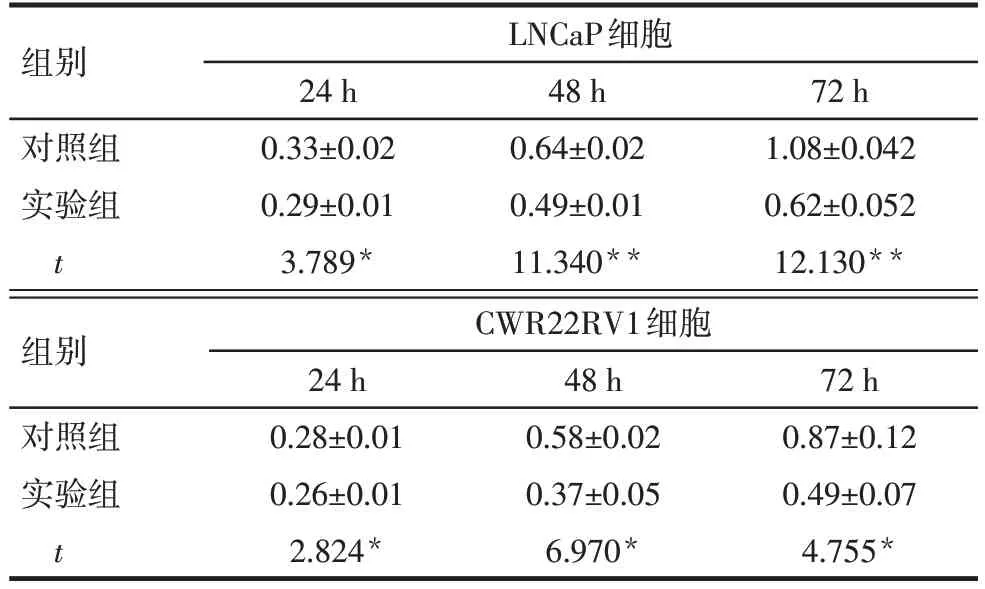
Tab.1 Effect of genistein on proliferative activity of LNCaP and CWR22RV1 cells表1 染料木黄酮对LNCaP和CWR22RV1细胞增殖活性的影响(n=3,OD490,±s)
*P<0.05,**P<0.01。
组别对照组实验组t LNCaP细胞24 h 0.33±0.02 0.29±0.01 3.789*48 h 0.64±0.02 0.49±0.01 11.340**72 h 1.08±0.042 0.62±0.052 12.130**组别对照组实验组t CWR22RV1细胞72 h 0.87±0.12 0.49±0.07 4.755*24 h 0.28±0.01 0.26±0.01 2.824*48 h 0.58±0.02 0.37±0.05 6.970*
2.2 染料木黄酮对前列腺癌细胞迁移能力的影响 在LNCap 和CWR22RV1细胞中,实验组的划痕愈合指数(%)较对照组下调(LNCap:18.32±4.28vs.62.54±11.69,n=3,t=6.152,P<0.01;CWR22RV1:21.38±6.74vs.67.39±15.41,n=3,t=4.738,P<0.01),见图1。

Fig.1 Effect of genistein on migration of LNCaP and CWR22RV1 cells图1 染料木黄酮对LNCaP 和CWR22RV1细胞的迁移的影响
2.3 染料木黄酮对前列腺癌细胞侵袭的影响 在LNCaP 细胞中,实验组的穿膜细胞数较对照组减少(单位:个/视野,130.67±13.05vs.255.67±14.57,n=3,t=11.068,P<0.01),在CWR22RV1 细胞中,实验组的穿膜细胞数亦较对照组减少(177.33±13.05vs.336.67±10.26,n=3,t=16.622,P<0.01),见图2。
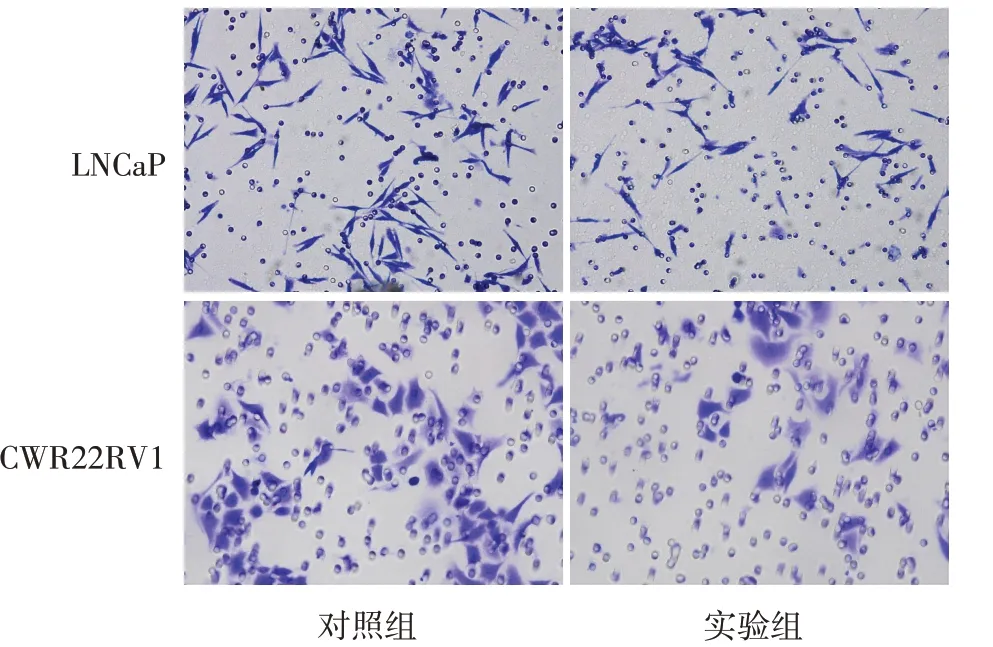
Fig.2 Effect of genistein on invasion of LNCaP and CWR22RV1 cells(crystal violet staining,×200)图2 染料木黄酮对LNCaP和CWR22RV1细胞侵袭的影响(结晶紫染色,×200)
2.4 染料木黄酮抑制上皮间质转化(EMT)过程及肿瘤干细胞的表达 Western blot 结果显示,在LNCap 和CWR22RV1 细胞中,与对照组相比,实验组间质细胞的标志物N-Cadherin、Vimentin 水平下调,上皮细胞标志物E-Cadherin表达上调,肿瘤干细胞的标志物CD44 与Oct-4 的蛋白表达水平下调。见图3、表2。

Fig.3 Changes of protein expression of E-Cadherin,N-Cadherin,Vimentin,CD44 and Oct-4 in LNCap and CWR22RV1 cells in each group图3 各组LNCap、CWR22RV1细胞中E-Cadherin,N-Cadherin,Vimentin,CD44、Oct-4的蛋白表达变化
Tab.2 Comparison of protein expressions of E-Cadherin,N-Cadherin,Vimentin,CD44 and Oct-4 in LNCaP and CWR22RV1 cells between the four groups表2 各组LNCaP和CWR22RV1细胞E-Cadherin、NCadherin、Vimentin、CD44和Oct-4蛋白表达水平比较(n=3,±s)

Tab.2 Comparison of protein expressions of E-Cadherin,N-Cadherin,Vimentin,CD44 and Oct-4 in LNCaP and CWR22RV1 cells between the four groups表2 各组LNCaP和CWR22RV1细胞E-Cadherin、NCadherin、Vimentin、CD44和Oct-4蛋白表达水平比较(n=3,±s)
*P<0.05,**P<0.01。
组别对照组实验组t LNCap细胞CD44 0.99±0.10 0.52±0.02 7.742**Oct-4 1.00±0.10 0.61±0.03 6.173**E-Cadherin 1.00±0.04 2.10±0.31 5.931**N-Cadherin 1.00±0.06 0.38±0.07 10.595**Vimentin 1.00±0.11 0.42±0.09 6.646**组别对照组实验组t CWR22RV1细胞CD44 1.00±0.14 0.48±0.04 6.024**Oct-4 0.99±0.09 0.38±0.03 10.879**E-Cadherin 0.99±0.11 1.87±0.15 7.757**N-Cadherin 0.99±0.04 0.46±0.04 14.541**Vimentin 0.99±0.04 0.50±0.10 7.732**
3 讨论
染料木黄酮的抗肿瘤作用已在宫颈癌、卵巢癌、肾癌以及肝癌中得到证实[11-13]。本研究结果表明,染料木黄酮能够抑制去势抵抗性前列腺癌细胞LANCaP 及CWR22RV1 的增殖能力,这与李飞等[14-15]的研究结果一致。此外,本研究通过细胞划痕和Transwell 侵袭实验进一步证实,染料木黄酮能够抑制前列腺癌细胞的迁移和侵袭能力。这与高晓康等[16]报道的染料木黄酮能够抑制肿瘤细胞增殖能力的结果一致。综合上述文献报道及本研究结果表明,染料木黄酮能够抑制前列腺癌的细胞增殖,从而抑制前列腺癌的进展和转移。
前列腺癌发生进展机制复杂,前列腺癌侵袭和转移过程中伴随EMT[17-18]。本研究发现,经染料木黄酮处理的前列腺癌LNCaP 和CWR22RV1 细胞中EMT重要相关蛋白发生了变化:间质蛋白标志物NCadherin、Viminten 表达降低,上皮蛋白标志物ECadherin表达增加。由此提示染料木黄酮能够抑制EMT 过程,从而抑制前列腺癌细胞的侵袭和转移。曹玉霖等[19]报道染料木黄酮可以通过PI3K/AKT 途径抑制雄激素非依赖性LNCaP 细胞的增殖。李飞等[15-16]研究发现,染料木黄酮能够通过抑制雄激素受体信号通路来抑制前列腺癌细胞增殖。由此可知,染料木黄酮对前列腺癌的侵袭和转移的抑制是多途径、多机制的。本研究着重探讨了染料木黄酮对前列腺癌EMT的抑制作用,对于染料木黄酮在前列腺癌进展过程中发挥作用的详细机制,待以后的研究深入探讨。
前列腺癌干细胞具有自我更新和多分化潜能,被认为是导致内分泌治疗失败的根源[20]。前列腺癌干细胞在功能和生物学特点与EMT细胞部分相似,并且这些功能和生物学特点在肿瘤的发生、发展及转移过程中发挥重要作用[21]。本课题组前期研究证实,CD44+肿瘤细胞较CD44-细胞具有更高的克隆形成和成瘤能力,转化生长因子(TGF)-β 可通过上调CD44的表达来下调E-Cadherin,同时上调Vimentin,从而促进前列腺癌EMT[22]。Zhang 等[23]研究发现,染料木黄酮可通过调控Hedgehog-Gli1信号通路影响前列腺癌细胞的干性。本研究使用染料木黄酮处理LNCaP和CWR22RV1细胞后,发现肿瘤干细胞的标志物CD44及Oct-4的表达均降低,说明染料木黄酮能够减少前列腺癌肿瘤干细胞的形成,从而抑制前列腺癌的进展。
综上,染料木黄酮能够通过抑制EMT过程和降低肿瘤细胞干性来抑制前列腺癌的进展和转移。



