章 颖 明 芳 章幼奕 张晓芳
慢加急性肝衰竭是在慢性肝病基础上,由各种原因引起的肝功能急剧恶化,以黄疸、凝血功能障碍、肝性脑病、腹水等为主要临床表现,预后较差,病死率为30%~60%[1-2]。血浆置换现已成为治疗肝衰竭的重要手段[3]。准确评估肝衰竭患者疾病的严重程度,有助于预测病死率,指导选择治疗方案。本研究回顾性分析147例经内科综合治疗和血浆置换治疗的慢加急性肝衰竭患者的临床资料,探讨血清标志物和临床评分对患者预后的预测价值。
1 对象与方法
1.1 研究对象 收集2015年1月—2019年7月南通市第三人民医院收治的慢加急性肝衰竭患者临床资料,共有147例患者入院后经过内科综合治疗和血浆置换治疗,其中男108例、女39例,年龄为(56.14±13.09)岁。入选患者资料完整且至少随访3个月,均符合2012和2018年版肝衰竭诊治指南中的诊断标准[1-2]。排除标准:①合并其他系统(心脏、脑、肺等)原发严重疾病;②合并原发性肝癌等恶性肿瘤;③合并血液系统疾病;④妊娠;⑤肝移植术后;⑥资料缺失或失访者。
1.2 治疗方法 所有患者予保肝、降胆红素、白蛋白(Alb)或血浆支持、营养支持、防治并发症、人工肝血浆置换血支持等。人工肝血浆置换支持,首次治疗予留置股静脉单针双腔导管,每次置换同血型新鲜冰冻血浆3 000 mL左右,每2~5 d 1次,治疗次数2次以上,治疗过程严密监测患者的生命体征。
1.3 疗效判断标准 临床好转应符合以下条件:①乏力、纳差、腹胀、出血等临床症状明显好转,肝性脑病消失;②黄疸、腹水等体征明显好转;③肝功能指标明显趋向正常水平[总胆红素(TBil)<5倍正常上限,凝血酶原活动度(PTA)>40%或者INR<1.5)。临床恶化应符合以下情况之一:①乏力、纳差、腹胀、出血等临床症状和体征加重;②肝功能指标恶化;③新发并发症和(或)肝外脏器功能衰竭,或原有并发症加重[1-2]。根据患者治疗后3个月的生存状态,分为生存组和死亡组。
1.4 观察指标 入院时(血浆置换前)检测患者肝肾功能、电解质、凝血功能、甲状腺激素、血脂等实验室指标,包括ALT、AST、Alb、TBil、血肌酐(sCr)、INR、血钠、TSH、T4、FT4、T3、FT3、TG、高密度脂蛋白(HDL)、TC、低密度脂蛋白(LDL)、载脂蛋白A(apoA)、载脂蛋白B(apoB)等。根据公式分别计算出终末期肝病模型(MELD)、联合血钠的MELD(MELD-Na)评分。MELD评分=3.8×ln[TBil(mg/dL,1 mg/dL=17.1 μmol/L)] +11.2 ×ln (INR) +9.6×ln [sCr(mg/dL,1 mg/dL=88.4 mmol/L)]+6.4×病因(淤胆性或酒精性为0,其他为1),结果按科学计数法取整数[4]。MELD-Na评分=MELD评分+1.59(135-血钠),血钠取值范围为120~135 mmol/L(<120 mmol/L记为120 mmol/L,>135 mmol/L记为135 mmol/L,120~135 mmol/L按实际数据计算)[5]。
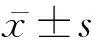
2 结 果
2.1 一般资料 病因为乙型肝炎病毒感染110例、丙型肝炎病毒感染7例、酒精性12例、自身免疫性9例、隐源性9例。生存组71例,男53例、女18例,年龄为(53.62±14.02)岁;死亡组76例,男55例、女21例,年龄为(58.45±11.85)岁。两组间年龄、性别构成、AST、sCr、FT4的差异均无统计学意义(P值均>0.05);死亡组Alb、血钠、TSH、T4、T3、TG、HDL、TC、LDL、apoA、apoB均显着低于生存组(P<0.01或0.05);死亡组FT3、TBil、INR、MELD评分、MELD-Na评分均显着高于生存组(P<0.05或0.01)。见表1。
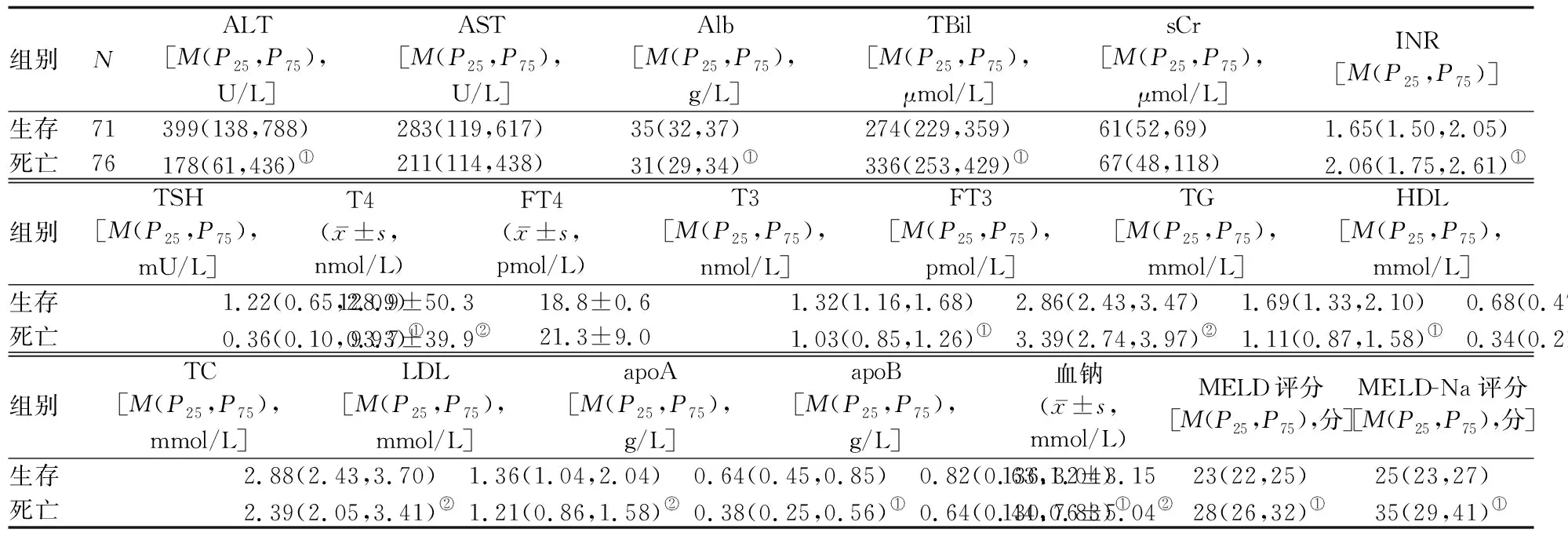
表1 147例肝衰竭患者中生存组和死亡组相关血清标志物和临床评分的比较
2.2 各血清标志物和临床评分预测慢加急性肝衰竭患者短期预后的效能分析 TSH、T4、T3、TG、HDL、apoA、MELD评分、TSH+T3、TG+apoA、TSH+T3+TG+apoA的AUC均>0.7~0.9。MELD-Na评分、TSH+T3+MELD-Na,TG+apoA+MELD-Na,TSH+T3+TG+apoA+MELD-Na的AUC均>0.9,预测效果更佳。见表2。
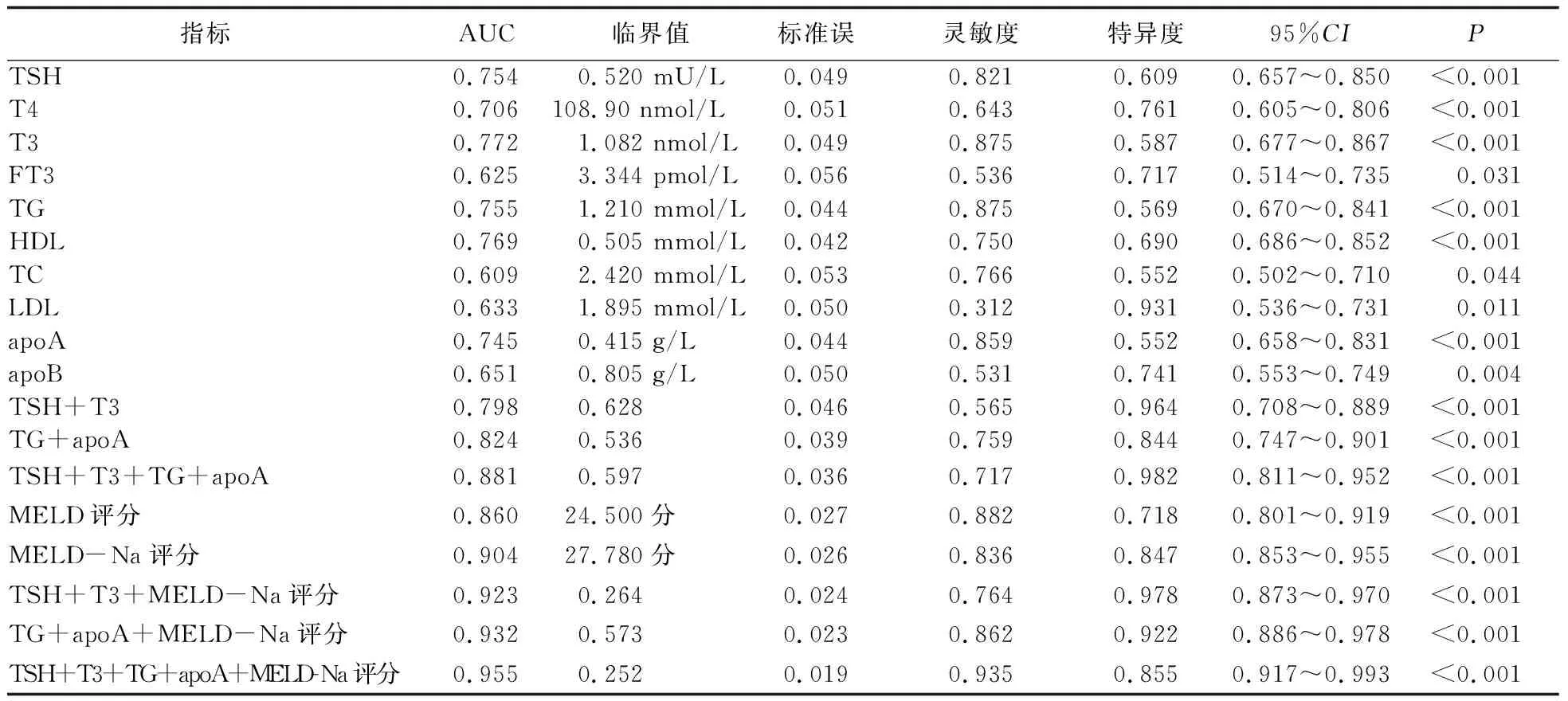
表2 甲状腺激素、血脂水平、MELD-Na等ROC曲线结果
2.3 各血清标志物和临床评分多因素logistic回归分析 当TSH、T3、TG、apoA值越小,MELD、MELD-Na评分越高,慢加急性肝衰竭患者短期死亡风险越高(P<0.05或0.01)。见表3。

表3 甲状腺激素、血脂水平、MELD-Na评分多因素logistic回归分析
3 讨 论
目前,慢加急性肝衰竭的治疗措施主要包括内科综合治疗、人工肝血浆置换支持治疗和肝移植,但该病进展迅速,并发症复杂多样,总体预后不佳,病死率高,故早期准确地判断和评估肝衰竭的病情和预后对临床治疗方案的选择至关重要[6-7]。
甲状腺激素与肝脏密切相关,肝脏在甲状腺激素代谢中起以下重要作用。①参与T4的脱碘反应。约80%~90%的T3是由T4经脱碘作用生成,肝细胞微粒体存在两种脱碘酶,即外环5’-脱碘酶和内环5’-脱碘酶,前者作用于T4使其转化为有生物活性的T3,后者作用于T4使其转化为无生物学活性的γT3[8-9];肝功能受损时可出现低T3和高γT3情况。丁蕊等[10]研究发现,低T3综合征为慢加急性肝衰竭患者短期病死的重要预测因素。本研究结果显示,肝衰竭死亡组血清T3显着低于生存组,ROC曲线分析提示T3的AUC为0.772,其临界值为1.082 nmol/L,相应灵敏度为0.875,特异度为0.587,具有较好的预测价值;多因素回归分析提示,其为肝衰竭患者短期预后的预测因子,T3值低,提示预后不佳。②合成甲状腺激素合成蛋白。肝脏为T4、T3、γT3提供3种蛋白载体, 即甲状腺素结合球蛋白(TBG)、甲状腺素结合前白蛋白(TBPA)和Alb,肝功能受损时可出现FT3、FT4水平升高。金宏慧等[11]研究结果表明,肝衰竭MELD评分与FT3、FT4呈正相关。本研究结果显示,肝衰竭死亡组FT3水平高于生存组,但AUC<0.7,临床应用价值不高。③结合与水解T3、T4,形成甲状腺激素的肠肝循环,构成血浆甲状腺激素可变总量的一部分。肝衰竭时下丘脑-垂体-甲状腺轴功能调节障碍[12],TSH水平是监测下丘脑-垂体-甲状腺功能的一项敏感指标,有研究[13-14]认为,TSH为肝衰竭预后的保护因素。本研究结果显示,肝衰竭死亡组TSH水平显着低于生存组,ROC曲线分析提示TSH的AUC为0.754,临界值为0.520 mU/L,灵敏度为0.821,特异度为0.609;多因素回归分析提示,TSH是肝衰竭患者短期预后的预测因子,TSH水平低,提示预后不佳;TSH联合T3预测价值更高,ROC曲线的AUC为0.798。
肝脏是人体脂类合成和代谢的主要场所,血浆中TG来源主要有两种,外源性TG来源于食物摄取;内源性TG的主要合成部位在肝脏。肝脏亦是氧化TG的重要器官。肝衰竭时食欲减退,肝脏合成TG减少,TG氧化受抑制,有研究[15]发现,重症肝炎时TG水平较正常对照组下降了43%。体内70%~80%的胆固醇由肝脏合成,同时肝脏也是胆固醇转化和代谢的场所。蒋彬等[16]研究结果表明,胆固醇水平与肝衰竭患者的预后密切相关,胆固醇水平越低,患者预后越差。约90%的HDL由肝脏合成,HDL含有能够激活卵磷脂胆固醇酰基转移酶(LCAT)的apoA1;apoA1是apoA中含量最多的一种,主要功能是促进胆固醇酯化和HDL的成熟,参与胆固醇的逆向转运[17]。多因素回归分析提示,apoA、TG均为肝衰竭短期预后的预测因子,apoA、TG水平低,提示预后不佳。TG联合apoA的AUC为0.824,临床预测价值均较高。
MELD评分是根据患者TBil、sCr、INR和肝病病因计算出的评分,能很好地反映患者肝病严重程度,可对终末期肝病短期、中期病死率进行有效的预测[18-19]。MELD-Na评分是在MELD评分基础上结合血钠得出的评分系统。李磊等[20]研究结果表明,MELD-Na评分可用于判断肝衰竭患者短期预后,其分值越高,提示预后不佳。本研究发现肝衰竭死亡组MELD-Na评分显着高于生存组,MELD-Na评分的AUC为0.904,临界值为27.780分,灵敏度为0.836,特异度为0.847;多因素回归分析提示其为影响肝衰竭患者短期预后的影响因素。多种甲状腺激素、血脂分析、MELD-Na评分联合应用预测价值更高。
综上所述,甲状腺激素、血脂水平、MELD-Na评分与慢加急性肝衰竭短期预后密切相关,TSH、T3、TG、apoA水平越低,MELD-Na评分越高,提示慢加急性肝衰竭预后不佳。上述几种甲状腺激素、血脂水平、MELD-Na评分可作为监测肝脏损害程度和评价预后的有效指标。



