梅金平,周 欣,姬文婕,马永强,杨国红,郭兆增,李玉明,赵季红
·基础医学论着////研究·
基于流式细胞术的小鼠血小板聚集率检测方法评价及川芎嗪的干预作用
梅金平1,周 欣2,姬文婕2,马永强2,杨国红2,郭兆增2,李玉明2,赵季红2
目的评价一种新的基于流式细胞术(Flow cytom etry,FCM)小鼠血小板聚集活性检测方法,以及川芎嗪的干预作用。方法CD61-PE和CD61-FITC标记的小鼠血小板(n=5)混合后加入ADP(终浓度20μmol/L)诱导血小板聚集,同时标记两种荧光染料的细胞群占所有血小板的百分比来评估血小板聚集功能;16只雄性C57BL/6J小鼠随机分为生理盐水组和氯吡格雷组, FCM检测小鼠血小板聚集功能;FCM检测川芎嗪(TMPZ)低、中、高浓度(终浓度分别为0.5 mg/ml、1 mg/ml、2 mg/ml)和替罗非班(终浓度为5μg/ml)对小鼠血小板聚集功能的影响。结果经ADP(终浓度20μmo l/L)诱导激活后含有双色荧光标记的细胞群即血小板聚集体明显增多(P<0.01);FCM检测小鼠服用氯吡格雷后其血小板聚集率显着降低[由(19.57±1.12)%降至(8.71± 1.21)%,P<0.01];与生理盐水组相比,TMPZ低、中、高剂量和替罗非班均能显着降低小鼠血小板聚集率(P<0.05)。结论基于流式细胞术的小鼠血小板聚集活性检测方法能够准确反映P2Y12受体拮抗剂、GPⅡb/Ⅲa受体阻断剂以及川芎嗪的抗血小板活性,对于血小板相关基础研究和抗血小板药物筛选平台具有借鉴价值。
血小板聚集;流式细胞术;川芎嗪;小鼠
血小板在生理性止血、维持血管壁完整以及某些病理过程,如血栓形成、动脉粥样硬化、不稳定型心绞痛、肿瘤转移和炎症反应等过程中起着重要作用[1]。因此,血小板功能检测对早期发现是否有血栓形成以及与血小板相关疾病的诊断和治疗有着重要的意义[2,3]。小鼠作为模式生物之一,除了和人类有着极为相似的生理解剖结构和胚胎发育过程,其与人类基因序列的同源性高达80%[4],因此可以利用小鼠作为动物模型来研究抗血小板药物对机体的影响[5]。但检测小鼠血小板功能的方法却鲜有报道。2013年国外学者报道了一种基于流式细胞术(flow cytom etry,FCM)检测血小板聚集率的新方法[6]。本研究对其方法进行改进,以期评价基于FCM法检测临床常见抗血小板药物以及川芎嗪(TMPZ)对小鼠血小板聚集功能的影响。
1 材料与方法
1.1 材料 SPF级C57BL/6J小鼠,体质量为20 g~ 30 g,购自北京维通利华实验动物技术有限公司;二磷酸腺苷(Adenosine acid,ADP,Sigma公司,美国);流式抗体:抗CD61-FITC、抗CD61-PE(Bio legend公司,美国);盐酸川芎嗪(哈尔滨三联药业有限公司);注射用盐酸替罗非班(山东新时代药业有限公司);硫酸氢氯吡格雷[75 mg,赛诺非安万特(杭州)制药有限公司];HEPES/tyrode’s bu ffe r、酸性柠檬酸葡萄糖溶液B(ACD),参照相关文献配制[7];红细胞裂解液(1× RBC美国);流式细胞仪FC 500(美国);振荡混匀器(IKA公司,德国)。
1.2 方法
1.2.1 流式细胞术检测小鼠血小板聚集率 按照每40μL全血加入ACD 40μL,HEPES/tyrode’s bu ffer 80μL的比例制备全血稀释液;C57BL/6J小鼠(n=5)通过颌下静脉丛取血,静脉血滴入EP管后迅速用微量移液器取出40μL。将稀释的全血等分成4份,分别加入标记为T1、T2、T3、T4的EP管,T1、T3管中分别各加入CD61-PE 0.24μL+cell staining bu ffer 5 μL,T2、T4管中分别各加入CD61-FITC 0.24μL+ cell staining bu ffer 5μL,室温避光孵育15 min;将T1、T2中的样品加入标记为F1的EP管中(作为基线组);T3、T4中的样品加标记为F2的EP管中。F1中加入生理盐水0.8μL,F2中加入ADP 0.8μL(终浓度为20μm ol/L),将F1、F2两管插入涡旋器中,37℃,避光涡旋(800 r/min)10 min,以激活血小板;将500μL红细胞裂解液加入F1、F2管中,室温避光孵育10 min后上机检测;上机检测方法如下:①FITC、PE双色荧光染料经488 nm激发光激发后,分别产生波长为525 nm、572 nm的荧光,分别用Cytom ics FC 500流式细胞仪的FL1、FL2两个通道收集荧光信号;②使用前向散射光(FSC)和侧向散射光(SSC)二维散点圈定血小板门;③以CD61-FITC为横坐标,以CD61-PE为纵坐标建立CD61-FITC和CD61-PE散点图;④检测CD61-PE和CD61-FITC双阳性细胞群占全部血小板的比例[Q 2/(Q 1+Q 2+Q 4)×100%,如图1],即为血小板聚集率。每份标本检测15 000~20 000个血小板表面的特异荧光讯号。小鼠经ADP诱导的血小板聚集率应为其经ADP诱导后的血小板聚集率与基线组血小板聚集率的差值。
1.2.2 FCM检测氯吡格雷对小鼠血小板聚集率的影响 16只雄性C57BL/6J小鼠随机分为生理盐水组和氯吡格雷组,每组8只;氯吡格雷组给予氯吡格雷盐水混合液11.26 mg/(kg·d)灌胃[按人与动物用药剂量换算公式:小鼠剂量(mg/kg)=9.01×成人氯吡格雷剂量(75 mg)/成人体重(60 kg)计算得出];生理盐水组给予生理盐水溶液0.01 ml/(g·d)灌胃。每日1次,共7 d;第7天灌胃后1 h采血,按方法1.2.1检测小鼠血小板聚集率。
1.2.3 FCM检测川芎嗪和替罗非班体外对小鼠血小板聚集功能的影响 40只小鼠随机分为生理盐水组、TMPZ低剂量组、TMPZ中剂量组、TMPZ高剂量组、替罗非班组,每组8只。对每组进行血样采集并荧光标记,生理盐水组、TMPZ低剂量组、TMPZ中剂量组、TMPZ高剂量组和替罗非班组分别加入生理盐水3 μL、TMPZ 3μL(终浓度为0.5 mg/ml)、TMPZ 3μL(终浓度为1 mg/ml)、TMPZ 3μL(终浓度为2 mg/ml)和替罗非班3μL(终浓度为5μg/ml),37℃避光孵育5min后,分别用ADP(终浓度为20μg/ml)对每组进行激活并上机检测。
1.2.4 统计学处理 采用Flow Jo 7.6.1软件分析流式细胞术检测结果,采用G raph pad Prism 5.0软件对数据统计分析。数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间差别比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 FCM测定小鼠血小板聚集率 FCM分析加入ADP前后的标本(见图1),以FSC和SSC参数设定血小板门,以CD61-FITC和CD61-PE参数分析血小板细胞群中血小板聚集情况:图1A表示未加ADP血小板分布,Q 1细胞群为PE标记的血小板,Q 4细胞群为FITC标记的血小板,Q2细胞群为聚集的血小板。图1B表示ADP活化后血小板的分布,可见加入ADP后,Q1、Q 4细胞群明显减少,而Q2细胞群明显增多,直观地表明血小板发生了聚集。小鼠(n=5)经ADP (终浓度为20μg/ml)激活后其血小板聚集率明显上升(P<0.01)(如图2)。
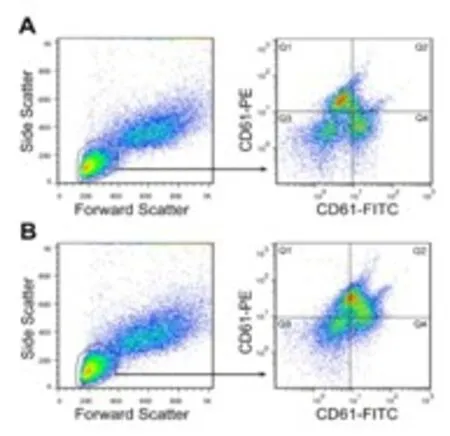
图1 FCM检测小鼠血小板聚集率
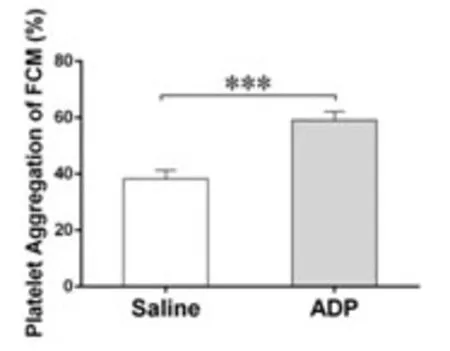
图2 FCM检测经ADP诱导血小板聚集率
2.2 FCM检测氯吡格雷体内对小鼠血小板聚集率的影响 灌胃7 d后,与生理盐水组相比,服用过氯吡格雷小鼠血小板聚集率显着降低[由(19.57±1.115)%降至(8.711±1.211)%,P<0.01]。详见图3A。
2.3 FCM检测TMPZ和替罗非班体外对小鼠血小板聚集率的影响 小鼠全血体外经TMPZ和替罗非班干预后,FCM检测其血小板聚功能明显降低(P<0.05),并且川芎嗪对ADP(终浓度20μm o l/L)诱导的小鼠血小板聚集呈浓度依赖性抑制作用(如图3B)。
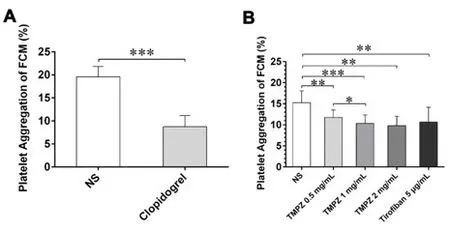
图3 FCM检测抗血小板药物对小鼠血小板聚集率的影响
3 讨 论
随着后基因组研究时代的到来,以及精确定点遗传操作技术的建立,小鼠已成为解析人类基因功能最重要的模式生物,是研究人类疾病发病机制的理想模型,也是进行新药研发的一个很好载体[4]。本研究中采用荧光标记的抗CD61特异性单克隆抗体标记小鼠血小板,在FCM分析时能特异地识别几乎所有的血小板[3,8]。两种不同荧光标记的血小板混合时,在ADP的作用下,血浆纤维蛋白原和血管性假血友病因子(vWF)以“桥链”的作用导致相邻的血小板发生聚集反应,当FCM检测到含有两种荧光微粒时,即为血小板聚集体(如图1)中Q 2细胞群,通过分析Q 2细胞群占所有的血小板细胞群(Q 1+Q 2+Q 4)的比率来评估血小板聚集功能[6]。氯吡格雷为口服抗血小板药物,需在体内通过肝细胞P450转化成活性代谢产物发挥作用。其活性产物与血小板膜表面二磷酸腺苷(ADP)受体P2Y12结合,使纤维蛋白原无法与糖蛋白Ⅱb/Ⅲa受体结合,使其失去“桥链”作用,抑制血小板相互聚集[9,10]。替罗非班在体外即可直接通过阻止纤维蛋白原与糖蛋白Ⅱb/Ⅲa结合,而阻断血小板的交联及相互聚集[11,12]。本研究中经FCM检测小鼠服用氯吡格雷和替罗非班干预后其血小板聚集率明显降低[3]。TMPZ系从活血化瘀中药川芎中分离提纯的一种生物碱单体,低剂量的TMPZ通过调节TXA2/PG I2平衡来影响血小板功能并呈量效关系,而高剂量的TMPZ主要是抑制血小板与其表面糖蛋白Ⅱb/Ⅲa互相结合而抑制血小板聚集[13]。本研究检测结果与相关文献报道一致[13]。基于FCM法检测小鼠血小板聚集功能,能够较为准确地反映临床常见抗血小板药物以及川芎嗪的抗血小板活性。
光学比浊法(LTA)是临床常见的检测血小板聚集功能的方法,但此方法需要提取血小板,样本经离心、洗涤等过程势必会造成人为血小板体外活化,且检测所需的血样本量大(3 ml~4 ml)、重复性差、检测时间久等,这些原因严重限制其临床应用[14]。FCM检测小鼠全血中血小板,使血小板更接近生理状态;所需血样本量少(每次检测只要40μL);无需提取血小板,整个操作过程中没有离心、涡旋、震荡等致使血小板体外医源性激活的过程,防止血小板亚群丢失,在检测过程中不会受其他种类细胞或碎片的干扰,保证了检测的特异性[15];FCM检测不受血液浊度影响;无放射性污染;由于FCM检测时间短、灵敏度高,尤适用于血小板减少症的研究[16]。但FCM也有不足之处:其检测结果不能像聚集仪动态分析血小板聚集的过程;流式抗体以流式细胞仪较为昂贵,尚不能作为常规应用。
本研究系统评价一种新的基于FCM的小鼠血小板聚集活性检测方法,该方法能够较为准确地反映P2Y12受体拮抗剂、GPⅡb/Ⅲa受体阻断剂和中药川芎嗪的抗血小板作用。该方法的建立为临床抗血栓治疗、指导临床用药、筛选、开发新的抗血小板药物等研究提供了重要依据。
[1] Leslie M.Beyond c lotting:The powe rs of p la te lets[J].Science, 2010,328(5978):562-564.
[2] Pe llaton C,Eeckhou t E,Silvain J,et al.Cardiology platelet function testing for c linicians[J].Rev Med Suisse,2014,10(412-413):24-31.
[3] Sinha l AR,Aylward PE.New antip late let agents and the role of platelet function testing in acute coronary syndromes[J].Clin Ther, 2013,35(8): 412 413):1064 1068.
[4] Mouse Genome Sequencing Consortium,Waterston RH,Lind-520-562.
[5] Schm itt A,Guichard J,Masse JM,et al.of m ice and m en: Comparison of the u ltrastructure of megaka ryocytes and p latele ts[J].Exp Hem atol,2001,29(11): blad-Toh K,et al.Initia l sequencing and compara tive analysis of the mouse genom e[J].Nature,2002,420(6915):1295-1302.
[6] De Cuyper IM,Meinders M,Van De Vijve r E,et al.A novel flow cytom etry–based p la tele t aggregation assay[J].Blood,2013, 121(10):e70-e80.
[7] Moo re C,Eme rson M.Assessment of p la tele t aggregation responses in vivo in the mouse[J].Methods Mo l Biol,2012,788: 21-28.
[8] Hen ry M,Davidson L,Cohen Z,et al.Who le blood agg rega tion, coagulation,and ma rke rs of p late let activation in die t-induced diabe tic c57b l/6jm ice[J].Diabetes Res Clin Pract,2009,84(1): 11-18.
[9] Seidel M,W inning J,Claus RA,et al.Bene ficial effect of clop-i dogrel in a mouse model of polym icrobia l sepsis[J].J Thromb Haemost,2009,7(6):1030-1032.
[10] Simon T,Ve rstuyft C,Mary-Krause M,et al.Genetic dete rm-inants of response to clopidog rel and cardiovascula r events[J]. N Eng l JMed,2009,360(4):363-375.
[11] Puri A,Bansal A,Narain VS,et al.Com pa rative assessment of p latelet GPⅡb/Ⅱa recepto r occupancy ratio with ep tifiba tide/ tirofiban in patients presenting with acs and unde rgoing pci[J]. Ind ian heart J,2013,65(2):152-157.
[12] Turkm en S,Fettser DV,Kagliian KE,et al.e ffect of in tracorona ry and intravenous administration of tirofiban loading dose in pa tients underwent percutaneous coronary inte rventions because of acute corona ry synd rome[J].Kardiologiia,2013,53 (1):23-27.
[13] Sheu JR,Kan YC,Hung WC,et al.Mechanism s involved in the an tip latelet activity of te trame thylpyrazine in hum an platelets[J]. Thromb Res,1997,88(3):259-270.
[14] Gorog DA,Fuster V.Plate let function tests in clinical ca rdio logyunfulfilled expectations[J].J Am CollCardiol,2013,61(21): 2115-2129.
[15] 余晖,高晓阳.全血法流式细胞术检测血小板相关抗体[J].细胞与分子免疫学杂志,2010,26(12):1296-1297.
[16] Van Blade l ER,Laa rhoven AG,Van De r Heijden LB,et al.Functiona l p la te le t defects in children with severe chronic itp as tested with 2 novel assays app licable for low p latelet counts[J]. Blood,2014,123(10):1556-1563.
A Novel Flow Cytometr y-based Mouse Platelet Aggregation Method and Its App lication for Accessing the Effects of Tetramethylpyrazine
Mei Jinping,Zhou Xin,JiWen jie,Ma Yongqiang,Yang Guohong,Guo Zhaozeng,Li Yuming,Zhao Jihong Graduate School,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China; Corresponding Author:Zhao Jihong(Tianjin Key Laboratory of Cardiovascu lar Rem odeling and Target Organ In jury,Institute of Card-i ovascular Disease and Heart Center,Ping jin Hospital,Logistics University of the Chinese Peop le’s Armed Police Forces,Tianjin 300162,China)
ObjectiveTo evaluate a novelmethod based on flow cytometry to assess mouse platelet aggregation and the effects of tetramethylpyrazine(TMPZ)on mouse platelet.MethodsPlatelets from the same mouse whole blood context(n=5)were labeled with CD61-PE or CD61-FITC,and were ana lyzed for the form ation of double-co lored aggregates by flow cytom etry afterm ixing and upon appropriate stimu lation with ADP(20μm ol/L).16 m ale C57BL/6Jm ice were randomly divided into 2 groups of norma lsa line group and clopidogrel group.The p latelet aggregation was measured by FCM after 7 days of drug administration.Whole C57BL/6J m ouse blood intervened by TMPZ was divided into 3 subgroups:low(0.5 mg/ml),m idd le(1 mg/ml)and high concentration(2 mg/ ml)and tirofiban(5μg/ml)group.Mouse plateletaggregation was tested by FCM.ResultsUpon stimulation with ADP the percentage of double-colored events increased over time and their forward scatter/side scatter positioning shifted significantly com pared with sing le p latelets(P<0.01).Mouse p late let aggregation after oral c lopidogre lwas significantly reduced from(19.57±1.12)%to (8.71±1.21)%(P<0.05).Mouse whole b lood was intervened by low,m idd le and high doses of TMPZ and tirofiban,and the m ouse p latelet aggregation rate dropped significantly com pared with that in the norm a l saline group(P<0.05).Conc lusionThe FC M-based method of evaluating p latelet aggregation can show the activities of P2Y12 recep tor antagonist,GPⅡb/Ⅲa recep tor antagonist and TMPZ,and this is potentially very relevant for both the study of p latelet and for the screening studies of the development of novelhemostatic drugs.
platelet aggregation;flow cytometry;mouse;tetramethylpyrazine
R285
A
10.3969/j.issn.1672-1349.2015.05.010
1672-1349(2015)05-0585-04
2015-01-05)
(本文编辑 王雅洁)
国家自然科学基金(No.81170238);武警后勤学院院级科研基金(No.FYM 201104,WHM 201218)
1.天津中医药大学研究生院(天津300193),E-m ail:m eijinp ing2007@163.com;2.武警后勤学院附属医院心脏医院,武警部队心血管病研究所,天津市心血管重塑与靶器官损伤重点实验室
赵季红,E-m ail:zjhw j@126.com



