,,,
目前缺血性心脏病的治疗取得了很大的进展,但是心衰作为各种心血管疾病的终末期表现,仍是心血管疾病高病死率和高致残率的主要原因。曲美他嗪作为一种新型的心肌代谢类药物,无论动物实验和临床试验均表明其对急、慢性心肌缺血有保护作用。本研究旨在评价曲美他嗪对心肌梗死后心衰大鼠心功能及心肌超微结构的影响。
1 资料与方法
1.1 动物 健康雄性SD大鼠50只(体重200 g~250 g),购自北京维通利华实验动物有限公司[许可证号:SCXK(京)2012-0001],由中国中医科学院广安门医院伦理委员会监督。分笼饲养于中国中医科学院广安门医院SPF级动物房,自然光照,饲以标准的大鼠合成饲料,自由饮用纯净水,环境温度(25±2)℃,相对湿度(45%~70)%。
1.2 仪器 HP 5500彩色多普勒超声显像仪(PHILIPS,America);HX-200动物呼吸机(成都泰盟科技有限公司,中国);BL-820S 生物机能实验系统(成都泰盟科技有限公司,中国);SIM-F124制冰机(SANYO,Japan);MLS-3750高压蒸汽灭菌器(SANYO,Japan);BA110S千分位电子天平(Sartorius AG,German);ASP200S脱水机(Leica,German);EG1150H包埋机(Leica,German);RM2245切片机(Leica,German);IX70光学显微镜(OLYPUS,Japan)无菌手术器械(弯钳,镊子,弯镊,持针器,眼科剪,3×8圆针,6-0线,1号缝合线)和载玻片、PV管。
1.3 药物与试剂
1.3.1 药物 曲美他嗪片(远大医药有限公司,中国,批号:12070404);戊巴比妥粉剂(上海艾研生物有限公司,中国,批号:081130251);注射用青霉素钠(华北制药股份有限公司,中国,批号: H13020657)。
1.3.2 试剂 10%中性甲醛(北京世济合力生物科技有限公司,中国,生产日期:2013年6月3日);伊红染液(珠海贝索生物技术有限公司,中国,批号:713051);苏木素体细胞染色液(福州迈新生物技术开发有限公司,中国,批号:130604445H);苏木色精返蓝液(北京世济合力生物科技有限公司,中国,生产日期:2013年6月3日);苏木色精分色液(北京世济合力生物科技有限公司,中国,生产日期:2013年6月3日);Masson三色染色液(珠海贝索生物技术有限公司,中国,批号:YZB/粤珠0011-2013)。
1.4 动物模型制备 SD大鼠以2%戊巴比妥液(40 mg/kg体重)进行腹腔麻醉[1],仰卧位固定于大鼠台上,胸部、颈部手术视野区常规备皮、消毒,同时记录标准肢体Ⅱ导联心电图;颈部手术视野区沿气管方向作长约3 cm左右的纵行切口,逐步分离颈部肌肉,暴露气管,采用内直径3 mm的气管导管经大鼠口腔插入气管内,以无创缝合线将导管打结固定于大鼠下颚,气管一端连接HX-200动物呼吸机,辅助大鼠呼吸(呼吸机潮气量为(9~12) mL,频率(85~90)次/min,吸呼比为1∶2);在距胸骨左缘0.5 cm,第3~4肋骨间作长3 cm的纵形切口,从左侧第四肋间钝性分离皮肤、胸大肌,打开胸腔,用眼科开睑器拉开第3、4肋,显示手术视野,暴露心脏,剪开心包,在肺动脉圆锥与左心耳交界下(1~2) mm处用3×8圆针穿过,用6-0无创性缝线,结扎冠状动脉左前降支(LAD),以穿刺而未结扎大鼠作为假手术组;以结扎部位远端心肌变白、搏动减弱且心电图出现ST段弓背向上明显抬高为急性心肌梗死(AMI)造模成功标志。然后挤出胸腔内气体,缝合外皮,碘伏消毒;术后连续3 d注射20万单位青霉素抗感染。
1.5 分组及给药 动物购回后在SPF级动物房适应性喂养3 d进入实验;术前每只大鼠进行超声心动检测;术前禁食12 h后,体重均衡,随机分为造模组与假手术组。假手术组16只和造模组34只;造模组大鼠按本文1.4所述方法造模,术后大鼠复苏24 h后行超声心动检测,左室射血分数(LVEF)值较手术前下降大于15%判定为心力衰竭模型复制成功;造模成功大鼠以随机数字表法分为模型组、曲美他嗪组。
各组大鼠术后72 h开始灌胃给药,模型组和假手术组给予生理盐水4 ml/kg;曲美他嗪组给予曲美他嗪10 mg/kg溶于生理盐水灌胃。各组连续给药8周,每天1次,于每日09:00-10:00间灌胃给药,以5 mL注射器连接灌胃针给大鼠灌胃;每周称量体重1次,根据体重计算调整给药剂量。
1.6 大鼠心功能检测 大鼠分别于术前、术后24 h及药物干预后8周行超声心动检测。大鼠称重并以2%戊巴比妥液(40 mg/kg体重)腹腔麻醉,大鼠左胸前广泛备皮后,仰卧位固定,选取标准左室乳头肌短轴切面和左室长轴切面结合M型和多普勒超声进行检查(CL15-7高频线阵探头、7 MHz~15 MHz),探头置于其左胸,在取得较理想的胸骨旁左心室短轴二维图像后,在乳头肌水平将M型取样线垂直室间隔和左心室后壁获得M型超声心动图,测定左室舒张末期内径(LVIDd)、左室收缩末期内径(LVIDs),并计算出LVEF、左室短轴缩短率(FS)和心输出量(CO)。计算由超声机自动完成。所检测数据均测量3次以取其平均值。超声检查的操作及分析由不知晓大鼠分组情况的超声专科医生完成。
1.7 大鼠心肌样本取材 各组大鼠于给药第8周,于末次给药后12 h后采集心肌样本,每组随机采集6例心肌样本。大鼠麻醉后,迅速打开胸腔,剪开心包,剔除附属物。心脏经生理盐水溶液反复冲洗至溶液变清亮,心脏浸入10%中性甲醛溶液室温固定。
1.8 大鼠心肌样本制备
1.8.1 大鼠心肌组织HE染色 从10%中性甲醛溶液中取出心脏,修整组织,经横断切面取出左室中部组织块,放入包埋盒中,置入脱水机中脱水,然后常规石蜡包埋。之后经修片、切片、裱片、烤片结束之后,即可进行染色、封片。
1.8.2 大鼠心肌组织Masson染色 充分固定和脱蜡后于玻片心肌组织移入Bouin氏液或Zenker氏液,流水冲洗过夜,常规脱水包埋;切片脱蜡至水;Weigert铁苏木素(Weigert铁苏木素A、B液等比例混合液)染(5~10) min,流水稍洗;1%盐酸酒精分化,流水冲洗数分钟;丽春红酸性品红染液染(5~30) min,1%冰醋酸冲洗;磷钼酸溶液处理约5 min后弃掉,不用水洗直接用苯胺蓝染液复染5 min;1%冰醋酸处理1 min,快速用95%酒精脱水多次;无水酒精脱水,二甲苯透明,中性树胶封固。
1.9 统计学处理 采用SPSS17.0软件进行统计分析。组内前后对照采用配对资料t检验。各组间比较采用单因素方差分析,各组间两两比较时先进行Levene方差齐性检验,满足方差齐性时采用LSD-t检验进行,不满足方差齐性采用Dunnetts-t检验。假设检验标准以P<0.05为具有统计学意义。
2 结 果
2.1 模型复制及分组 实验SD大鼠共计50只,随机分为假手术组16只,造模组34只。假手术组手术后存活13只,给药期间无死亡;造模组复制模型成功28只,以随机数字表法,随机分为模型组14只、曲美他嗪组14只;给药期间,模型组死亡2只,曲美他嗪组死亡2只。
2.2 曲美他嗪对心梗后心衰大鼠心功能的影响 治疗后与模型组比较,曲美他嗪组左室舒张末内径和左室收缩末内径均减低,有统计学意义(P<0.05或P<0.01);LVEF、FS、CO均明显增加,有统计学意义(P<0.01)。
曲美他嗪组治疗后与治疗前比较,治疗后LVIDd与疗前无明显变化;治疗后LVIDs较治疗前减低,有统计学意义(P<0.05);治疗后LVEF、FS较治疗前明显增加,有统计学意义(P<0.01);治疗后CO较治疗前增加,有统计学意义(P<0.05)。详见表1。
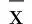
表1 各组大鼠心功能参数比较(±s)
2.3 曲美他嗪对心梗后心衰大鼠心肌组织超微结构的影响
2.3.1 HE染色 假手术组光镜下心肌细胞形态基本正常,胞质、胞核清晰,可见清晰的心内膜层、肌层和外膜层。心肌细胞核呈椭圆形,胞浆内肌丝排列整齐,心肌纤维着色均匀(见图1)。模型组光镜下心肌梗死灶广泛分布,梗死灶内可见坏死组织及炎性细胞浸润,胞浆嗜酸性变,红染似肌凝状态;心肌纤维排列紊乱,部分心肌纤维断裂,呈灶性坏死,细胞核消失,可见大量胶原纤维组织,梗死灶内有散在岛状分布的存活心肌细胞,成纤维细胞稀少,肉芽组织生长稀少(见图2)。曲美他嗪组光镜下心肌梗死灶较局限,心肌细胞部分坏死,心肌纤维排列不整齐,散在心肌纤维断裂消失,可见梗死灶内呈岛状分布的存活心肌细胞,炎性细胞浸润较模型组减少。可见成纤维细胞和肉芽组织增生较模型组增多(见图3)。
2.3.2 Masson染色 假手术组心肌细胞质、肌纤维呈红色,细胞核呈蓝褐色,胶原纤维呈蓝色。可见心肌细胞排列整齐,正常心肌组织小动脉周围及心肌细胞间隙有少许胶原纤维(见图4)。模型组在梗死灶及周边,可见坏死心肌细胞被胶原组织代替。可见心肌细胞肥大、排列紊乱,心肌组织小动脉周围有较多胶原沉积,并有向心肌细胞间隙伸展的趋势。心肌组织间隙的胶原沉积也显着增加(见图5)。曲美他嗪组大鼠心肌细胞形态学观察:可见部分心肌细胞被胶原纤维代替,胶原纤维与心肌细胞相间(见图6)。

图1 假手术组心肌组织形态学(8周HE×100)
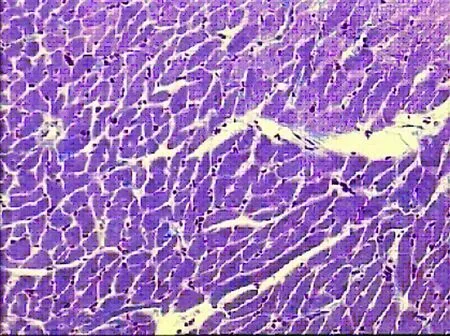
图2 模型组心肌组织形态学(8周HE×100)
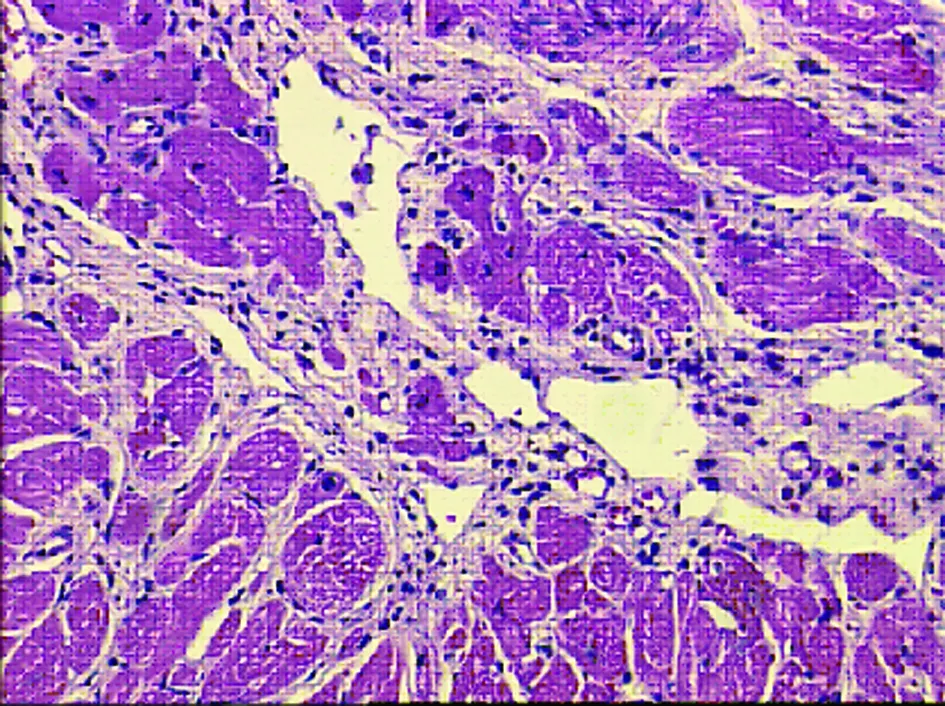
图3 曲美他嗪组心肌组织形态学(8周HE×100)
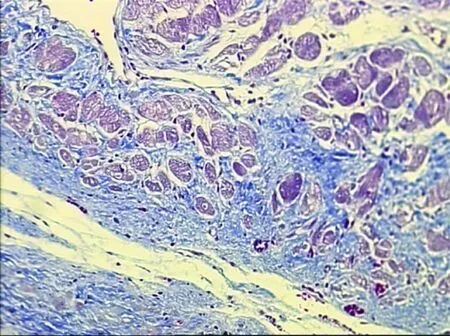
图4 假手术组心肌组织形态学(8周Masson×100)
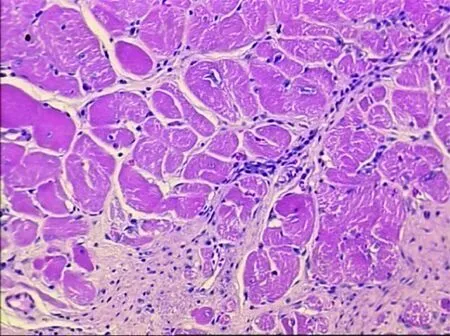
图5 模型组心肌组织形态学(8周Masson×100)
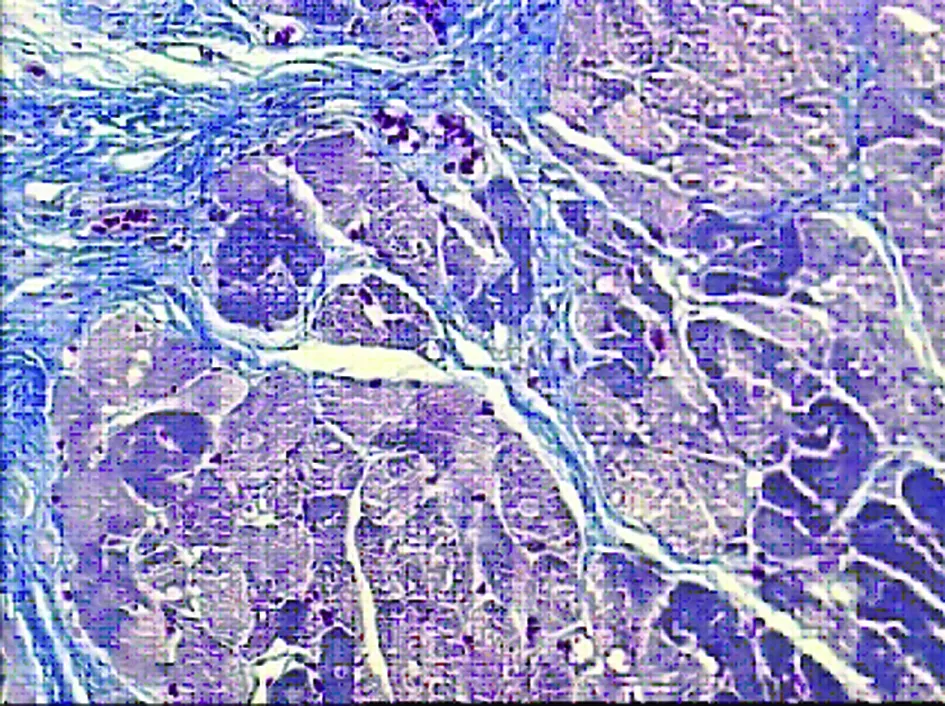
图6 曲美他嗪组心肌组织形态学(8周Masson×100)
3 讨 论
曲美他嗪作为一种心血管病治疗的辅助药物,由于其特有的优化心肌能量代谢的药理机制,目前主要用于心肌缺血和心功能不全的辅助治疗。正常心肌的能量主要来源于葡萄糖和脂肪酸氧化代谢。脂肪酸氧化代谢产生等量ATP的耗氧量比糖代谢高,因此其产生ATP的效率低于糖代谢。当心肌缺血时,冠脉血循环中的脂肪酸升高,心肌能量代谢以脂肪酸代谢为主,葡萄糖氧化代谢受阻,不但会使耗氧增加,还使糖酵解的产物如乳酸增加。曲美他嗪通过抑制心肌能量代谢中的脂肪酸氧化,使之向葡萄糖氧化转化,提高ATP生成的效率,达到改善心肌缺血和心功能的作用。
本研究中,与心梗后心衰模型组相比较,曲美他嗪组可以明显减小心衰后扩大的左室收缩末内径和舒张末内径,尤其减小左室收缩末内径,提高左室射血分数和左室短轴缩短率,提高心输出量,改善心梗后心衰大鼠的心脏收缩功能,这与以往的研究结果相符[2]。这除了曲美他嗪影响心肌细胞代谢以外,可能还有其他的机制参与其中,如①曲美他嗪通过改善缺血细胞内的能量代谢,减少细胞内H+、Na+、Ca2+的超负荷,抑制氧自由基的生成,提高氧自由基的清除功能,减少细胞膜的脂质氧化,而具有强大的抗氧化作用[3]。②在缺氧状态下,线粒体内Ca2+超负荷可以引起线粒体肿胀,氧化磷酸化障碍,曲美他嗪可以与膜上的可通透性蛋白结合并使之失活以抑制Ca2+引起的线粒体肿胀,从而减少凋亡蛋白细胞色素C释放,抑制下游的caspase酶,阻止细胞凋亡[4-5]。
心功能的改善依赖于心肌细胞的存活。本研究中,模型组心肌梗死灶内可见坏死组织及炎性细胞浸润;心肌纤维排列紊乱,部分心肌纤维断裂,呈灶性坏死,细胞核消失,梗死灶内有散在岛状分布的存活心肌细胞,肉芽组织生长稀少。在梗死灶及周边,可见坏死心肌细胞被胶原组织代替。曲美他嗪组心肌梗死灶较局限,心肌细胞部分坏死,散在心肌纤维断裂消失,可见梗死灶内呈岛状分布的存活心肌细胞,成纤维细胞和肉芽组织增生较模型组增多,部分心肌细胞被胶原纤维代替,胶原纤维与心肌细胞相间。提示曲美他嗪可能有抑制心梗后心肌细胞凋亡、改善心肌纤维化的作用。这与之前的研究结果相一致[6-7]。
曲美他嗪作为一种优化心肌代谢的药物,在不影响心率、血压的情况下,通过优化心肌的能量代谢而改善心室的收缩功能、抑制氧化应激反应而阻止心肌细胞凋亡,对心梗后心衰大鼠的心功能和心肌超微结构产生有益的影响。其临床疗效也逐渐得到证实,在心绞痛、心力衰竭、心肌再灌注损伤等方面都有一定的治疗作用。
[1] Pfeffer MA,Braunwald E.Ventricular remodelling after myocardial infarction:experimental observations and clinical implications[J].Circulation,1990,81:1161-1172.
[2] 李兵,陈相健,朱舒舒,等.曲美他嗪对慢性心力衰竭大鼠心肌能量代谢及超微结构的影响[J].中华老年心脑血管病杂志,2008,10(6):447-450.
[3] 张锐,韦建瑞,尹海燕,等.曲美他嗪对休克患者肾功能影响的临床研究[J].中华危重症急救医学,2014,26(1):219-222.
[4] Gong X,Fan G,Wang W,et.al.Trimetazidine protects umbilical cord mesenchymal stem cells against hypoxia and serum deprivation induced apoptosis by activation of akt[J].Cell Physiol Biochem,2014,34:2245-2255.
[5] Singh D,Chopra K,RETRACTED:Effect of trimetazidine on renal ischemia /reperfusion injury in rats[J].Pharmacological Research,2004,50:623-629.
[6] Xu H,Zhu G,Tian Y.Protective effects of trimetazidine on bone marrow mesenchymal stem cells viability in an ex vivo model of hypoxia and in vivo model of locally myocardial ischemia[J].J Huazhong Univ Sci Technology Med Sci,2012,32:36-41.
[7] 冯翔宇,李彤,李秀华,等.曲美他嗪与雷米普利对心力衰竭大鼠心肌细胞凋亡及半胱氨酸天冬氨酸蛋白酶3的影响[J].中华老年心脑血管病杂志,2014,16:856-859.



