,
急性脑梗死(急性缺血性脑卒中)是常见的卒中类型,占全部脑卒中的60%~80%,急性期的时间不统一,一般指发病后2周内。临床治疗急性脑梗死常规方法包括改善脑血液循环、神经保护及中医中药,中国急性缺血性脑卒中诊治指南2014推荐的改善脑血循环治疗有溶栓、抗血小板、抗凝、降纤、扩容、扩张血管等[1],受时间窗及适应证等多种因素限制,目前仅有少于5%的病人接受溶栓治疗,对未接受溶栓治疗的病人及时有效地挽救缺血半暗带、降低致残率十分重要。抗凝治疗急性缺血性脑卒中的主要目的是防止缺血性脑卒中的早期复发、血栓的延长和远端小血管的继发栓塞[2]。阿加曲班作为一种新型直接凝血酶抑制剂,与其他抗凝药物(普通肝素、低分子肝素、类肝素、口服抗凝剂)相比较具有起效迅速、代谢较快、时间窗宽广[3]等优点。目前针对阿加曲班抗血小板的研究试验较少[4]。本研究观察阿加曲班联合氯吡格雷治疗急性脑梗死的疗效及安全性,评估年龄、发病时间、牛津郡社区卒中计划(OCSP)分型及大脑中动脉有无狭窄对其疗效的影响。
1 资料与方法
1.1 研究对象 选择2015年9月-2016年4月江苏省中医院脑病中心住院的急性脑梗死病人174例。纳入标准:发病2周内(不符合溶栓条件和不愿意溶栓治疗)的急性脑梗死病人,诊断标准参照中国急性缺血性脑卒中诊治指南2014[1];美国国立卫生研究院卒中量表(NIHSS)评分≥4分,所有病人均出现轻度至中度的神经功能缺损症状,如口角歪斜、言语不利、肢体乏力、共济失调、意识障碍甚至昏迷等;首次发病或有脑梗死病史但未遗留神经功能缺损症状的再次发病者,不影响本次NIHSS评分;均经头颅MRI确诊;血压≤180/100 mmHg;病人或由其受委托人签署知情同意书。
排除标准:对凝血酶抑制剂过敏者;入院后凝血功能提示明显异常;血小板<100×109/L;半年内有重大手术及创伤史;合并动脉瘤、血管畸形、短暂性脑缺血发作、脑出血后遗症、消化道出血、血液疾病、严重肝肾功能不全;近期内服用其他抗凝药物或皮下注射低分子肝素。
终止标准:病人病情恶化,出现出血性症状;CYP2C19基因型检测显示氯吡格雷慢代谢;病人或其受委托人要求终止治疗者。
1.2 治疗方案 依据中国急性缺血性脑卒中诊治指南2014,两组均给予改善脑代谢、清除氧自由基、营养神经、调脂稳斑、活血化瘀等常规治疗,对合并高血压、糖尿病病人积极进行降压、降糖,并适时进行康复训练。氯吡格雷组:在常规治疗基础上,予以氯吡格雷(深圳信立泰药业股份有限公司生产,国药准字H20000542,规格:每片25 mg)75 mg,每日1次口服抗血小板聚集,治疗维持至出院。阿加曲班组在常规治疗基础上,入院第1天~第2天给予阿加曲班(天津药物研究院药业有限责任公司生产,国药准字H20050918,规格:每支10 mg)20 mg加入0.9%氯化钠注射液250 mL静脉输注,每日3次;第3天~第7天给予阿加曲班10 mg加入氯化钠注射液250 mL静脉输注,每日2次;入院时即予以氯吡格雷75 mg,每日1次口服抗血小板聚集,治疗维持至出院。
1.3 分组 将174例急性脑梗死病人随机分为阿加曲班联合氯吡格雷组(阿加曲班组)和氯吡格雷组,各87例。阿加曲班组男60例,女27例;年龄65.05岁±10.89岁;NIHSS 4分~17分;合并高血压65例,合并2型糖尿病35例;氯吡格雷组男50例,女37例;年龄67.25岁±12.30岁;NIHSS 4分~17分;合并高血压57例,合并2型糖尿病33例。阿加曲班组根据年龄、发病时间(24 h)、OCSP分型、大脑中动脉有无狭窄再分组,详见表1。

表1 阿加曲班组病人一般资料 例(%)
1.4 观察指标 以NIHSS、改良Rankin量表(mRS)及日常生活活动能力量表(ADL)为评定标准,分别记录两组入院时、治疗后7 d、14 d的NIHSS、mRS、ADL评分。
1.5 疗效评定标准 根据全国第四届脑血管病学术会议制定的临床神经功能缺损程度评分标准[5]判断疗效:基本痊愈为NIHSS评分减少91%~100%;显着进步为NIHSS评分减少46%~90%;进步为NIHSS评分减少18%~45%;无变化为NIHSS评分减少或增加17%以内;恶化为NIHSS评分增加18%以上。
2 结 果
2.1 研究完成情况 两组病人一般资料等比较,差异无统计学意义(P>0.05),具有可比性。氯吡格雷组入组87例,完成87例;阿加曲班组入组87例,完成83例,1例未满疗程自行要求出院,3例CYP2C19基因型检测显示氯吡格雷慢代谢。
2.2 两组治疗前后NIHSS评分、mRS评分及ADL评分比较 入院时两组病人NIHSS评分、mRS评分及ADL评分比较,差异无统计学意义(P>0.05)。治疗后7 d同组病人NIHSS评分、mRS评分与入院时比较,差异有统计学意义(P<0.05)。治疗后14 d同组病人NIHSS评分、mRS评分及ADL评分与入院时比较,差异有统计学意义(P<0.05);阿加曲班组NIHSS评分和mRS评分低于氯吡格雷组,ADL评分高于氯吡格雷组,差异有统计学意义(P<0.05)。详见表2。

组别n 项目入院时 治疗后7 d治疗后14 d氯吡格雷组87NIHSS评分 6.80±2.67 6.02±2.441) 5.83±3.221)mRS评分 3.41±0.953.02±1.081) 2.93±0.891)ADL评分 61.55±21.4063.68±20.60 68.28±22.641)阿加曲班组83NIHSS评分 6.71±3.005.77±2.981)4.39±2.461)2)mRS评分3.64±1.183.13±1.401)2.52±1.591)2)ADL评分 61.51±26.1164.52±26.25 75.96±24.541)2) 与同组入院时比较,1)P<0.05;与氯吡格雷组治疗后14 d比较,2)P<0.05。
2.3 阿加曲班组亚组间NIHSS评分、mRS评分及ADL评分比较
2.3.1 不同年龄组病人NIHSS评分、mRS评分及ADL评分比较 根据病人年龄分为≤65岁组和>65岁组,两组入院时、治疗后7 d、14 d NIHSS评分、mRS评分及ADL评分比较,差异无统计学意义(P>0.05)。详见表3。

项目组别n入院时治疗后7 d 治疗后14 dNIHSS评分 ≤65岁组42 6.93±3.11 5.93±3.324.40±2.54>65岁组416.49±2.90 5.61±2.624.37±2.41mRS评分 ≤65岁组423.46±1.30 3.14±1.46 2.50±1.57>65岁组413.73±0.96 3.12±1.36 2.54±1.63ADL评分≤65岁组 4263.26±26.44 64.76±28.13 74.88±27.26>65岁组4160.61±24.70 64.27±24.51 77.07±21.68 注:两组各项比较,P>0.05。
2.3.2 不同发病时间病人NIHSS评分、mRS评分及ADL评分比较 根据病人发病时间分为<24 h组和≥24 h组。两组入院时、治疗后7 d、14 d NIHSS评分、mRS评分及ADL评分比较,差异无统计学意义(P>0.05)。详见表4。

项目组别n入院时治疗后7 d治疗后14 dNIHSS评分<24 h组62 6.68±3.09 5.71±3.00 4.16±2.45≥24 h组21 6.81±2.795.95±2.99 5.05±2.42mRS评分<24 h组 62 3.56±1.21 3.13±1.42 2.37±1.58≥24 h组213.86±1.06 3.14±1.39 2.95±1.56ADL评分 <24 h组6263.06±25.6565.24±26.23 77.82±24.00≥24 h组2156.90±27.5462.38±26.82 70.48±25.88 注:两组各项比较,P>0.05。
2.3.3 前循环组与后循环组NIHSS评分、mRS评分及ADL评分比较 根据入院后MRA检查,OCSP分型将病人分为TACI组、PACI组、POCI组及LACI组,比较前循环组(TACI组+PACI组)和后循环组(POCI组),两组入院时、治疗后7 d、14 d NIHSS评分、mRS评分及ADL评分比较,差异无统计学意义(P>0.05)。详见表5。
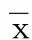

项目组别n入院时治疗后7 d治疗后14 dNIHSS评分前循环组357.11±3.456.54±2.59 5.00±2.54后循环组186.94±3.265.44±3.22 4.06±2.24mRS评分 前循环组 353.74±1.113.37±1.37 2.97±1.71后循环组183.34±1.112.72±1.45 2.28±1.45ADL评分前循环组3556.57±26.09 62.29±25.38 71.14±25.84后循环组1863.39±22.0869.44±26.95 78.33±22.69 注:两组各项比较,P>0.05。
2.3.4 大脑中动脉狭窄组与大脑中动脉无狭窄组NIHSS评分、mRS评分及ADL评分比较 根据入院后TCD或MRA检查将病人分为大脑中动脉狭窄组和大脑中动脉无狭窄组,两组入院时、治疗后7 d NIHSS评分、mRS评分及ADL评分比较,差异无统计学意义(P>0.05);治疗后14 d mRS评分和ADL评分比较,差异无统计学意义(P>0.05),大脑中动脉狭窄组NIHSS评分高于大脑中动脉无狭窄组,差异比较有统计学意义(P<0.05)。详见表6。
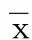
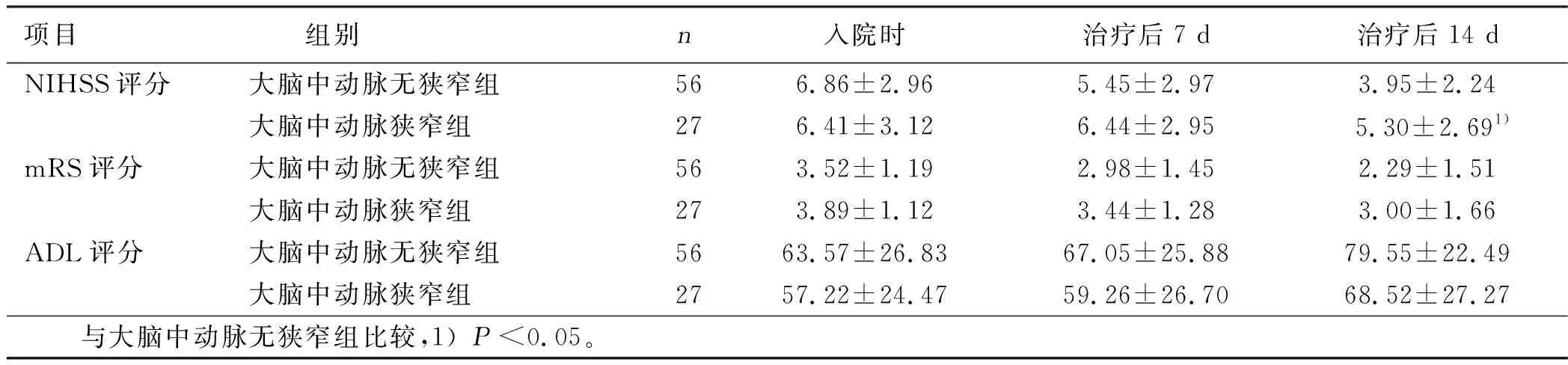
项目 组别n入院时治疗后7 d 治疗后14 dNIHSS评分大脑中动脉无狭窄组56 6.86±2.96 5.45±2.97 3.95±2.24大脑中动脉狭窄组276.41±3.12 6.44±2.955.30±2.691)mRS评分大脑中动脉无狭窄组56 3.52±1.19 2.98±1.45 2.29±1.51 大脑中动脉狭窄组273.89±1.12 3.44±1.28 3.00±1.66ADL评分大脑中动脉无狭窄组56 63.57±26.8367.05±25.88 79.55±22.49大脑中动脉狭窄组2757.22±24.4759.26±26.70 68.52±27.27 与大脑中动脉无狭窄组比较,1)P<0.05。
2.4 两组临床疗效比较 阿加曲班组治疗后与氯吡格雷组比较,差异有统计学意义(P<0.05)。详见表7。
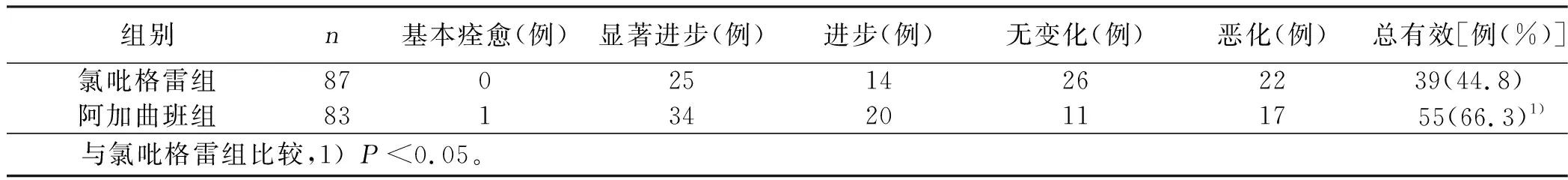
表7 两组临床疗效比较
2.5 阿加曲班组再分组临床疗效比较 两组间(年龄、发病时间、前后循环)疗效比较差异无统计学意义(P>0.05);大脑中动脉狭窄组总有效率明显低于大脑中动脉无狭窄组,差异有统计学意义(P<0.05)。详见表8。
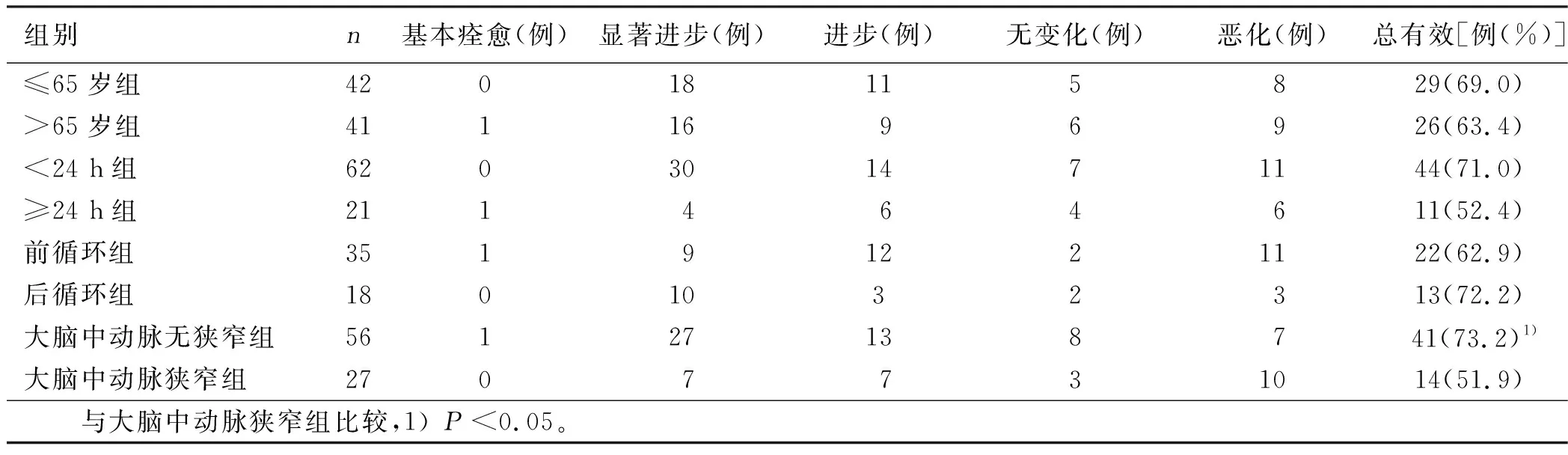
表8 阿加曲班组再分组临床疗效比较
2.6 安全性评价 两组均未出现影响治疗的不良反应,如脑出血、恶心、呕吐、腹泻、过敏、凝血障碍及明显肝功能异常等。
3 讨 论
急性脑梗死病灶由中心坏死区及周围缺血半暗带组成[4],中心坏死区的脑细胞发生梗死时已死亡,但缺血半暗带中的神经细胞有其周围侧支循环的代偿,结构保持完整,尽早恢复半暗带血流,神经细胞可存活并恢复功能。缺血半暗带由Astrup等[6]提出,近年来研究者们相继提出“多分子半暗带”和“代谢性半暗带”概念[4]。目前,半暗带定义为围绕缺血核心区灌注相对较低的脑组织,其血流降低不足以维持电活动,但可维持离子通道功能。该区域经过一系列有害的代谢过程,从缺血核心区逐渐波及临近组织,包括兴奋性毒性、扩散性抑制、氧化应激和炎症反应,可能导致缺血核心区扩大和临床转归恶化[7]。因此,改善缺血区的血液供应,促进侧支循环建立和流通,恢复梗死灶半暗区的脑组织功能,是治疗急性脑梗死的首要任务。
抗凝治疗虽然目前仍存有争议,但越来越多的临床研究证实,其是无法进行溶栓治疗的急性脑梗死病人有效替代选择。直接凝血酶抑制剂阿加曲班在中国急性缺血性脑卒中诊治指南2014[1]中提及。阿加曲班是一种人工合成的小分子左旋精氨酸衍生物,选择性与血液凝血酶催化位点可逆性结合,直接灭活其活性,阻断凝血级联反应的正反馈,间接抑制凝血酶形成,又进入血凝块内部,灭活与血栓结合的凝血酶,抑制全身血液高凝状态同时可针对局部血栓起到抗凝、辅助溶栓作用[2]。一项体内研究表明,阿加曲班可降低血小板表面P-选择素的表达和血小板-白细胞的聚集,减少白细胞活化,抑制血管粥样硬化[8]。有研究表明,阿加曲班可降低急性缺血性脑卒中病人D-二聚体,增加脑血流量[9]。吉智等[10]研究表明,阿加曲班可调节内皮细胞一氧化氮和内皮素-1功能,下调炎症因子白介素-81、肿瘤坏死因子-α的表达,从而降低血液高凝状态,拮抗血小板聚集,减少微血栓形成,增加脑部血流量,预防远端小血管堵塞继发的血栓,改善病人侧支循环,挽救缺血半暗带,促进神经功能恢复。
本研究观察阿加曲班组与氯吡格雷组治疗急性脑梗死的疗效,结果表明:两组治疗后7 d病人的NIHSS评分和mRS评分与入院时比较明显降低(P<0.05)。治疗后14 d病人的NIHSS评分和mRS评分与入院时比较明显降低,ADL评分与入院时比较明显升高(P<0.05);治疗后14 d阿加曲班组NIHSS评分和mRS评分明显低于氯吡格雷组,ADL评分明显高于氯吡格雷组,且治疗后临床疗效等级比较,差异有统计学意义(P<0.05)。因此,阿加曲班治疗急性缺血性脑卒中是有效的。
本研究将阿加曲班组根据年龄、发病时间(24 h)、OCSP分型和大脑中动脉有无狭窄再分组,分别观察各组病人入院时及治疗后7 d、14 d的NIHSS评分、mRS评分、ADL评分,并比较各组间的临床疗效。本研究结果表明,≤65岁组和>65岁组治疗后7 d、14 d的NIHSS评分、mRS评分、ADL评分及临床疗效比较,差异无统计学意义(P>0.05),这与赵智江等[11]研究表明阿加曲班疗效在不同年龄的人群中无明显差别一致。Siegmunda等[12]研究表明,大剂量阿加曲班可有效抢救脑梗死发病24 h后半暗带组织,且临床效果优于尿激酶。本研究以发病24 h为观察标准,比较阿加曲班治疗急性缺血性脑卒中的疗效差异,结果表明,<24 h组和≥24 h组治疗后7 d、14 d的NIHSS评分、mRS评分、ADL评分及临床疗效比较,差异无统计学意义(P>0.05)。多项临床研究表明,阿加曲班可明显降低发病48 h内急性脑梗死病人的NIHSS评分、mRS评分[13-15]。上述研究结果表明,部分急性脑梗死病人发病24 h~48 h内不断进展,直至出现较严重的神经功能缺失。本研究结果表明,前循环组和后循环组两组治疗后7 d、14 d的NIHSS评分、mRS评分、ADL评分及临床疗效比较,差异无统计学意义(P>0.05)。这与赵智江等[11]等临床研究结论一致。阿加曲班治疗前循环梗死的急性缺血性脑卒中更具优势[2]。有研究表明,阿加曲班治疗后循环脑梗死的急性缺血性脑卒中有较好的临床结局[3]。本研究结果显示,前、后循环梗死所致的急性缺血性脑卒中不同之处在于病变部位,但发病机制与动脉粥样硬化有关,阿加曲班治疗前、后循环急性缺血性脑卒中疗效差异有待进一步论证。颅内外大血管狭窄或闭塞是急性脑梗死的病理学基础,一项研究显示,大血管狭窄或闭塞且缺乏有效侧支循环时,可导致血栓延伸扩大或不稳定斑块脱落,使缺血半暗带扩大,加重原有神经功能缺损或出现新的神经症状[16]。本研究结果表明,大脑中动脉狭窄组和大脑中动脉无狭窄组两组治疗后7 d NIHSS评分、mRS评分及ADL评分比较,差异无统计学意义(P>0.05);治疗后14 d大脑中动脉狭窄组NIHSS评分高于大脑中动脉无狭窄组,差异有统计学意义(P<0.05),且大脑中动脉狭窄组临床疗效等级明显低于大脑中动脉无狭窄组(P<0.05),可见阿加曲班治疗大脑中动脉无狭窄的急性脑梗死更具优势。这一结果与之前诸多临床试验研究一致。因此阿加曲班的疗效与年龄、发病时间、OCSP分型无显着相关,与是否伴有大脑中动脉狭窄显着相关。
阿加曲班常见的不良反应是出血,包括鼻出血、便血和静脉注射部位淤血。一项多中心试验评估阿加曲班治疗急性缺血性脑卒中的安全性,结果表明,阿加曲班各剂量组均未增加颅内出血及明显出血症状的发生[17]。有研究表明,治疗浓度阿加曲班对相关的丝氨酸蛋白酶几乎无影响,具有安全有效的特点[18]。Sugg等[19]采用阿加曲班治疗急性缺血性脑卒中的随机双盲安慰剂对照安全性研究,结果显示阿加曲班治疗组活化全血凝固时间明显延长,且并未增加明显不良反应。耿文娟等[20-21]研究显示,急性脑梗死应用阿加曲班联合脑保护治疗安全有效。本研究两组均未出现影响治疗的不良反应,如脑出血、恶心、呕吐、腹泻、过敏、凝血障碍及明显肝功能异常等。因此,阿加曲班治疗急性缺血性脑卒中是安全的。
综上所述,阿加曲班与氯吡格雷治疗急性脑梗死是安全有效的,联合应用对病人的病情改善更显着。阿加曲班对大脑中动脉无狭窄的急性缺血性脑卒中病人更具优势,且与年龄、发病时间和OCSP分型无显着相关。
参考文献:
[1] 中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246.
[2] 赵倩影.阿加曲班治疗进展性脑梗死的临床观察[D].大连:大连医科大学,2014:1-33.
[3] 王彦云,王珩.阿加曲班治疗急性脑梗死的临床研究进展[J].中西医结合心脑血管病杂志,2015,13(8):995-997.
[4] 刘梦婵,李凤鹏,韩雅玲,等.阿加曲班对比阿司匹林联合氯吡格雷治疗急性缺血性卒中的初步随机、开放研究[J].解放军医学杂志,2015,40(6):433-439.
[5] 中华神经科学会.脑卒中患者临床神经功能缺损程度评分标准(1995)[J].中华神经内科杂志,1996,29(6):381-383.
[6] Astrup J,Symon L,Branston NM,et al.Cortical evoked potential and extracellular K+and H+at critical levels of brain ischemia[J].Stroke,1977,8(1):51-57.
[7] Ramos-Cabrer P,Campos F,Sobrino T,et al.Targeting the ischemic penumbra[J].Stroke,2011,421(Suppl1):S7-S11.
[8] 吴保鑫,侯玉超,沈霞.NMDA受体亚单位 NR2A 在凝血酶诱导的脑出血后脑损伤中的研究[J].中国临床神经科学,2013,8(5):491-497.
[9] Maruki Y,Onoda A,Matsuzaki M,et al.A specific thrombin inhibitor (argatroban) ameliorated cerebral blood flow in the patients with acute cerebral infarction[J].Keio J Med,2000,49:A138-A140.
[10] 吉智,范秀博.注射用红花黄色素联合阿加曲班治疗急性脑梗死的临床研究[J].现代药物与临床,2016,31(2):158-162.
[11] 赵智江,高凤国,张东素,等.阿加曲班治疗不同部位及不同年龄急性脑梗死的疗效对比[J].山西医药杂志,2013,42(10):1136-1137.
[12] Siegmunda R,Boera K,Poeschel K,et al.Comparison of the ecarin chromogenic assay and different APTT assays for the measurement of argatroban concentrations in plasma from healthy individuals and from coagulation factor deficient patients[J].Thromb Res,2008,123(1):159-165.
[13] 施俊峰,李杰,陈峰,等.阿加曲班治疗急性脑梗死合并糖尿病患者的临床效果[J].实用临床医药杂志,2015,19(15):149-150.
[14] 赵智江,张微微,赵秀欣,等.阿加曲班治疗急性缺血性脑卒中疗效及应用时机的临床研究[J].中华老年心脑血管病杂志,2012,14(2):181-182.
[15] 王宏艳,高志欣,李玮.阿加曲班注射液治疗急性脑梗死患者的疗效观察[J].现代药物与临床,2013,28(4):581-584.
[16] Park JS,Park SS,Koh EJ,et al.Treatment for patients with acute ischemic stroke presenting beyond six hours of ischemic symptom onset:effectiveness of intravenous direct thrombin inhibitor,argatroban[J].J Korean Neurosurg Soc,2010,47(4):258-264.
[17] Hua Y,Tang LL,Fewel ME,et al.Systemic use of argatroban reduces tumor mass,attenuates neurological deficits and prolongs survival time in rat glioma models[J].Acta Neurochir Suppl,2005,95(95):403-406.
[18] Austin JH,Stearns CR,Winkler AM,et al.Use of the chromogenic factor X assay in patients transitioning from argatronban to warfarin therapy[J].Pharmacotherapy,2012,32(6):493-501.
[19] Sugg RM,Pary JK,Uchino K,et al.Argatronban tPA stroke study:study design and results in the first treated cohort[J].Archives of Neurology,2006,63(8):1057-1062.
[20] 耿文娟,王丽娟.阿加曲班治疗急性脑梗死临床疗效观察[J].实用心脑肺血管病杂志,2012,20(4):625-626.
[21] 董薇薇.阿加曲班治疗急性脑梗死疗效观察[J].中国实用医药,2013,8(5):70-71.



