,
研究显示,炎症免疫在动脉粥样硬化(atherosclerosis,AS)的发生发展中起重要作用,炎症因子贯穿动脉粥样硬化发生发展乃至斑块破裂的全过程[1-2]。氧化型低密度脂蛋白(ox-LDL)是AS形成中的一个重要因子,血凝素样氧化低密度脂蛋白受体(LOX-1)是主要存在于内皮细胞上的ox-LDL特异受体。体内LDL 在氧化应激作用下形成ox-LDL,ox-LDL比低密度脂蛋白(LDL)有更强的毒性作用,与内皮细胞表面受体LOX-1 特异性结合后,引起内皮功能失调和损伤,进一步刺激平滑肌细胞增殖。LOX-1的激活与内皮细胞、平滑肌细胞和巨噬细胞的凋亡有关,此过程是促进斑块不稳定和发生为急性冠脉综合征的重要机制[3]。LOX-1 还是一种炎性因子,能刺激血小板等释放黏附分子、趋化因子等,使平滑肌细胞、巨噬细胞等大量吞噬ox-LDL而形成泡沫细胞沉积在血管内壁,同时触发一系列细胞内信号通路,参与高血压、血栓和AS 等的形成。Li等[4]观察冠状动脉内皮细胞(HCAECs)发现,在HCAECs上有LOX-1持续表达;将HCAECs和血管紧张素Ⅱ(AngⅡ)一起孵育,LOX-1 mRNA和蛋白表达显着增加。同时,AngⅡ促使HCAECs加速摄取I125标记的ox-LDL,导致ox-LDL介导的细胞损害。替非罗班是抗血小板聚集的药物,国外已有体外实验证明,替罗非班能够减少冠心病临床事件及心血管病死亡,且所获得的益处与抑制血小板聚集作用无关,提示这可能与改善内皮功能、稳定斑块等作用有关[5]。本研究旨在体外观察替罗非班对人脐静脉内皮细胞LOX-1的表达是否存在抑制作用,进一步分析替罗非班抗动脉硬化和抑制免疫炎症的可能机制。
1 材料与方法
1.1 材料 健康新生儿脐带,邯郸市第一医院妇产科提供;PDTC(美国Sigma公司);兔抗人LOX-1多克隆抗体(美国Santa Cruz);FITC-羊抗兔二抗(美国Santa Cruz);兔抗人Ⅷ因子一抗(美国Santa Cruz);SP免疫组化试剂盒(北京中山生物技术有限公司);DAB显色剂RPMI1640培养基、无脂蛋白血清、胰蛋白酶、 Trizol试剂为Gibco公司产品;Ⅱ型胶原酶(Sigma公司);胎牛血清(杭州四季青公司);逆转录聚合酶链反应(RT-PCR)试剂盒及引物购自大连宝生物有限公司;PCR Marker由上海申工生物公司合成;焦磷酸二乙酯(DEPC)、琼脂糖购自美国Sigma公司;替罗非班(欣维宁,武汉远大制药)。
1.2 方法
1.2.1 细胞培养 无菌操作下取分娩4 h健康新生儿脐带,用磷酸缓冲盐溶液(PBS)冲洗干净,以0.1%Ⅱ型胶原酶37 ℃消化10 min,终止消化后收集消化液,1 000 r/min离心8 min,弃上清液,加入RPMI1640培养基,在5%CO2、37 ℃培养箱内培养。待细胞生长达亚融合状态时,以0.25%胰蛋白酶消化、传代。选择生长良好的第2代~第5代细胞用于实验。采用形态学及抗Ⅷ因子抗体免疫荧光染色行内皮细胞鉴定(荧光免疫组化方法)。具体方法如下:培养瓶中的细胞融合成铺路石状单层时,将细胞消化下来,接种入预先用4%多聚赖氨酸浸泡后并经无菌处理的盖玻片上,置入6孔板进行细胞爬片,种板密度为1×105/mL,待细胞生长至适宜密度时,终止培养。
1.2.2 氧化低密度脂蛋白的准备 低密度脂蛋白的分离是以单个不连续密度梯度 50 000 r/min超速离心而进行的快速分离,低密度脂蛋白加入含10 μmol/L硫酸铜的磷酸盐缓冲液氧化修饰24 h,在准备后15 d内进行实验。
1.2.3 实验分组及方法 共分为3组。对照组:培养液不加干扰因素;ox-LDL组:ox-LDL 80 mg/L加入培养的THP-1细胞中孵育12 h;ox-LDL+替罗非班组先加入ox-LDL(80 mg/L)孵育12 h,后加入固定浓度的替罗非班(替罗非班用量根据体重计算)分别作用12 h、24 h、36 h。
1.3 逆转录-聚合酶链反应测定LOX-1mRNA表达 按Trizol试剂盒说明书提取总RNA,将RNA在-70 ℃保存待测[6],然后进行逆转录-聚合酶链反应,紫外凝胶图像分析仪进行数据分析,以目的基因mRNA扩增后产物的光密度值与内参照GAPDHmRNA扩增后产物光密度值的比值作为mRNA表达的相对值。LOX-1及内参GADPH的引物序列见表1。

表1 引物序列
1.4 流式细胞仪间接免疫荧光法检测LOX 采用流式细胞仪(EPICS-XL,美国Cuter公司)间接免疫荧光法检测:接种细胞至6孔培养板;37 ℃,5%CO2及饱和湿度条件下培养24 h后,从孵育箱内取出细胞培养板;用0.25%胰酶消化收集细胞,吹打成单细胞悬液;收集到离心管内,1 000 r/min离心5 min后,弃去上清液;1×PBS-BSA(0.1%BSA)缓冲液洗2次,加入1∶100兔抗人LOX-1抗体,4 ℃孵育 1 h,然后以1×PBS-BSA(0.1%BSA)缓冲液洗1次,除去未结合的一抗;加入标记荧光素的羊抗兔IgG,工作浓度1∶100,4 ℃避光孵育1 h,1×PBS-BSA(0.1%BSA)缓冲液洗2次,加入PBS重悬细胞;使用流式细胞仪检测表达LOX-1阳性细胞数量变化,以标记抗体呈阳性的细胞百分率作为表达LOX-1蛋白的计量标准。
2 结 果
2.1 替罗非班对HUVECs LOX-1mRNA表达的影响 与对照组比较,ox-LDL组LOX-1mRNA的表达显着升高(P<0.05);替罗非班抑制HUVECs LOX-1 mRNA的表达作用呈时间依赖性。与ox-LDL组比较,应用替罗非班后12 h、24 h、36 h LOX-1mRNA表达降低了8%、64%和73%,差异有统计学意义(P<0.05)。详见图1和表2。
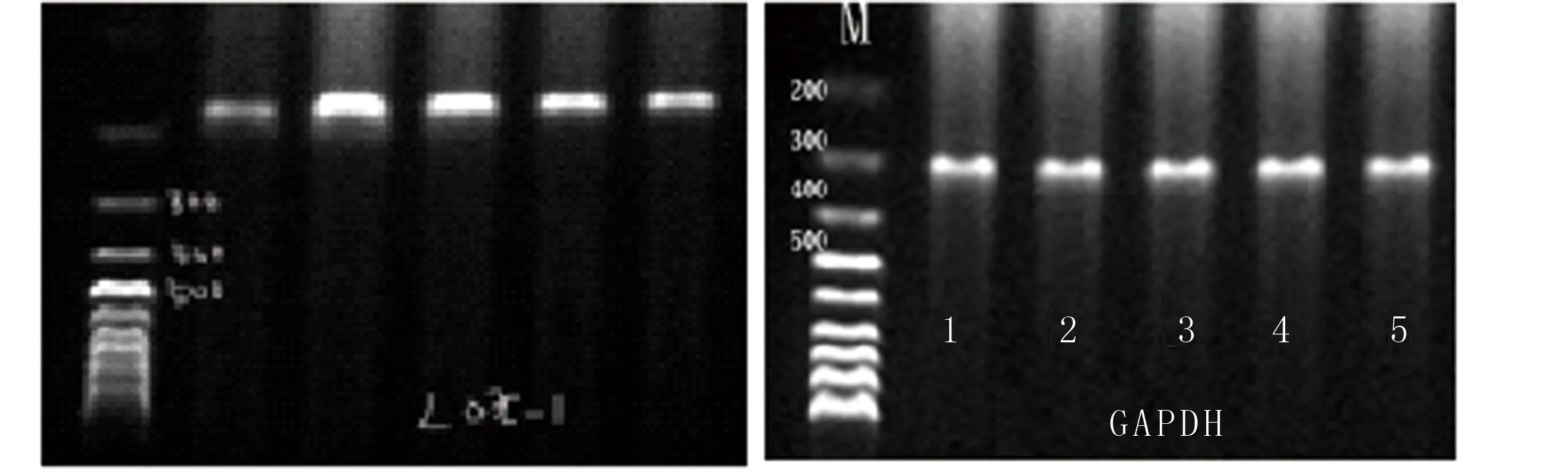
1为对照组;2为ox-LDL组;3为替罗非班12 h组;4为替罗非班24 h组;5为替罗非班36 h组。
图1 HUVECs细胞LOX-1mRNA表达的逆转录--聚合酶链反应电泳图
表2 替罗非班对HUVECs LOX-1mRNA表达的影响(±s)
2.2 替罗非班对HUVECs LOX-1阳性细胞数的影响 与对照组比较,ox-LDL组HUVECs LOX-1阳性细胞数明显增加(P<0.05);固定浓度的替罗非班作用后HUVECs LOX-1阳性细胞数的表达量随替罗非班的作用时间延长而减低,其作用呈时间依赖性。详见表3。
表3 替罗非班对HUVECs LOX-1阳性细胞数的影响(±s)
3 讨 论
血管内皮细胞不仅是全身血管内膜的屏障结构,而且是一个重要的内分泌器官,具有多方面的生理功能,主要为调节血管张力,调节炎症细胞在血管壁的黏附聚集,抑制血小板的过度激活和聚集,维持凝血和纤溶系统的活性平衡。尽管AS的发生机制十分复杂,但目前公认内皮细胞的损伤和功能障碍是AS发生的始动因素和中心环节。
ox-LDL是AS形成中的一个重要因子,ox- LDL 引起血管壁脂质堆积、炎性变化和细胞凋亡。近年发现在血管内皮细胞和巨噬细胞表达血凝素样LOX-1[7],它可特异性地结合ox-LDL,并诱导单核巨噬泡沫细胞转运到血管内皮及平滑肌细胞,因此LOX-1可能在AS早期病理变化中起着关键作用。LOX-1属于二型膜蛋白,在其氨基酸序列的N 端有一条短的胞浆尾链,而在其C 端有一条长的细胞外区域,因此,其结构属于C 类血凝素家族。小牛LOX- 1 的分子量接近50 kD,而人类的则接近40 kD。LOX- 1 与其他已经发现的ox- LDL受体,包括A 类和B类清道夫受体以及CD68 都没有任何结构上的同源性[8]。通过克隆在人类内皮细胞表达的乙酰化LDL的清道夫受体,发现它也可以摄取ox-LDL,而LOX- 1只能与ox-LDL结合而不能与乙酰化的LDL结合[9]。
LOX-1 不仅是ox-LDL的受体,同时也是一种细胞黏附分子,与激活的血小板和嗜中性细胞结合后,可以增强内皮细胞释放内皮素-1,从而诱导内皮功能紊乱,促进AS进程[10]。因此,LOX-1不仅通过结合ox-LDL,而且通过结合血小板和嗜中性白细胞来启动和促进AS 的进程。
本研究结果显示,与对照组比较,ox-LDL组HUVECs LOX-1表达显着升高(P<0.05),替非罗班可明显抑制HUVECs LOX-1的表达,与对照组比较,应用替罗非班后12 h、24 h、36 h LOX-1mRNA的表达降低了8%、64%和73%,呈时间依赖性。流式细胞术表明,替罗非班作用后HUVECs LOX-1阳性细胞数的表达量随替罗非班的作用时间延长而减低,变化趋势同LOX-1mRNA水平一致,差异有统计学意义(P<0.05)。通过实验还发现,替罗非班作用后24 h与36 h后LOX-1表达下降最明显。这表明,替罗非班作用的理想时间点在24 h~36 h。同时还发现,流式细胞术检测LOX-1阳性细胞数的下降较基因水平低,提示目前已经分离出几类不同的ox-LDL受体[11],包括A类和B 类清道夫受体以及CD68,在细胞水平检测受到相应限制,导致LOX-1阳性细胞数的下降幅度降低。
LOX-1与其配体间的相互作用,导致内皮细胞功能紊乱,对AS的发生发展及一些并发症的产生有重要意义。替非罗班可明显抑制HUVECs LOX-1的表达, 因此能抑制细胞因子、基质金属蛋白酶(MMPs)、黏附分子如E选择素,单核细胞趋化蛋白1(MCP-1)、细胞间黏附分子-1(ICAM-1)和血管细胞黏附分子-1(VCAM-1)等的激活,从而阻断与炎症有关的血管损伤,这为临床治疗心血管疾病提供了新的思路。
参考文献:
[1] Ross R.Atherosclerosis:an inflammatory disease[J].N Eng J Med,I999,340(2):115-126.
[2] Abou-Raya A,Abou-Raya S.Inflammation:a pivotal link between autoimmune diseases and atherosclerosis[J].Autoimmunity Reviews,2006,5(5):331-337.
[3] Grelli S,Spitalieri P,et al.In vivo and in vitro studies support that a new splicing isoform of OLR1 gene is protective against acute myocardial infarction [J].Circ Res,2005,97(2):152-158.
[4] Li DY,Zhang YC,Philips I,et al.Upregulation of endothelial receptor for oxidized low-density lipoprotein (LOX-1) in cultured human artery endothelial cells by angiotensin Ⅱ type 1 receptor activation [J].Circ Res,1999,84(9):1043-1049.
[5] Lin R,Liu J,Peng N,et al.Lovastatin reduces nuclear factor Kappa-B activation induced by C-reactive protein in human vascular endothelial cells[J].Biol Pharm Bull,2005,28:1630-1634.
[6] 张利峰,杨志明,柴婵娟.阿托伐他汀对THP-1源性巨噬细胞CD40和MMP-9的抑制作用[J].中西医结合心脑血管病杂志,2009,7(1):66-68.
[7] Sawamura T,Kume N,Aoyama T,et al.A novel endothelial receptor for oxidized low density lipoprotein [J].Nature,1997,386(6620):73-77.
[8] Nagase M,Abe J,Takahashi K,et al.Genomic organization and regulation of expression of the lectin- like oxidized low-density lipoprotein receptor(LOX-1) gene [J].J Biol Chem,1998,273(50):33702-33707.
[9] Adachi H,Tsujimoto M,Arai H,et al.Expression cloning of a novel scavenger receptor from human endothelial cells[J].J Biol Chem,1997,272(50):31217-31220.
[10] Sakurai K,Sawamura T.Stress and vascular responses Endothelial dysfunction via lectin-like oxidized low-density lipoprotein receptor-1:close relationships with oxidative stress[J].J Pharmacol Sci,2003,91(3):182-186.
[11] Tsukamoto K,Kinoshita M,Kojima K,et al.Synergically increased expression of CD36,CLA-1 and CD68,but not of SR-A and LOX-1,with the progression to foam cells from macrophages[J].J Atheroscler Thromb,2002,9(1):57-64.



