, ,,
慢性脑供血不足是由各种原因导致大脑出现慢性灌注不足,从而引发大脑缺血、缺氧出现的脑功能障碍的疾病。而学习记忆能力明显下降是脑供血不足主要临床表现之一。诸多临床及实验研究发现,针灸治疗可以明显改善脑供血及学习记忆能力,但对其分子机制的研究至今还不明确。
本研究采用双血管阻断法(2-VO)造成慢性脑灌注不足大鼠模型,从调节脑与神经发生密切相关的神经诱导因子Noggin及其拮抗剂骨结合蛋白-4(bone morphogenetic protein 4,BMP4)的表达为切入点,观察慢性脑缺血大鼠及电针治疗时海马新生细胞的增殖、分化等神经发生的变化规律,探讨Noggin与BMP4在电针治疗中对神经发生的影响,以期待从神经生物学角度阐明针灸治疗慢性脑缺血损伤疾病作用机制,为针灸治疗脑缺血疾病提供科学依据。
1 材料与方法
1.1 实验动物与分组 实验用3个月龄雄性SD大鼠108只,体重210 g±30 g,由山西医科大学实验动物中心提供。将大鼠随机分为假手术组与手术组,造模后将手术组随机分为模型组与电针组,然后将假手术组、模型组、电针组大鼠再按缺血1周、2周、4周分为3个亚组,每个亚组12只。
1.2 动物模型制备 按Ni等[1]方法永久性结扎双侧颈总动脉制作慢性脑灌注不足大鼠模型。大鼠称重后用10%水合氯醛(3.5 mL/kg)腹腔注射麻醉,将大鼠仰卧位固定于手术台上,暴露颈部,局部备皮,用聚维酮碘(PV)消毒后行颈部正中切开术,分离双侧颈总动脉,后用4#缝合线结扎,确保阻断动脉血流,缝合切口。
1.3 电针治疗方法 自制捕鼠器固定大鼠头部,参照《实验针灸学》[2]中大鼠穴位定位方法取“百会”和“大椎”穴,用0.5寸针灸针针刺穴位,“百会”穴刺法:从“百会”穴沿头顶正中线向后斜平刺0.5 cm;“大椎”穴刺法:直刺0.5 cm。将韩氏穴位神经刺激仪的输出线连接两穴位针灸针,调节刺激参数:输出电流1 mA,频率15 Hz连续波,时间20 min。大鼠头部一般会出现轻微抖动,每天1次,治疗7次后休息1 d。
1.4 细胞标记及取材方法 B5-溴脱氧尿嘧啶核苷(BrdU)标记:各组大鼠每组随机抽取6只,在术后第4天进行BrdU腹腔注射,连续注射3 d,每日2次(间隔12 h),以观察新生细胞增殖、分化情况。按不同要求处死大鼠后取材,进行各项指标检测。取材方法:①取标记BrdU的大鼠(取BrdU标记者,每组6只),10%水合氯醛腹腔注射麻醉后,用生理盐水经左心室、升主动脉灌注,直至流出液为澄清液体,接着推注4%多聚甲醛(用0.1 mol/L磷酸缓冲液配制成pH7.4溶液)200 mL。随后滴注4%多聚甲醛500 mL,先快滴后慢滴。然后开颅,迅速将脑组织完整取出,置于4%多聚甲醛液中固定,4 ℃浸泡24 h;继以移入20%、30%蔗糖溶液梯度脱水,标本沉底后取出,锡箔纸包裹液氮速冻4 min,-80 ℃保存,以备制作冰冻切片进行形态学观察。②预先将实验室空调打开(18 ℃,4 h),然后将实验大鼠(每组剩余6只)麻醉后,放置在冰台上断头取脑,分离脑组织,取出海马,然后放入2 mL的离心管中,迅速置于-80 ℃冰箱中储存,以备RT-PCR半定量检测之用。
1.5 BrdU免疫组化染色方法及细胞计数 将切片入50%甲酰胺2×SSC中,置于64 ℃孵育箱30 min,入2 mol/L HCl中,37 ℃孵育30 min,每步之间漂洗。用过氧化物酶染法进行BrdU染色,正常兔血清常温封闭1 h,甩去血清,继之入一抗(一抗为Rat Anti-BrdU单克隆抗体,Abcam 公司提供)4 ℃湿盒孵育过夜,入二抗[二抗为Ribbt Anti-RatIgG (H+L)(HRP), Abcam 公司提供]常温1 h,继之DAB显色5 min~8 min,苏木素复染40 s,脱水封片。
阳性细胞计数时取连续计数3个相邻视野海马颗粒细胞层(granular cell layer,GCL) BrdU阳性细胞数(个/mm2),每只大鼠细胞数量来自6张切片的均数。
1.6 免疫荧光双标染色方法及细胞计数 0.01 mol/L柠檬酸缓冲液高火微波煮沸,置片后中低火微波处理3 min,间隔5 min,反复3次后,降至室温,磷酸缓冲盐溶液(PBS)冲洗,此后每步之间漂洗。入2N HCl中,37 ℃孵育30 min。正常兔血清封闭1 h,甩去血清,按比例将GFAP或NeuN(两种抗体均为小鼠单克隆抗体由Chemicon公司提供)与BrdU一抗混合稀释,4 ℃过夜,将异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的第一个二抗[Ribbt Anti-RatIgG (H+L)(FITC):Abcam 公司提供]稀释后加入,37 ℃避光1 h孵育,将花青(cyanine,Cy3)标记的第2个二抗[Ribbt Anti-Mouse IgG (H+L)(Cy3),Chemicon 公司提供]稀释后加入,37 ℃避光孵育1 h,PBS漂洗,缓冲甘油封片。
增殖细胞计数分别在不同激发光(LEICA DML2500荧光显微镜,FITC为绿荧光,A:495 nm,E:528 nm;Cy3,A:450 nm,E:570 nm为红荧光)下观察并摄片,并用合成软件合成。连续取3个视野,计数每个视野中BrdU阳性细胞数及BrdU+GFAP、BrdU+NeuN阳性细胞数,因BrdU+NeuN双标阳性细胞数目较少,为避免误差,只对BrdU单标阳性细胞、BrdU+GFAP双标阳性细胞、BrdU+NeuN双标阳性细胞计数,分别以平均每平方毫米含多少个BrdU阳性细胞计算海马GCL单位面积内的BrdU数及BrdU荧光双标阳性细胞数量,然后计算荧光双标阳性细胞(分化细胞)占海马新生神经干细胞(neural stem cells,NSC)的比例,进行统计分析。每只大鼠细胞数量来自6张切片的均数。
1.7 RT-PCR检测方法 取出保存的海马每只10 mg,共60 mg加入1 mL TriBlue,提取总RNA,按文献[3]提供方法进行。取总RNA 2 μg,加入DEPC-H2O使总体积为8 μL,加入0.5 μL Ribonuclease inhibitor,2 μL Random Primer,混匀后65 ℃保温5 min,室温放置10 min,离心,将所有溶液收集于管底;加入 4 μL 5×First-strand Buffer、0.5 μL Ribonuclease inhibitor、2 μL 100 mol/L MDTT、2 μL dNTP mix、1 μL MMLV Reverse Trariptase;混匀并离心,37 ℃保温1 h。 90 ℃处理5 min,冰上冷却10 min,室温离心,将所有溶液收集到管底,按2 μL/PCR管分装。通过网站(www.genome.wi.mit.edu)提供的引物设计程序(Primer 5.0),设计PCR引物。Noggin上游5′-AGCACCCAGCGACAACCT-3′,下游5′-GCCACATCTGTAACTTCCTCCT-3′;BMP4上游5′-TGGACACCTCATCACACGACTA-3′,下游5′-GCGACGGCAGTTC TTATTCTTC-3′;β-actin上游5′-TGTATGCCTCTGGTCGTACCAC-3′,下游5′-AC AGAGTACTTGCGCTCAGG A-3′。扩增反应体系:模板2 μL,100 μmol/L上游引物0.5 μL,100 μmol/L下游引物0.5 μL,Taq酶0.7 μL,dNTP 1 μL,Mg2+free Buffer缓冲液5 μL,MgCl25 μL,DDW补充至50 μL,混匀离心,放入PCR仪中扩增(扩增参数见表1)。反应产物置1.6 %琼脂糖凝胶电泳,摄片,扫描半定量。

表1 扩增参数
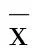
2 结 果
2.1 海马NSC的增殖情况 缺血1周、2周,电针组与模型组大鼠海马齿状回颗粒下层BrdU阳性细胞数较假手术组明显增多(P<0.01),而缺血4周时电针组、模型组、假手术组海马齿状回颗粒下层BrdU阳性细胞数比较,差异无统计学意义(P>0.05)。缺血1周、2周,电针组BrdU阳性细胞数较模型组明显增多(P<0.05或P<0.01);缺血4周时电针组与模型组相比差异无统计学意义(P>0.05)。随着缺血时间的延长,电针组与模型组BrdU阳性细胞数呈递减趋势,假手术组变化趋势不明显。详见表2。BrdU免疫组化详见图1。
表2 各组不同时间海马齿状回BrdU阳性细胞数比较(±s) 个/mm2
2.2 海马NSC的分化情况
2.2.1 BrdU+NeuN免疫荧光双标结果 造模后2周,海马GCL开始有少量BrdU+NeuN双表达细胞,第4周BrdU+NeuN双表达细胞所占比例增加(P<0.01)。缺血2周时,假手术组、模型组与电针组BrdU+NeuN双表达阳性细胞数比较,差异无统计学意义(P>0.05)。缺血4周时,模型组与假手术组BrdU+NeuN双表达阳性细胞数比较,差异无统计学意义(P>0.05);电针组BrdU+NeuN双表达阳性细胞数较假手术组、模型组明显增多(P<0.05)。详见表3。BrdU+NeuN荧光双标图详见图2、图3。
图1 BrdU免疫组化(40×)
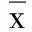
表3 BrdU+NeuN免疫荧光双标法NeuN阳性细胞率比较(±s) 10-2
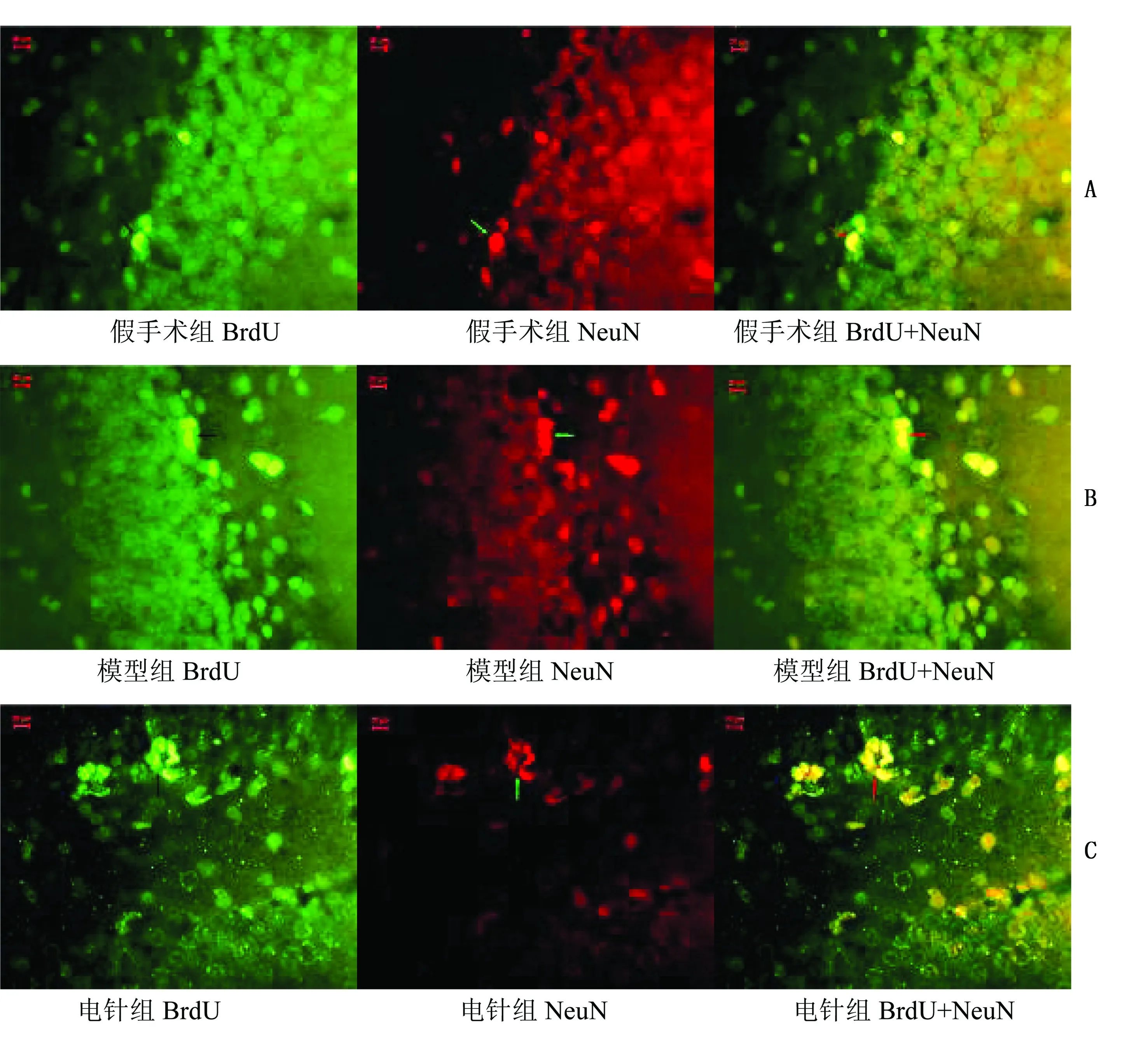
所有荧光双标图片均在荧光显微镜10×40倍下拍摄,图A发绿色荧光者为FITC标记;图B发红荧光为Cy3标记,图C为图A、图B的合成图,表示两种物质共表达,上图箭头指示者为阳性细胞
图2缺血2周各组BrdU+NeuN荧光双标结果

所有荧光双标图片均在荧光显微镜10×40倍下拍摄,图A发绿色荧光者为FITC标记;图B发红荧光为Cy3标记,图C为图A、图B的合成图表示两种物质共表达,上图箭头指示者为阳性细胞。
图3缺血4周各组BrdU+NeuN荧光双标结果
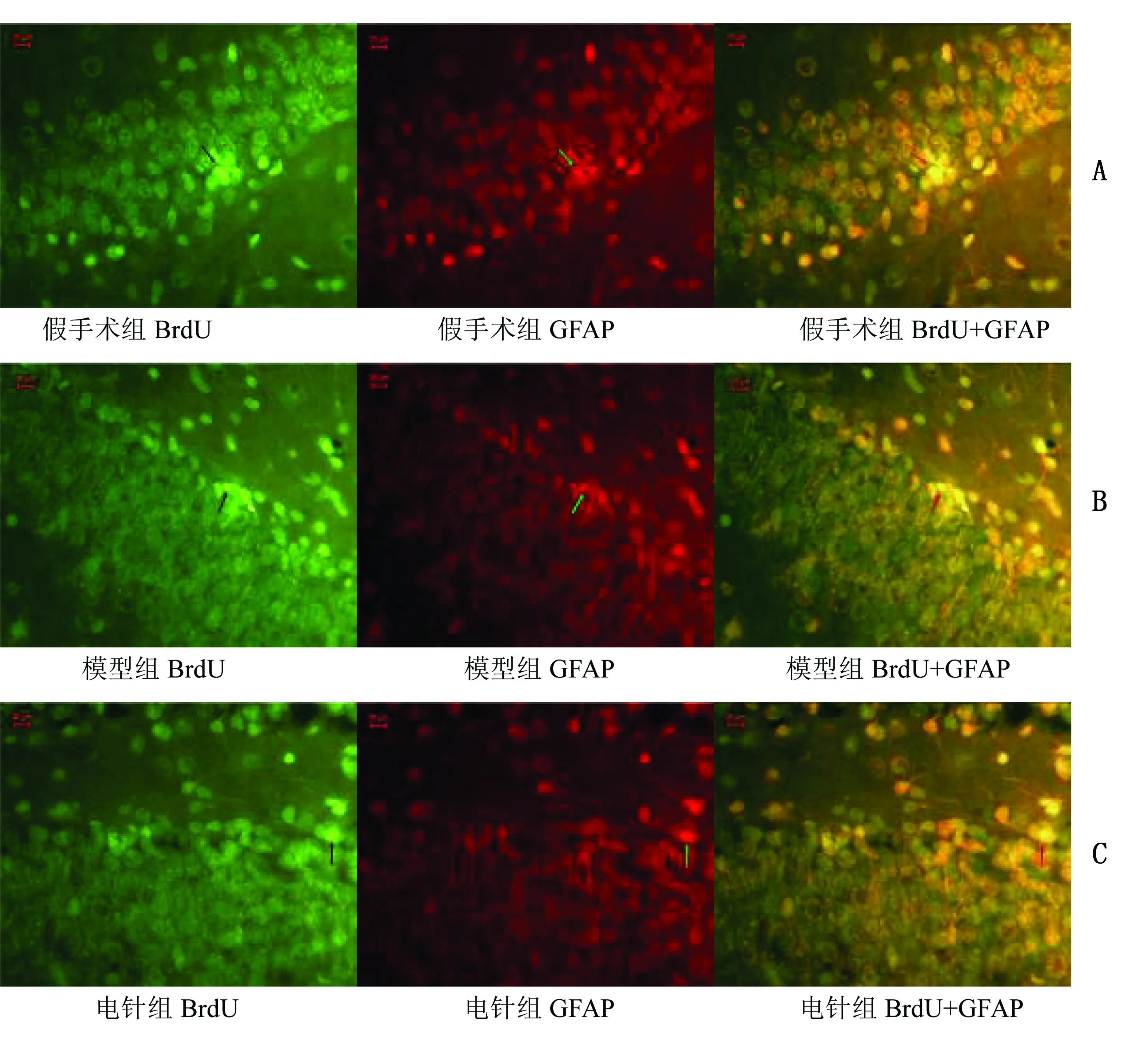
2.2.2 BrdU+GFAP免疫荧光双标结果 造模2周后,海马GCL开始有少量BrdU+GFAP双表达阳性细胞,第4周BrdU+GFAP阳性细胞数比例增加(P<0.01)。缺血2周时,电针组、模型组、假手术组BrdU+GFAP阳性细胞数比较,差异无统计学意义(P>0.05)。缺血4周时,与假手术组比较,模型组与电针组BrdU+GFAP阳性细胞数比例均明显增高(P<0.05),但4周电针组与模型组比较无统计学意义(P>0.05)。详见表4。BrdU+GFAP荧光双标图详见图4、图5。
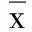
表4 BrdU+GFAP免疫荧光双标结果法GFAP阳性细胞率比较(±s) 10-2
2.3 海马组织Noggin与BMP4 mRNA的表达情况
2.3.1 Noggin mRNA相对表达量 缺血1周、2周,模型组Noggin mRNA相对表达量均高于假手术组,差异有统计学意义(P<0.05),缺血4周时模型组Noggin mRNA相对表达量与假手术组比较差异无统计学意义(P>0.05)。缺血1周、2周、4周,电针组Noggin mRNA相对表达量均明显高于模型组,差异有统计学意义(P<0.05或P<0.01)。模型组Noggin mRNA相对表达量随缺血时间的延长呈递减趋势,4周时与假手术组比较差异无统计学意义。电针组呈现持续高表达,缺血2周时最高。详见表5、图6。
所有荧光双标图片均在荧光显微镜10×40倍下拍摄,图A发绿色荧光者为FITC标记;图B发红荧光为Cy3标记,图C为图A、图B的合成图,表示两种物质共表达,上图箭头指示者为阳性细胞
图4缺血2周各组BrdU+GFAP荧光双标图
所有荧光双标图片均在荧光显微镜10×40倍下拍摄,图A发绿色荧光者为FITC标记;图B发红荧光为Cy3标记,图C为图A、图B的合成图,表示两种物质共表达,上图箭头指示者为阳性细胞
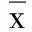
图5 缺血4周各组BrdU+GFAP荧光双标图
A为假手术组缺血1周;B为模型组缺血1周;C为电针组缺血1周;D为假手术组缺血2周;E为模型组缺血2周;F为电针组缺血2周;G为假手术组缺血4周;H为模型组缺血4周;I为电针组缺血4周
图6大鼠海马Noggin、β-actin电泳图
2.3.2 BMP4 mRNA相对表达量 缺血1周、2周、4周,模型组BMP4 mRNA相对表达量均较假手术组显着增加(P<0.01),电针组BMP4 mRNA相对表达量较模型组明显降低(P<0.05)。假手术组随时间变化不明显。造模后,模型组与电针组BMP4 mRNA相对表达量升高;且模型组随缺血时间延长呈递增趋势;电针组在缺血1周、2周呈下降趋势,4周时略有升高。详见表6、图7。
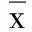
表6 各组不同时间海马BMP4 mRNA的表达(±s)
A为假手术组缺血1周;B为模型组缺血1周;C为电针组缺血1周;D为假手术组缺血2周;E为模型组缺血2周;F为电针组缺血2周;G为假手术组缺血4周;H为模型组缺血4周;I为电针组缺血4周
图7大鼠海马BMP4、β-actin电泳图
2.3.3 Noggin与BMP4相对表达量比值变化 缺血1周、2周、4周,模型组Noggin与BMP4相对表达量比值与假手术组比较差异无统计学意义(P>0.05),电针组Noggin与BMP4相对表达量比值与假手术组、模型组比较差异有统计学意义(P<0.05或P<0.01)。模型组4周时Noggin与BMP4相对表达量比值明显低于1周时,差异有统计学意义(P<0.05)。模型组与假手术组Noggin与BMP4相对表达量比值随时间延长呈下降趋势。详见表7。
表7 各组不同时间Noggin与BMP4相对表达量比值变化(±s)
3 讨 论
以往一直认为成年动物中枢神经系统的神经元是终极分化细胞,一旦因疾病或损伤导致死亡后不会再生;在成年哺乳动物大脑的中枢神经系统中不能产生足够的神经细胞来替代这些损伤细胞,由此使神经回路的完整性破坏[4]。然而,自从Altman等[5]首次发现成年啮齿动物脑内有神经发生后,研究者一直致力于研究整个哺乳动物种类,包括人类在内的成年海马齿状回产生的新的神经细胞及其作用[6]。海马是目前公认的与学习记忆等高级神经功能活动有密切关系的重要脑区,缺血对海马的损伤是认知功能障碍的主要病理基础。目前研究发现,新生及成年哺乳动物的海马区域可持续产生NSC,而NSC在特定的微环境中调控因子影响的情况下可增殖、分化、迁移为特殊的神经细胞表型,从而功能性地整合到海马回路中起作用,这为深入研究海马功能及进一步探讨针刺防治缺血性疾病提供了新的途径。
BrdU是一个胸腺嘧啶类似物,它的应用是这一领域革命性的突破,采用BrdU标记的方法,可以发现成年海马齿状回中的神经发生,从而打破了“神经发生仅存在于胚胎中”的传统观念[7]。BrdU能整合到处于细胞分裂周期S期的DNA双链中,并可通过免疫组化荧光染色,检测标记细胞在体内的变化,BrdU阳性细胞可被看作是具有增殖活性的细胞,是神经干细胞研究中最常用的标记物[8]。本实验采用BrdU标记,很好地显示海马齿状回增殖细胞,并通过荧光双标染色判断增殖细胞的分化情况,观察分化为神经元还是胶质细胞。
海马神经发生是经过一系列具有不同调控机制的复杂步骤产生的终产物,包括神经干细胞的存活、增殖、分化、迁移以及结构和功能的整合[9-10]。许多因素对成年期神经干细胞活性具有调节作用,如Notch、BMPs、Eph/ephrins、Noggin、Wnt/β-catenin等在成体神经发生的微环境中发挥重要的作用。其中Noggin与BMP4对NSC的增殖、分化具有重要意义。
大量的研究表明,Noggin在中枢神经系统的作用与其形成的浓度梯度及拮抗剂BMP4的浓度梯度有关。局部的配体与拮抗剂的浓度决定了Noggin信号的梯度。Zimmerman等[11]研究证实Noggin拮抗BMP4作用呈剂量依赖性,16 nmol/L Noggin 蛋白能够抑制0.1 pmol/L~6.66 nmol/L BMP4的活性;420 pmol/L BMP4与160 pmol/L Noggin(38% of 420 pmol/L)共同孵育,则BMP4的活性被抑制39%,而830 pmol/L BMP4与160 pmol/L Noggin(19% of 830 pmol/L) 共同孵育能够抑制16%的活性。Noggin剂量与抑制BMP4作用的线性量效关系,亦表明两种蛋白存在直接作用。Shou等[12]的研究发现,BMPs对嗅球的神经发生具有抑制与促进两种作用,低浓度的BMP4促进神经发生,高浓度的BMP4抑制神经发生。BMPs的作用与Noggin特性、配体浓度有关。
本研究发现,Noggin mRNA表达与海马神经干细胞的增殖具有密切相关性,实验结果显示,假手术组各时期Noggin mRNA表达无显着变化,且各时期NSC增殖也处于“静息”状态。模型组缺血1周、2周Noggin mRNA相对表达量明显增高,而此时海马神经干细胞的增殖也最显着,这说明Noggin对海马神经干细胞的增殖有调控作用,而缺血损伤可能会激发Noggin等调控因子表达增强来进行自我修复,促进干细胞的增殖、分化。内源性NSC虽然可以对损伤信号产生应答,通过增殖、分化、迁移修复部分功能,但损伤信号对成体神经干细胞的影响是有限的,Arvidsson等[13]实验表明,缺血6周后新生神经元仅占死亡神经元的0.2%。因此,通过体外定向诱导(如学习锻炼、针灸治疗等)强化环境信号是促进神经再生的重要途径。对BMP4 mRNA相对表达量分析发现,缺血后BMP4 mRNA一直持续高表达状态,4周达到最高,而同时相电针组BMP4相对表达降低,结合两组神经干细胞增殖、分化新生细胞数量来看,BMP4可能与促进NSC胶质分化有关。
本实验通过Noggin/BMP4比值来反映两基因之间的拮抗效应对神经发生的影响。对相关结果分析发现,该比值与Noggin相对表达情况趋向基本一致,能够充分反映Noggin在促神经干细胞的增殖、分化中的正向调节作用。
通过分析电针对慢性脑灌注不足大鼠海马齿状回神经干细胞增殖、分化及海马Noggin、BMP4 mRNA表达的影响,发现电针可以通过调节大鼠海马Noggin与BMP4基因的表达促使海马神经干细胞的增殖、定向分化。进而推断:电针改善慢性脑灌注不足大鼠缺血性脑病可能是通过调节Noggin/BMP4的表达,促使海马神经干细胞增殖、存活及定向分化等一系列的级联反应实现的。



