糖尿病(diabetes mellitus,DM)是一种由环境因素和遗传因素同时参与的、以血糖升高为主要特征的慢性代谢性紊乱疾病,与神经系统、微小血管病变和大血管病变等并发症密切相关,我国糖尿病较常见。骨质疏松症是一种涉及多器官的骨骼稳态失衡,导致骨骼承重能力下降,易碎且发生多部位骨折,给公共卫生事业、医疗卫生机构带来沉重负担及资源占用。我国2型糖尿病(type 2 diabetes mellitus,T2DM)合并骨质疏松病人不断增加,至少1亿人处于该病危险之中,探讨其机制对临床治疗十分重要。胱抑素C(cystatin-c,Cys-C)是一种半胱氨酸蛋白酶抑制剂,体外实验发现,牛奶碱性蛋白(milk basic protein,MBP)可改善体内骨代谢,而Cys-C是MBP的重要组分且能抑制骨吸收[1],目前Cys-C是否能在体内调节骨吸收进而影响骨稳态机制尚不明确。本研究分析T2DM病人血清Cys-C水平与骨质疏松症的相关性,以期为临床提供思路。
1 资料与方法
1.1 研究对象 选取2017年11月—2018年6月在山西医科大学第一医院内分泌科就诊的T2DM病人204例,根据骨密度测定结果分为T2DM合并骨质疏松组、T2DM合并骨量减少组和T2DM组。所有病人均符合1999年世界卫生组织提出的T2DM诊断标准。排除标准:糖尿病急性并发症;严重循环系统、消化系统、泌尿系统等器质性疾病;感染及其他应激状态;肿瘤、恶病质等。
1.2 方法
1.2.1 一般资料 测定并记录所有病人一般资料,包括性别、年龄、病程、体质指数(body mass index,BMI)。
1.2.2 生化指标 抽取空腹静脉血,测定Cys-C、糖化血红蛋白(glycosylated hemoglobin A1,HbA1c)、空腹血糖(fasting blood glucose,FPG)、Ⅰ型胶原氨基端延长肽(procollagen type Ⅰ N-terminal propeptide,PⅠNP)、Ⅰ型胶原C端末端肽(β-C-terminal telopeptide of type Ⅰ collagen,β-CTX)、25-羟基维生素D[25-hydroxy vitamin D,25-(OH)VD]、甲状旁腺素(parathyroid hormone,PTH)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素n端分子(N-MID-osteocalcin,N-MID)、尿微量白蛋白/肌酐(microalbumin/creatinine,mAlb/CRE)。
1.2.3 骨密度 由山西医科大学第一医院骨密度室使用美国Hologic公司生产的双能X线骨密度仪器测定病人腰椎L1~L4骨密度(g/cm2),由软件计算T值,参照WHO1994年推荐的诊断标准:T值≥-1.0为正常,-1.0>T值>-2.5为骨量减少,T值≤-2.5为骨质疏松。
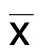
2 结 果
2.1 3组临床资料比较 T2DM组年龄低于T2DM合并骨质疏松组和T2DM合并骨量减低组(P<0.05)。T2DM合并骨质疏松组病程较T2DM组和T2DM合并骨量减低组延长(P<0.05)。T2DM组BMI、FPG均高于T2DM合并骨质疏松组和T2DM合并骨量减低组(P<0.05)。T2DM合并骨质疏松组Cys-C含量、β-CTX、N-MID水平高于T2DM组和T2DM合并骨量减低组(P<0.05),PⅠNP、25-(OH)VD浓度低于T2DM组和T2DM合并骨量减低组(P<0.05),且T2DM组和T2DM合并骨量减低组比较,差异有统计学意义(P<0.05)。T2DM合并骨质疏松组TC、LDL-C、HDL-C水平高于T2DM组和T2DM合并骨量减低组(P<0.05)。详见表1。
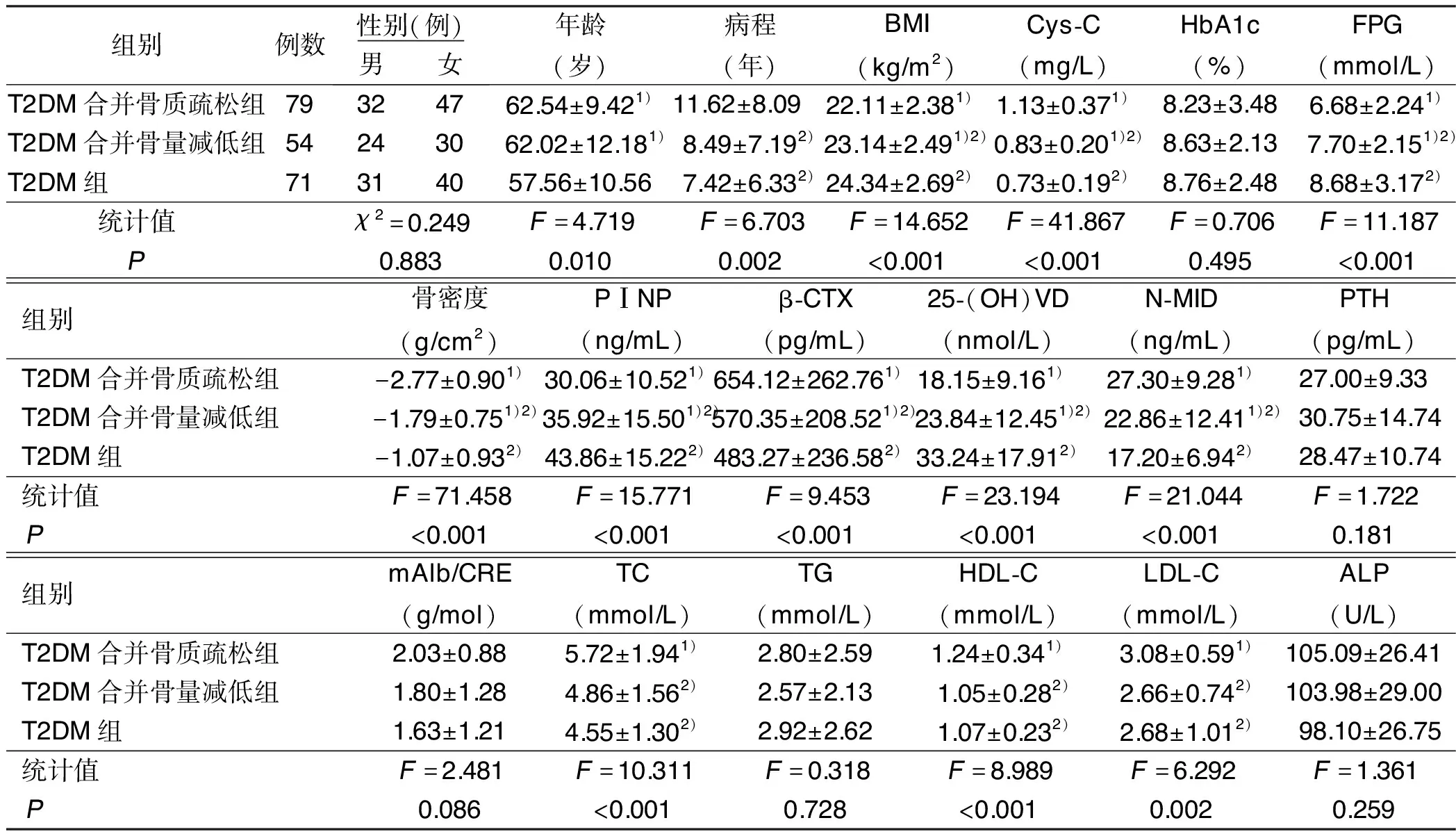
表1 3组临床资料比较
与T2DM组比较,1)P<0.05;与T2DM合并骨质疏松组比较,2)P<0.05
2.2 Cys-C相关性分析 女性T2DM病人Cys-C浓度与β-CTX、N-MID、病程呈正相关,与骨密度、25-(OH)VD和PⅠNP、BMI、FPG呈负相关(P<0.05);男性T2DM病人Cys-C浓度与β-CTX、N-MID、年龄、病程、LDL-C呈正相关,与骨密度、25-(OH)VD和PⅠNP呈负相关(P<0.05)。详见表2、表3。
2.3 腰椎骨密度的危险因素分析 采用多重线性回归逐元回归分析,剔选准则α入=0.05,α出=0.10,模型F=27.829,P<0.001,包含4个自变量,决定系数r2=0.359,以L1~4骨密度为因变量的多重线性回归分析结果显示:年龄、25-(OH)VD、BMI和性别为腰椎骨密度的影响危险因素。详见表4。
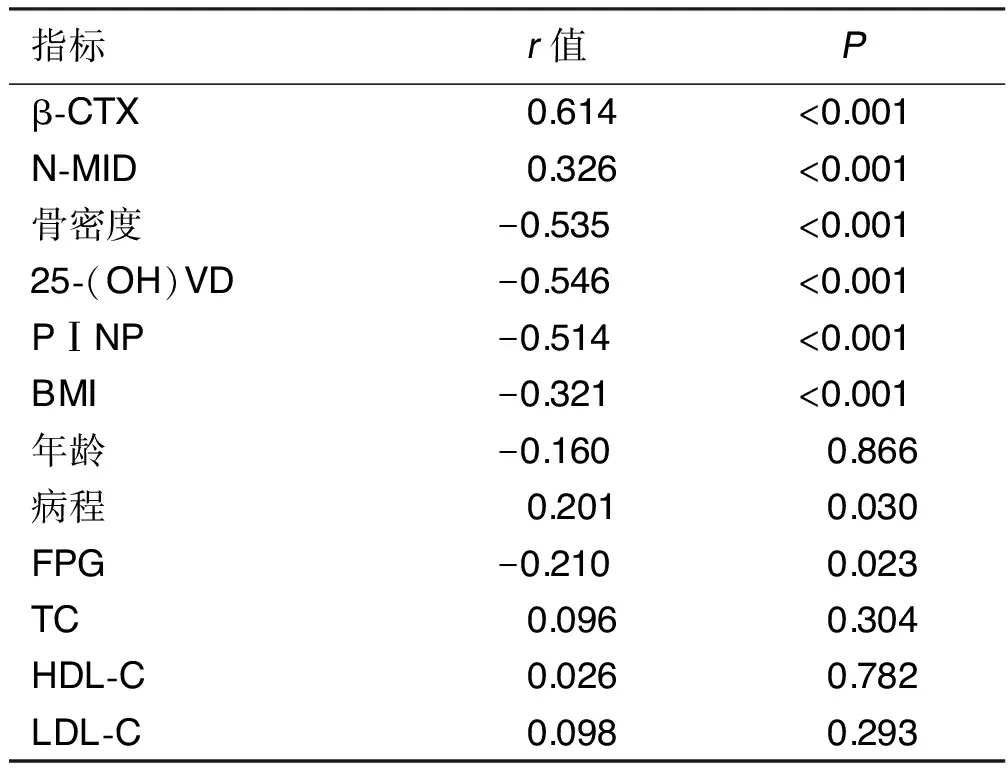
表2 女性病人Cys-C水平的相关性分析
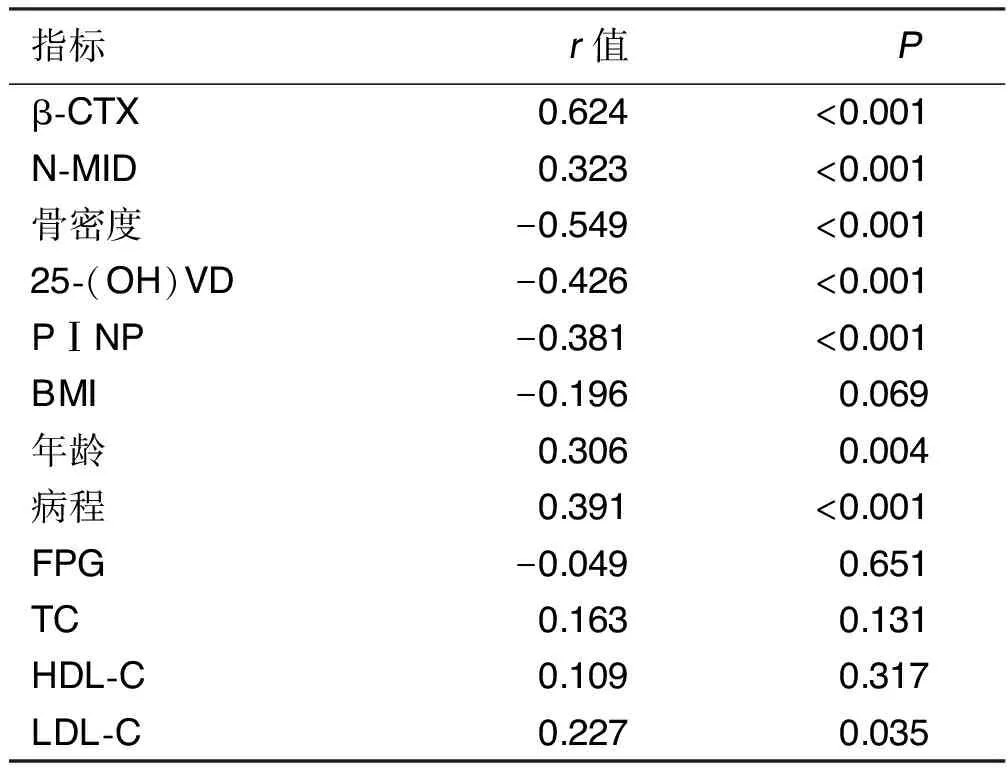
表3 男性病人Cys-C水平的相关性分析
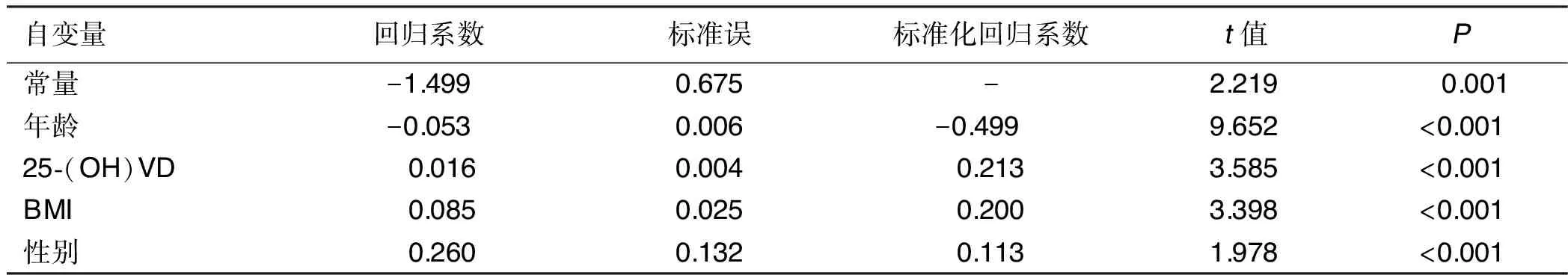
表4 腰椎骨密度的危险因素
3 讨 论
DM是一种慢性全身代谢性疾病,以血糖升高为主要特点,随着社会经济的进步、生活模式的改变、人口老龄化的加剧,我国DM患病率呈高度增长趋势。骨质疏松是影响中老年人健康多见且重要的因素,其特征在于骨骼的退化、骨干质量的改变,伴有骨骼硬度下降及抗机械负荷能力减弱,具有较高的骨折发生率,其中髋部骨折为威胁健康的骨折类型,是中老年人致残和致死的重要原因之一[2],骨质疏松的高致残率、高致死率严重影响病人生活质量,威胁社会公共健康。
T2DM病人患骨质疏松风险高于正常人,且更易发生骨折,尤其是髋部和上肢[3-4],但T2DM病人发生骨质疏松机制尚不明确,可能与高血糖、低胰岛素水平、糖基化终末产物等有关。对来自骨质疏松性骨折研究的4 709名女性进行病例-队列分析研究,结果显示Cys-C浓度与髋部骨折风险独立相关,具有较高浓度Cys-C的老年女性病人发生髋部骨折风险几率显着增加[5],这与相关研究[6]结果一致。骨骼重建是一个动态过程,涉及由破骨细胞介导的骨吸收和成骨细胞诱导的骨形成过程,通过测定骨密度评估骨代谢情况,骨转换标记物亦可评估骨组织的分解和合成代谢状况,并帮助判断骨重建过程中成骨细胞和破骨细胞的活跃程度,PⅠNP是一种由成骨细胞产生的骨形成标志物,可反映Ⅰ型胶原合成(骨基质的主要组分)和新骨形成的能力;β-CTX是一种骨吸收标志物,反映破骨细胞对胶原基质的降解水平和骨吸收能力[7-9]。有研究发现,血清25-(OH)VD缺乏程度与骨质疏松患病风险有关,较低浓度25-(OH)VD更易发生骨质疏松[10-11]。本研究结果显示,Cys-C浓度偏高的T2DM病人骨吸收较骨形成活跃,且25-(OH)VD缺乏程度更严重,这与原晶等[10]研究结果一致,且合并骨质疏松的T2DM病人N-MID含量偏高,N-MID反映骨转换程度,符合骨质疏松病人骨转换状态活跃的特点。
Cys-C是一种分子质量较低的、产自细胞内的蛋白质,其作用是抑制半胱氨酸蛋白酶,Cys-C是同型半胱氨酸(homocysteine,Hcy)在机体内代谢过程中重要一环,可阻断Hcy分解过程,进而升高Hcy含量[12]。Hcy通过增强氧化应激反应和降低一氧化氮(nitric oxide,NO)生物利用度改变血管扩张能力,增加血管血流阻力,最终减少骨血流量从而促进骨质流失。相关研究发现,成骨细胞的活性随着Hcy浓度增加而降低,Hcy可激活破骨细胞活性,抑制破骨细胞凋亡,通过影响骨吸收和骨形成之间平衡,破坏骨骼稳态环境,促进骨质减低,最终导致骨质疏松症[13-15]。有研究认为,骨质疏松症与动脉粥样硬化具有相似的发病机制,骨量低病人动脉硬化程度严重[16-17]。金启辉等[18]发现血Cys-C水平与颈动脉斑块数量呈显着相关(r=0.432,P<0.01),且Cys-C浓度越高,颈动脉内膜中层增厚危险性越高,这与Kobayashi等[19]研究结果一致,Cys-C浓度越高提示动脉粥样硬化程度越严重,分析原因可能是由于骨吸收活跃导致骨中钙流失,动脉壁内膜沉积钙质更易出现动脉硬化。有研究认为,高Hcy可抑制胶原交联,促进纤维降解,进而影响骨代谢与动脉硬化[20]。本研究结果发现,Cys-C浓度较高的骨质疏松组病人TC、HDL-C、LDL-C含量高于余下两组(P<0.05),提示骨质疏松病人发生血脂异常风险更大,更易发生动脉硬化,与上述观点基本一致。本研究结果显示,年龄、25-(OH)VD、BMI和性别为腰椎骨密度的危险影响因素,高龄、低BMI、低25-(OH)VD水平、女性更易发生骨质疏松症,雌激素是重要的性激素,雌激素在调控骨稳态平衡方面起重要作用,低水平维生素D影响钙代谢,且维生素D慢性不足导致继发性甲状旁腺功能亢进,增加骨转换,造成进行性骨丢失和脆性骨折风险增加[21];高龄、低BMI病人摔倒风险较高且肌肉质量少,可能增加骨折风险,这与相关研究[22]结果一致。
综上所述,本研究提示血Cys-C与T2DM病人骨密度存在一定的相关性,Cys-C浓度较高时,T2DM病人患骨质疏松症风险增加, 定期监测T2DM人群血Cys-C水平有助于筛查骨质疏松,从而更好地临床指导,准确预防与治疗,以期减少并发症。本研究因病人来源单一、未能完全排除生活方式的影响,今后需进一步增加样本量进行深入研究。



