姜海涛,代玉静,魏 玮,孙显东,徐艳慧,李 强,杨华志,斯钦孟和,王卫芳
高血压是多种心脑血管疾病的重要危险因素[1]。有研究发现,内蒙古地区蒙古族居民的高血压患病率较同地区的汉族居民高,可能与两个民族居民的饮食、生活习惯差异有关,但具体的生物学机制尚不清楚[2]。微小RAN(microRNA,miRNA)属调控性非编码RNA,为一类由内源基因编码单链RNA分子,其长度约为19~23个核苷酸,可参与动植物生命活动中转录后水平的基因表达调控。有研究发现,高血压的发生与miRNA的调控有密切关系[3]。而内蒙古地区蒙古族居民与同地区的汉族高血压病人血管内皮细胞miRNA表达谱是否存在差异报道较少。本研究旨在通过比较内蒙古地区蒙古族和汉族高血压病人血管内皮细胞miRNA表达谱,探讨两个民族居民高血压发病率差异的生物学机制。
1 资料与方法
1.1 临床资料 将2017年9月—2018年9月赤峰市医院、锡林郭勒盟医院、海拉尔区人民医院就诊的128例蒙古族原发性高血压病人作为观察组,其中男74例,女54例;将136例汉族原发性高血压病人作为对照组,其中男76例,女60例。研究对象的血压依据《中国高血压防治指南2010》所制定的标准测量方法进行测量,以两次测量结果的平均值作为最后的血压值。其中高血压诊断及分级标准为:在未用抗高血压药情况下,收缩压(SBP)≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压(DBP)≥90 mmHg,或既往有高血压史,目前正在用抗高血压药者,即诊断为高血压[4]。正常血压高值:SBP 120~139 mmHg和(或)DBP 80~89 mmHg;1级高血压:SBP 140~159 mmHg和(或)DBP 90~99 mmHg;2级高血压:SBP 160~179 mmHg和(或)DBP 100~109 mmHg;3级高血压:SBP≥180 mmHg和(或)DBP≥110 mmHg。排除标准:继发性高血压、心功能Ⅲ~Ⅳ级、冠心病、重度肺功能不全、风湿性疾病、糖尿病、内分泌紊乱、严重肝肾功能异常、脑卒中、外周动脉疾病、精神疾病以及妊娠或哺乳期女性。研究对象均签订知情同意书。
1.2 质量控制 依据《中国高血压基层管理指南(2014年修订版)》的方法对项目组成员进行问卷调查和血压测量操作的专项培训,并设专人对样本收集过程进行质量监督。对所得数据进行双录入,两次录入结果经计算机检错,录入正确率为99.9%。
1.3 方法
1.3.1 外周血总RNA提取和质量检测 两组病人均于清晨抽取空腹外周静脉血(10 mL),置于乙二胺四乙酸(EDTA)抗凝管内,分装后-80 ℃保存备用。按250 μL血液加750 μL Trizol RNA提取液的比例混合,裂解5 min后,加入200 μL氯仿,室温静置3 min后,4 ℃、12 000 r/min离心15 min;取上清液,加入500 μL异丙醇,静置过夜后(-20 ℃)、4 ℃、12 000 r/min离心15 min;弃上清,用80%的焦碳酸二乙酯(DEPC)乙醇洗涤总RNA,4 ℃、7 500 r/min离心5 min,弃上清,自然风干RNA沉淀。加双蒸水溶解总RNA,采用NanoDrop风光光度计和Agilent 2100生物芯片分析系统检测样品总RNA的A260/A280值,介于1.7~2.2且28S/18S>0.7,表明总RNA样品的质量合格。液氮中保存备用。
1.3.2 miRNA反转录 利用TaqMan MIRNA Reverse Transeription Kit和带茎环结构的miRNAs特异RT-primer进行miRNA反转录。miRNA反转录试剂盒进行RNA反转录,得到的cDNA采用miRNA荧光定量PCR试剂盒进行 RNA定量,miRNAs反转录反应体系为15 μL:dNTPs(100 mmol/L)0.15 μL、反转录酶(50 U/μL)1 μL、10×Buffer 1.5 μL、酶抑制剂(20 U/μL)0.019 L,无 RNA 酶纯水 4.16 μL,每15 μL RT reaction体系包含7 μL RT master mix、5 μL total RNA (1 to 10 ng per reaction),离心后置于冰上孵育 5 min 进行反转录反应,16 ℃、30 min,42 ℃、30 min,85 ℃、5 min,4 ℃保存。 miRNA的定量检测:利用实时荧光定量聚合酶链反应(qRT-PCR)方法,定量检测血浆中miRNAs表达。qRT-PCR反应条件:95 ℃、10 min,95 ℃、15 s,60 ℃、60 s,40个循环,组内重复3次取平均值。通过优化提取、反转录及定量检测方法,建立稳定、可靠的血浆miRNAs定量检测方法。
1.3.3 基因芯片检测不同样品中miRNA表达谱差异 总RNA进行Poly(A)加尾,根据生物标记试剂盒说明书,将生物素标记的信号分子与总RNA相连接。在室温条件下,取杂交液81.7 μL与经生物素标记的总RNA样品混匀,并按说明书进行处理后,加入miRNA芯片中,于杂交炉内恒温(48 ℃)杂交16 h。结束后弃杂交液,芯片加入缓冲液冲洗,待芯片干燥后进行扫描。扫描图像经Affymetrix GeneChip Command Consolies 1.1软件进行数据分析,并结合相关文献报道[5],筛选两组芯片中与高血压相关的差异表达miRNAs,筛选标准为:Cy3、Cy5信号值均>200,Cy3或Cy5信号值>800,差异倍数在2倍以上,且P<0.05。
2 结 果
2.1 两组临床资料比较 两组年龄、性别、血脂指标、肌酸(Cr)、体质指数(BMI)、2型糖尿病、红细胞计数、血小板计数等临床资料比较,差异均无统计学意义(P>0.05)。详见表1。
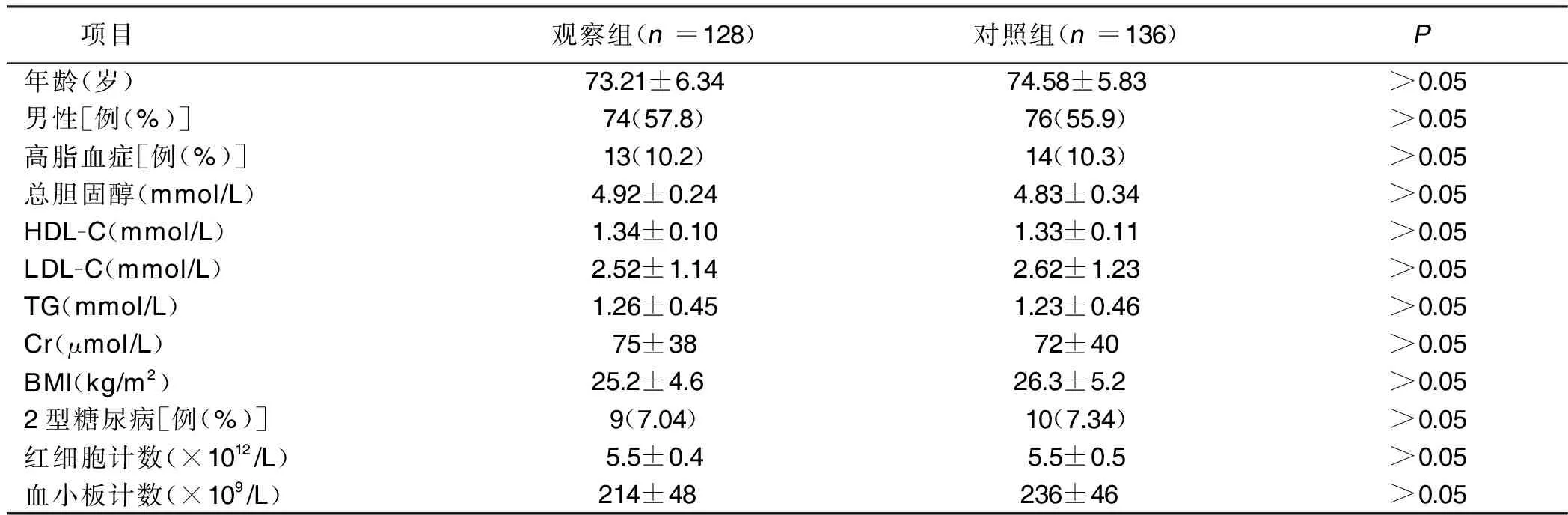
表1 两组临床资料比较
2.2 miRNA浓度及纯度的检测 蒙古族和汉族高血压病人血液总RNA的A260/A280值分别为2.24和2.31,总RNA的浓度分别为287 ng/μL和296.9 ng/μL,28S/18S比值分别为1.69和1.81。表明上述样品所提取总RNA的质量符合芯片检测要求,可以确保后续实验的开展。
2.3 两组样本表达谱miRNA基因芯片结果 miRNA基因芯片共检测2 812个miRNA。观察组与对照组相比,筛选获得20个差异表达较剧烈的miRNA,其中上调表达12个,下调表达8个。上调表达的miRNA多于下调表达的miRNA 。详见表2、表3。
2.4 逆转录cDNA质量的检测 cDNA定量:取混匀的cDNA样本1 μL,用分光光度仪分别测定260 nm、280 nm的吸光值。根据A260/A280估计核酸纯度及浓度,均符合实验要求。
2.5 两组miRNA相对表达水平比较 提取两组血浆中的RNA,运用hsa-miR-132、hsa-miR-192、hsa-miR-212、hsa-miR-361-5p、hsa-miR-17、hsa-miR-30、hsa-miR-72、hsa-miR-144、hsa-miR-150、hsa-miR-638、hsa-miR-1249、hsa-miR-185和hsa-miR-155、hsa-miR-27b、hsa-miR-149、hsa-miR-296-5p、hsa-miR-133b、hsa-miR-1825、hsa-miR-1280、hsa-miR-150分子末端加 poly(A)尾法进行逆转录,再用 SYBRGreen法进行qRT-PCR,核小分子RNA U6(RNU6)作为内参。计算2-△△T后,通过两组比较t检验分析,差异有统计学意义(P均<0.01)。
2.6 两组血液miRNA表达谱差异检测结果 经基因芯片检测,与汉族高血压病人相比,蒙古族高血压病人血液中,上调的与高血压相关的miRNAs有12个,其中miRNA-132上调倍数最大(29.33倍),详见表2;而下调的与高血压相关的miRNAs有8个,miRNA-155下调倍数最大(14.12倍),详见表3。分别对上述差异表达miRNA的靶基因进行京都基因与基因组百科全书(KEGG)富集分析,结果显示,上述miRNA主要参与凋亡信号通路(主要为p53)、转化生长因子-β(transforming growth factor-β,TGF-β)信号转导通路、血管内皮生长因子(vascular endothelial growth factor,VEGF)信号转导通路、Wnt信号转导通路、丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)信号转导通路、mTOR信号转导通路、Jak-STAT信号转导通路以及细胞骨架信号通路等。
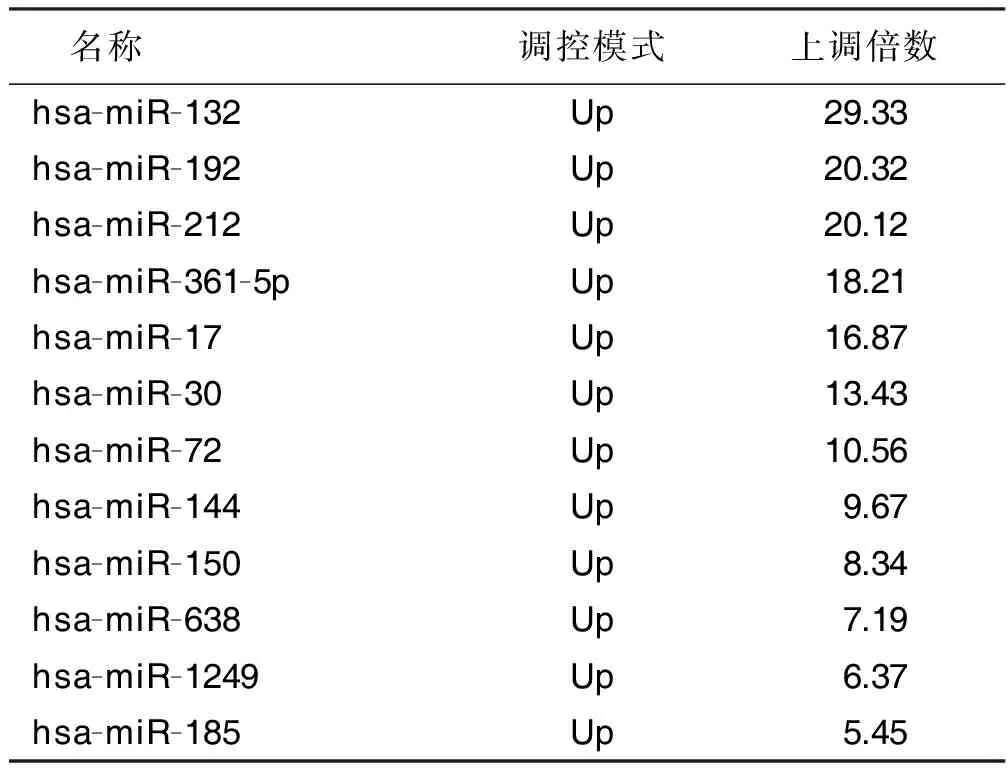
表2 两组血液miRNA表达谱差异检测结果(上调倍数)
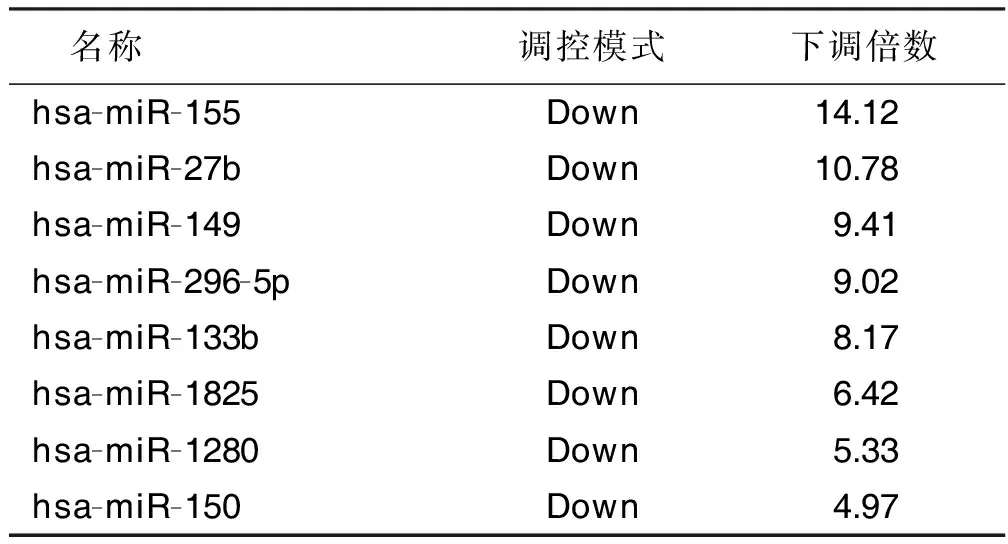
表3 两组血液miRNA表达谱差异检测结果(下调倍数)
2.7 高血压不同亚组miRNA表达水平比较 高血压病人分为3个亚组:1级高血压组、2级高血压组、3级高血压组,3组年龄、高血脂史、糖尿病史、高血压史、冠心病家族史、BMI、TC、TG、HDL-C、载脂蛋白A1(Apo-A1)、血同型半胱氨酸(Hcy)、血清总胆红素(TBIL)、纤维蛋白原(FIB)比较差异均无统计学意义(P>0.05)。3级高血压组miRNA表达上调或下调倍数高于2级高血压组,2级高血压组高于1级高血压组(P<0.05),差异均有统计学意义。其中,miRNA-132、miRNA-192、miRNA-212、miRNA-361-5p、miRNA-17、miRNA-155、miRNA-27b的特异度和敏感度较高,可作为蒙古族高血压病人与汉族高血压病人差异的标记物。
3 讨 论
miRNA的生物学作用机制一般为与靶mRNA的互补区域结合后,可以负性调控靶mRNA的翻译水平(或者直接将靶mRNA降解),从而负性调控靶基因的转录和表达。一般情况下,一个miRNA可以调控多个靶基因,而一个靶基因又可以受到多个miRNA的负性调控,从而构成一个复杂的生物学调控网络。研究表明,高血压的发病具有多环节、多靶点的特点,涉及肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的功能、血管内皮细胞及平滑肌细胞的功能及其细胞膜电离子通道的数量及功能等,并且上述各靶点均可与有相关的miRNA参与调控[6-9]。同时,研究发现机体的组织和细胞产生的miRNAs在参与高血压的发病过程中,可以进入血液循环,并在血液中被检测到。由于这些miRNAs均以某种稳定的形式存在,从而不会被血液中的RNA酶所降解。因此,这些参与高血压发病的miRNAs不仅可以作为早期诊断高血压病的生物学指标,同时也可以作为治疗高血压病的靶点[10]。
miRNA芯片检测技术是通过计算机扫描处理和定量分析芯片的高密度杂交点阵图象,从而得到miRNA差异表达谱,具有高通量、高灵敏性、高度可重复性以及生物检材需求量低等特点,已经广泛应用于包括高血压病在内的多种疾病发病机制及药物干预的研究中。本研究借助miRNA芯片检测技术的优势,成功筛查出内蒙古地区蒙古族高血压病人和汉族高血压病人差异表达的高血压病相关miRNA 20个。蒙古族高血压病人血液中hsa-miR-132、hsa-miR-192、hsa-miR-212、hsa-miR-361-5p、hsa-miR-17、hsa-miR-30、hsa-miR-72、hsa-miR-144、hsa-miR-150、hsa-miR-638、hsa-miR-1249和hsa-miR-185表达上调,hsa-miR-155、hsa-miR-27b、hsa-miR-149、hsa-miR-296-5p、hsa-miR-133b、hsa-miR-1825、hsa-miR-1280、hsa-miR-150表达下调。差异表达量与高血压分级有关,即分级越高,上调或下调越大,3级高血压最明显。根据对miRNA的靶基因进行KEGG富集分析,结果显示,内蒙古地区蒙古族居民和汉族居民的高血压患病率差异可能与凋亡信号通路(主要为p53)、TGF-β信号转导通路、VEGF信号转导通路、Wnt信号转导通路、MAPK信号转导通路、mTOR信号转导通路、Jak-STAT信号转导通路以及细胞骨架信号通路等有关。表明由于受到遗传因素以及饮食因素的影响,上述20个miRNAs在内蒙古地区的蒙古族居民和汉族居民体内存在差异表达,从而造成包括凋亡信号通路(主要为p53)、TGF-β信号转导通路等上述信号转导通路的生物活性在两个民族的居民体内存在差异,而这些信号转导通路均与高血压的发病存在密切相关关系,从而导致同一地区两个民族的居民在高血压病的发病比例上存在明显差异[2,5]。
本研究结果提示,上述20个miRNAs在内蒙古地区的蒙古族居民和汉族居民体内存在差异表达,并参与差异调控多条信号转导通路的活性,最终导致同一地区两个民族的居民高血压发病率存在明显差异。因此,上述20个miRNAs有可能作为早期诊断内蒙古地区蒙古族居民高血压病的生物学指标。但至于上述哪些miRNAs可以作为内蒙古地区蒙古族居民高血压病治疗的关键靶点,还有待于进一步研究。



