张明磊,杨清泉,李贞彩,王 星,张一帆
急性心肌梗死是临床常见的一种心血管疾病,心肌缺氧、缺血可引发心肌炎等病理变化,氧自由基生成量增加可造成心肌损伤,还可破坏心血管结构及功能,同时氧化应激反应还可促进心肌细胞凋亡从而造成心肌细胞损伤[1-2]。因此,抑制氧化应激反应有助于保护心肌组织及避免心肌损伤,从而降低急性心肌梗死等心血管疾病发生率。过氧化氢(H2O2)可促进心肌细胞凋亡而诱导心肌细胞氧化损伤[3]。研究表明,长链非编码RNA(long non-coding RNA,LncRNA)可调控H2O2诱导的心肌细胞凋亡过程[4]。长链非编码RNA ENST00000418539.1(LncRNA ENST00000418539.1)在稳定性冠心病病人单核细胞中表达上调,并可能作为稳定性冠心病诊断的潜在指标[5]。通过生物信息学分析显示,微小RNA-24(microRNA-24,miR-24)可能是ENST00000418539.1的靶基因,研究表明,miR-24在H2O2诱导的心肌细胞中表达下调,并可能参与心肌细胞损伤过程[6]。但ENST00000418539.1是否可通过调控miR-24的表达影响H2O2诱导心肌细胞氧化应激损伤尚未可知。因此,本研究采用H2O2诱导心肌细胞建立细胞损伤,探讨ENST00000418539.1对心肌细胞凋亡及氧化应激的影响,探究其对miR-24的调控作用。
1 材料与方法
1.1 材料与试剂 大鼠心肌细胞H9c2购自中国科学院上海细胞库。H2O2购自河北健宁药业有限公司;杜氏改良培养基(DMEM)、胎牛血清、胰蛋白酶购自美国Gibco公司;Lipofectamine2000购自美国Invitrogen公司;Trizol试剂购自北京全式金生物技术有限公司;反转录与实时荧光定量聚合酶链反应(qRT-PCR)试剂盒购自美国Thermo Fisher公司;ENST00000418539.1小分子干扰RNA(si-ENST00000418539.1)、乱序无意义阴性序列(si-NC)、miR-24寡核苷酸模拟物(miR-24 mimics)及阴性对照mimic NC序列(miR-NC)、miR-24特异性寡核苷酸抑制剂(anti-miR-24)及阴性对照(anti-miR-NC)购自广州锐博生物科技有限公司;丙二醛(malondialdehyde,MDA)、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自南京建成生物工程研究所;膜联蛋白Ⅴ(Annexin Ⅴ)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡试剂盒购自美国Sigma公司;RIPA裂解液、二喹啉甲酸(BCA)蛋白定量检测试剂盒购自北京全式金生物技术有限公司;兔抗鼠半胱氨酰天冬氨酸特异性蛋白酶3(cysteinyl aspartate-specific protease-3,Caspase-3)、半胱氨酰天冬氨酸特异性蛋白酶9(cysteinyl aspartate-specific protease-9,Caspase-9)抗体购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自美国Abcam公司。
1.2 方法
1.2.1 实验分组 对数生长期心肌细胞接种于96孔板(5×104个/孔),置于37 ℃、体积分数5%二氧化碳(CO2)培养箱培养24 h,使用200 μmol/L H2O2处理心肌细胞48 h[7],作为模型组。同时将正常培养的细胞作为对照组。通过Lipofectamine2000试剂分别将si-NC、si-ENST00000418539.1、si-ENST00000418539.1与anti-miR-NC、si-ENST00000418539.1与anti-miR-24转染至心肌细胞,使用200 μmol/L H2O2处理心肌细胞48 h,分别记作si-NC组、si-ENST00000418539.1组、si-ENST00000418539.1+anti-miR-NC组、si-ENST00000418539.1+anti-miR-24组。
1.2.2 qRT-PCR检测细胞中ENST00000418539.1、miR-24的表达水平 收集各组对数生长期心肌细胞,采用Trizol法提取细胞中的总RNA。应用Nanodrop2000c超微量分光光度计检测RNA浓度。ENST00000418539.1正向引物5′-CCACTAGATCGAGGTGCTTGG-3′,反向引物5′-GGTGGTACCGGAGGGAATCT-3′;miR-24正向引物5′-GTCCAGATCACCCTCACCTC-3′,反向引物5′-CAGAAAACTGC AAACGAGGC-3′;GAPDH正向引物5′-AACGGATTTGGT CGTATTG-3′,反向引物5′-GGAAGATGGTGATGGGATT-3′;U6正向引物5′-GCTTCGGCAGCACATATACT-3′,反向引物5′-GTGCAGGGTCCGAGGTATTC-3′,引物由上海生工生物工程股份有限公司设计合成。将总RNA反转录为cDNA,以cDNA为模板进行qRT-PCR反应,反应条件:95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40次循环。ENST00000418539.1以GAPDH为内参,miR-24以U6为内参,采用2-ΔΔCt法计算ENST00000418539.1、miR-24相对表达量。
1.2.3 流式细胞术检测细胞凋亡率 收集各组对数生长期心肌细胞,0.25%胰蛋白酶消化,预冷磷酸盐缓冲液(PBS)洗涤,4 ℃条件下经3 000 r/min离心10 min,加入500 μL结合缓冲液重悬细胞,加入5 μL Annexin Ⅴ-FITC与5 μL PI,充分混匀,室温振荡孵育10 min,应用FACS Calibur流式细胞仪检测各组细胞凋亡率。
1.2.4 检测MDA、LDH水平 收集各组细胞培养液,参照试剂盒检测MDA、LDH水平,严格按照试剂盒说明书进行操作。
1.2.5 双荧光素酶报告基因检测ENST00000418539.1的靶基因 starBase预测显示ENST00000418539.1与miR-24存在靶向结合位点,分别将含有结合位点与突变位点的序列插入荧光素酶报告基因载体分别构建野生型载体WT-ENST00000418539.1、突变型载体MUT-ENST00000418539.1,分别将miR-NC、miR-24 mimics与WT-ENST00000418539.1、MUT-ENST00000418539.1共转染至心肌细胞,转染48 h,收集细胞后检测相对荧光素酶活性。
1.2.6 蛋白免疫印迹(Western Blot)法检测Caspase-3、Caspase-9蛋白表达 收集各组对数生长期心肌细胞,加入400 μL RIPA裂解液,冰上孵育30 min,4 ℃条件下经3 000 r/min离心6 min,提取细胞总蛋白。采用BCA法检测蛋白浓度,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将分离的蛋白凝胶转移至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶封闭2 h,加入一抗稀释液(1∶1 000),4 ℃孵育24 h,TBST洗涤,加入二抗(1∶5 000),室温孵育1 h,TBST洗涤,加入ECL化学发光剂,应用Image J软件分析各条带灰度值。
1.3 统计学处理 采用SPSS 21.0统计学软件分析数据。定量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 干扰ENST00000418539.1对H2O2诱导H9c2凋亡及Caspase-3、Caspase-9蛋白表达的影响 与对照组比较,模型组细胞凋亡率升高(P<0.05),Caspase-3、Caspase-9蛋白水平升高(P<0.05);与模型组、si-NC组比较,si-ENST00000418539.1组细胞凋亡率降低(P<0.05),Caspase-3、Caspase-9蛋白水平降低(P<0.05)。详见图1、表1。
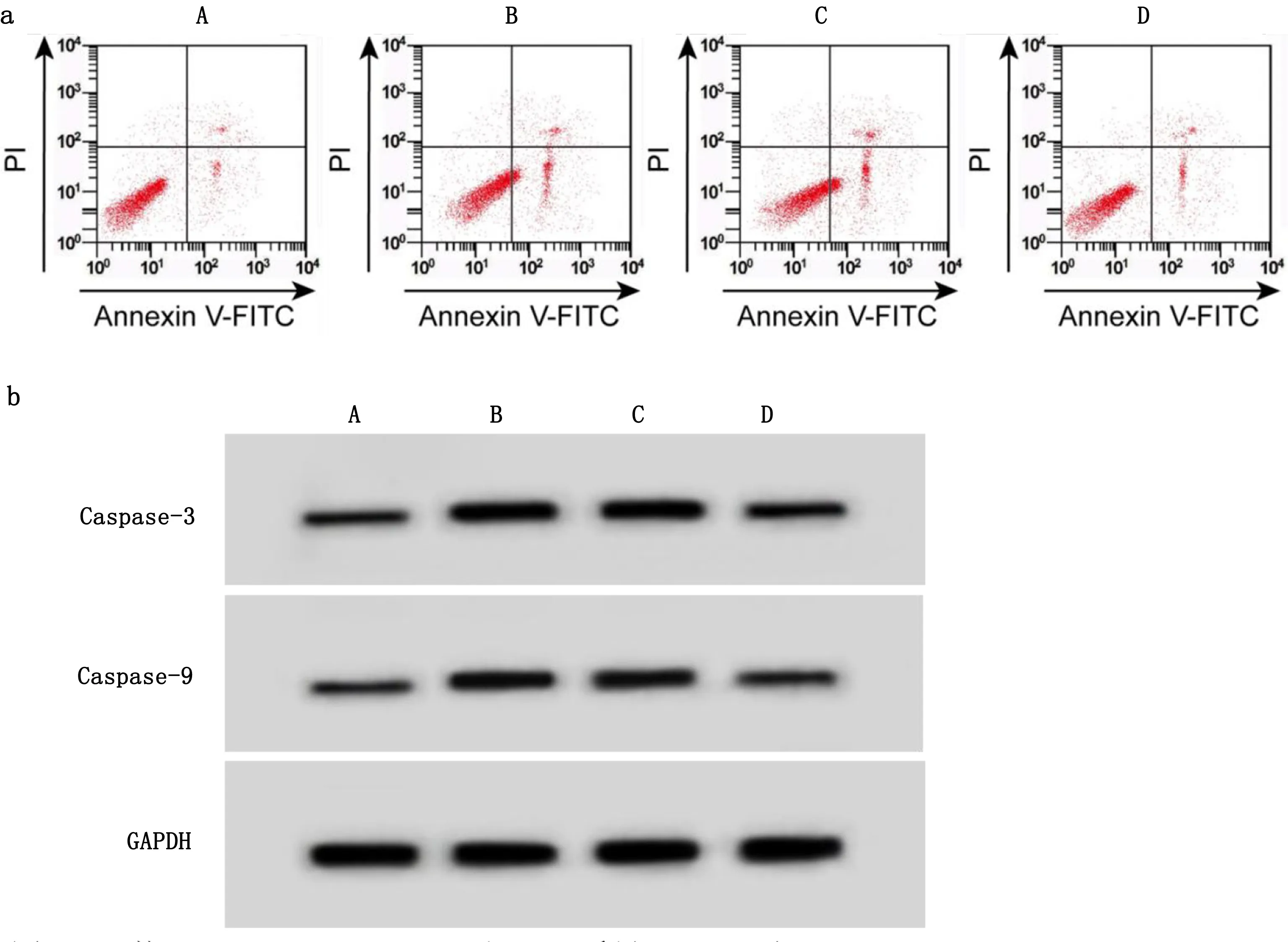
图1 干扰ENST00000418539.1对H2O2诱导H9c2凋亡及Caspase-3、Caspase-9蛋白表达的影响
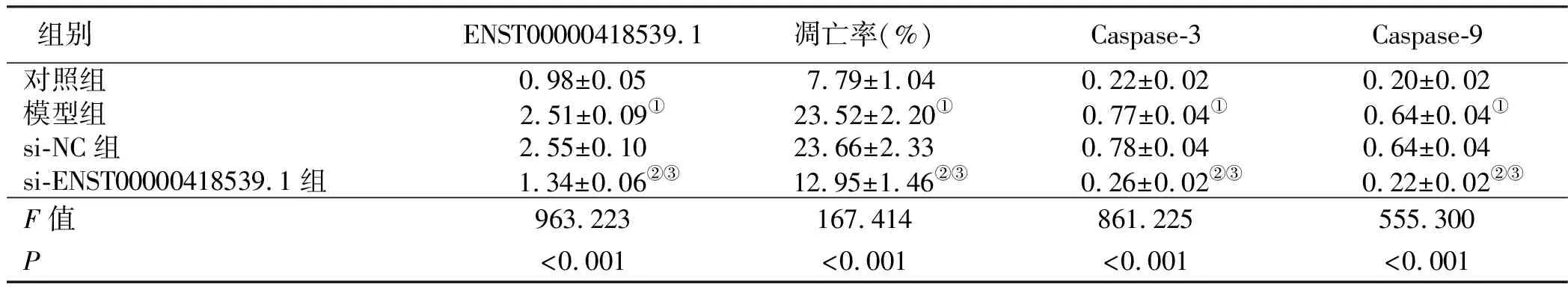
表1 干扰ENST00000418539.1对H2O2诱导H9c2凋亡及Caspase-3、Caspase-9蛋白表达的影响(x±s,n=9)
2.2 干扰ENST00000418539.1对H2O2诱导H9c2中MDA、LDH表达的影响 与对照组比较,模型组MDA、LDH水平升高(P<0.05);与模型组、si-NC组比较,si-ENST00000418539.1组MDA、LDH水平降低(P<0.05)。详见表2。
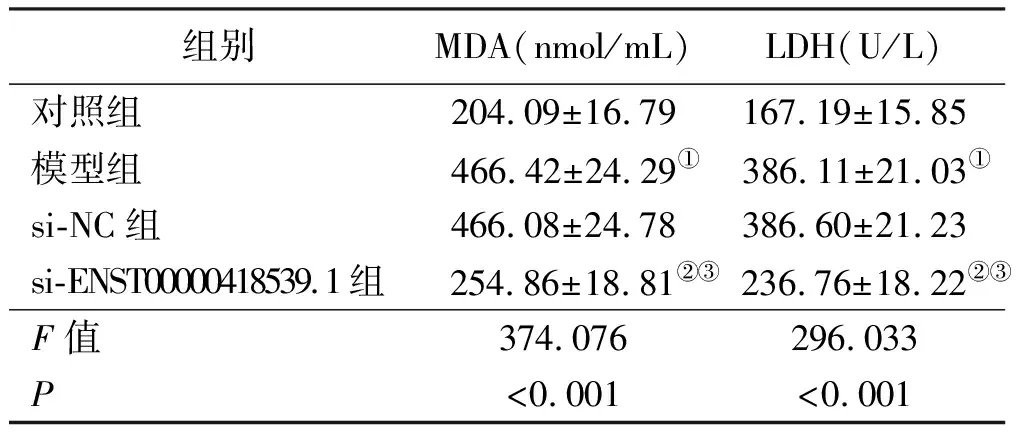
表2 干扰ENST00000418539.1对H2O2诱导H9c2中MDA、LDH表达的影响(x±s,n=9)
2.3 ENST00000418539.1靶向miR-24 starBase预测显示ENST00000418539.1与miR-24存在靶向关系,详见图2。双荧光素酶报告实验结果显示,共转染野生型载体WT-ENST00000418539.1的细胞实验中,与miR-NC组比较,miR-24组荧光素酶活性降低(P<0.05);共转染突变型载体MUT-ENST00000418539.1的细胞实验中,miR-24组荧光素酶活性与miR-NC组比较,差异无统计学意义(P>0.05),详见表3。与si-NC组比较,si-ENST00000418539.1组细胞中miR-24的表达水平升高(P<0.05)。详见表4。
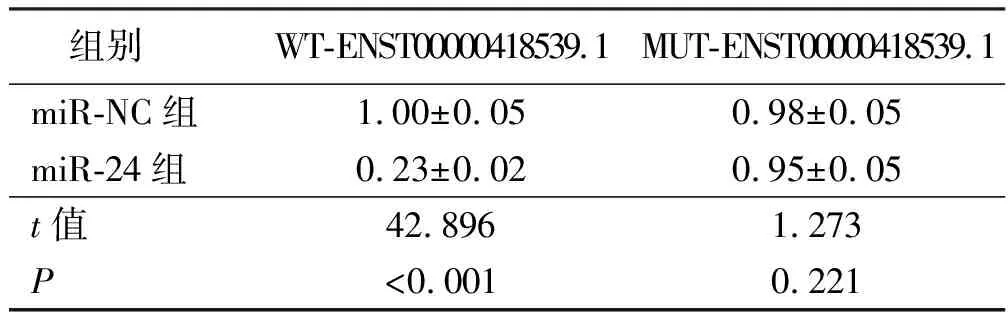
表3 双荧光素酶报告实验(x±s,n=9)

表4 miR-24的表达(x±s,n=9)
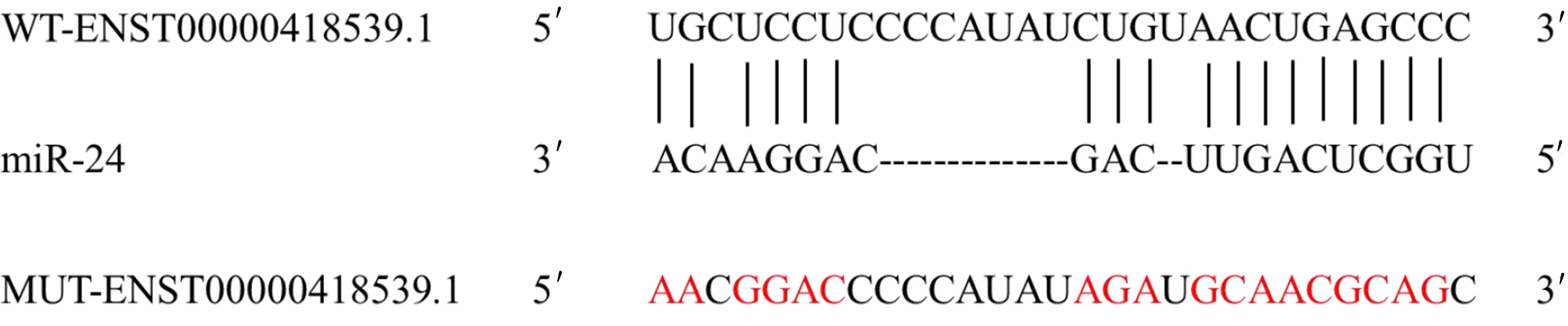
图2 ENST00000418539.1靶向miR-24
2.4 干扰miR-24能逆转干扰ENST00000418539.1对H2O2诱导H9c2凋亡的影响 与si-ENST00000418539.1+anti-miR-NC组比较,si-ENST00000418539.1+anti-miR-24组细胞凋亡率升高(P<0.05),Caspase-3、Caspase-9蛋白表达水平升高(P<0.05)。详见图3、表5。
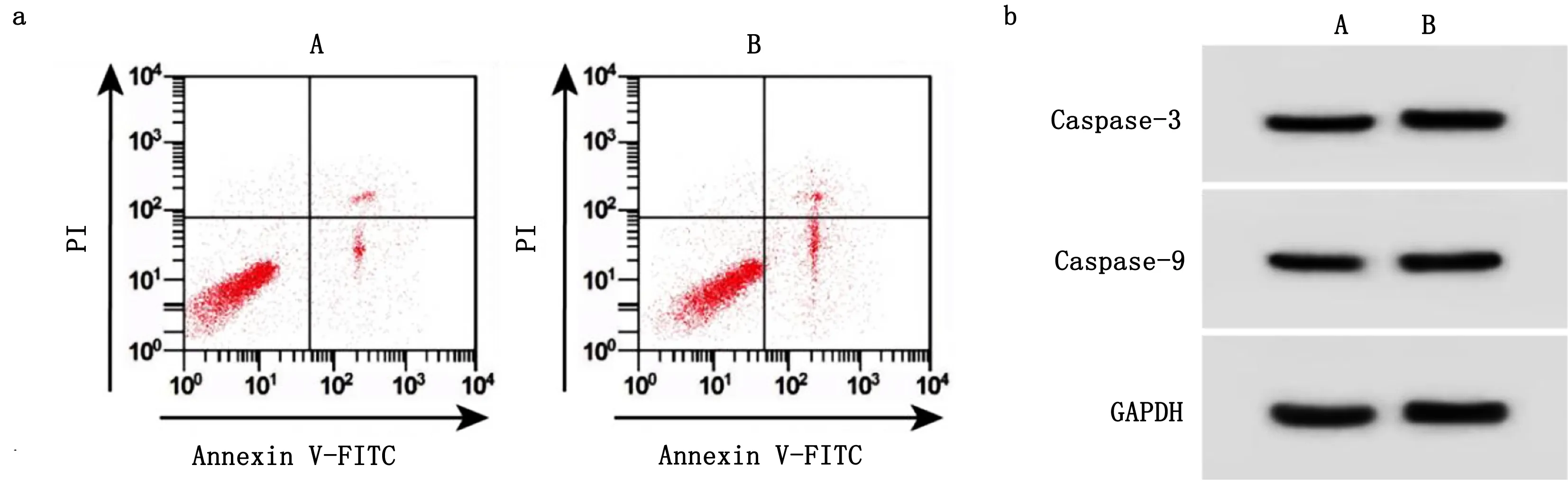
图3 干扰miR-24能逆转干扰ENST00000418539.1对H2O2诱导H9c2凋亡及Caspase-3、Caspase-9蛋白表达的影响
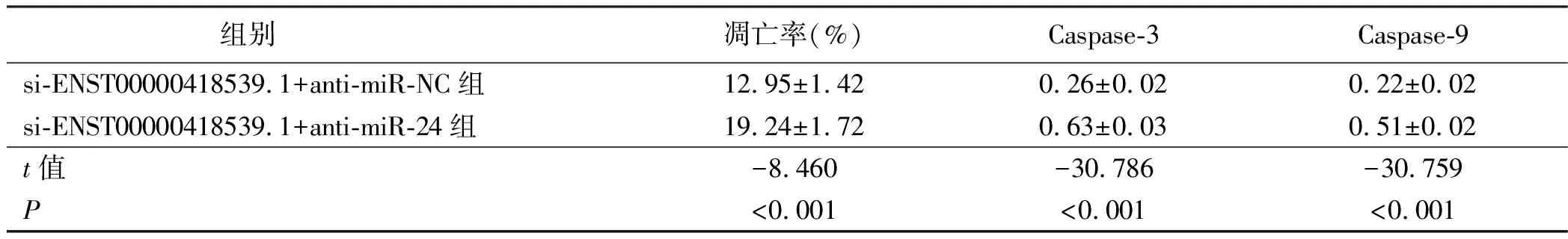
表5 干扰miR-24能逆转干扰ENST00000418539.1对H2O2诱导H9c2凋亡的影响(x±s,n=9)
2.5 干扰miR-24能逆转干扰ENST00000418539.1对H2O2诱导H9c2中MDA、LDH表达水平的影响 与si-ENST00000418539.1+anti-miR-NC组比较,si-ENST00000418539.1+anti-miR-24组MDA、LDH水平升高(P<0.05)。详见表6。
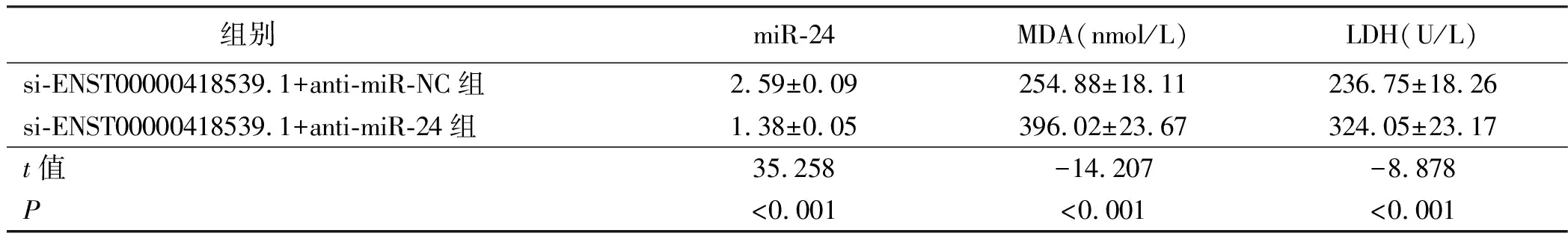
表6 干扰miR-24能逆转干扰ENST00000418539.1对H2O2诱导H9c2中MDA、LDH表达的影响(x±s,n=9)
3 讨 论
氧自由基生成与清除失衡后可引起心肌细胞氧化应激损伤,心血管疾病发生时可产生氧自由基而加重心肌细胞氧化损伤,从而促进细胞凋亡,因此,抑制氧化应激可减少心肌细胞凋亡,从而达到治疗心血管疾病的目的[8-9]。研究表明,长链非编码RNA表达异常可参与心肌细胞氧化应激损伤过程[10-12]。但仍有部分长链非编码RNA在心肌细胞损伤中的作用机制尚未阐明。本研究结果显示,H2O2可诱导心肌细胞中ENST00000418539.1表达上调,提示ENST00000418539.1在H2O2诱导心肌细胞氧化应激损伤中可能发挥重要调控作用。研究表明,Caspase-3、Caspase-9表达上调可促进细胞凋亡[13]。本研究结果显示,H2O2处理后心肌细胞凋亡率升高,Caspase-3、Caspase-9表达上调,而干扰ENST00000418539.1表达后细胞凋亡率降低,Caspase-3、Caspase-9表达下调,提示干扰ENST00000418539.1表达可降低H2O2诱导的心肌细胞凋亡率。研究表明,MDA含量升高可加重氧化损伤,LDH水平升高可促进氧化应激反应[14]。本研究结果显示,H2O2诱导心肌细胞中MDA、LDH水平升高,而干扰ENST00000418539.1表达后MDA、LDH水平降低,提示干扰ENST00000418539.1表达可降低MDA、LDH水平从而减轻氧化应激损伤。
为探究ENST00000418539.1是否通过调控miR-24表达参与心肌细胞损伤过程,本研究通过双荧光素酶报告实验与qRT-PCR实验证实ENST00000418539.1可靶向结合miR-24,并可负向调控miR-24的表达。研究表明,miR-24上调表达可减轻心肌缺血再灌注损伤[15]。miR-24通过靶向BIM减轻心肌细胞凋亡[16]。miR-24抑制POZ/BTB表达可保护内皮细胞免受糖尿病损害[17]。miR-24表达异常可参与心肌细胞凋亡过程[18]。本研究将si-ENST00000418539.1与anti-miR-24共转染至心肌细胞,随后使用H2O2处理,结果显示,细胞凋亡率升高,Caspase-3、Caspase-9表达上调,MDA、LDH水平升高,提示干扰miR-24能逆转干扰ENST00000418539.1对H2O2诱导心肌细胞凋亡及氧化应激指标MDA、LDH的作用。
综上所述,干扰ENST00000418539.1表达后H2O2诱导的心肌细胞凋亡率降低,氧化应激指标MDA、LDH水平降低,其作用机制可能与靶向调控miR-24表达有关,可为进一步揭示心肌细胞氧化应激损伤的分子机制提供实验依据。



