房娉平,阚敏宸,郭立静,孙 涛,刘文杰,霍浩然
血管性痴呆(vascular dementia,VD)是由一系列脑血管疾病导致的一种严重的认知功能障碍综合征,约占痴呆病人的20%,是仅次于阿尔茨海默病的第二大痴呆类型,严重影响病人生活质量[1]。海马CA1区是大脑认知功能脑区,脑缺血或长期血流低灌注所致海马CA1区神经元损伤是VD的病理基础[2-3]。病理生理学研究显示,脑组织缺血缺氧所致氧化应激反应在VD发生发展过程中发挥着重要作用[4-5]。
随着国家振兴中医药战略的实施及中医药现代化研究的深入,中药治疗VD逐渐得到医患的关注与认可。灯盏花属菊科多年生草本植物,是我国传统中药品种,性温、味辛,具有发表散寒、消炎止痛之功效,目前临床多用于心脑血管疾病的治疗[6]。灯盏花素(Breviscapine,Bre)是中药灯盏花的主要活性成分,具有良好的抗氧化活性[7]。核因子E2相关因子2/血红素加氧酶1(Nrf2/HO-1)通路在机体氧化应激反应中发挥着重要的调控作用[8]。本研究探讨Bre对VD大鼠海马CA1区病理学改变及Nrf2/HO-1通路的影响,现报道如下。
1 材料与方法
1.1 实验动物 健康无特定病原体(SPF)级雄性SD大鼠180只,8周龄,体质量220~250 g,购自河北医科大学实验动物学部[SYXK(冀)2018-004],合格证号:20191204011。实验前适应性饲养7 d[光照/黑暗12 h交替、温度(25±1)℃、相对湿度(60±10)%]。
1.2 实验药物与试剂 灯盏花素注射液购自石药银湖制药有限公司;尼莫地平注射液(nimodipine,NMP)购自扬子江药业集团有限公司。脱氧核糖核苷酸末端转移酶标记技术(TUNEL)试剂盒、TriQuick Reagent总RNA提取试剂盒和丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物(GSH-Px)试剂盒均购自北京索莱宝生物技术有限公司;反转录试剂盒、荧光定量聚合酶链式反应(PCR)试剂盒购自上海novoprotein公司;Nrf2、HO-1、β-actin抗体和IgG二抗购自北京博奥森生物技术有限公司。
1.3 实验方法
1.3.1 动物分组、造模与给药 将180只SD大鼠按照随机数字表法分为假手术组、模型组、Bre低剂量组(1mg/kg)、Bre中剂量组(2mg/kg)、Bre高剂量组(4 mg/kg)和NMP组(2 mg/kg),每组30只。参考文献[9]报道的方法,术前12 h禁食、自由饮水,采用钝性分离并结扎双侧颈总动脉复制VD大鼠模型;假手术组分离双侧颈总动脉但不结扎。造模完成后,Bre各剂量组和NMP组均每日1次腹腔注射相应剂量药物,假手术组和模型组每日1次腹腔注射生理盐水,疗程均为14 d[10]。
1.3.2 Morris水迷宫实验测评学习记忆能力 将平台固定于第3象限,水温设置为(25±1)℃。治疗完成后,随机取各组10只大鼠,适应性训练3 d并诱导大鼠找到位于第3象限平台。①定位航行实验:将每只大鼠分别从第1象限、第2象限、第4象限固定入水点头朝器壁方向放入水中,记录找到平台的时间(120 s内未找到平台则按120 s计算),取平均值,即逃避潜伏期;②空间探索实验:撤除第3象限平台,于第1象限固定点头朝器壁方向放入水中,记录120 s时间内穿越平台次数。逃避潜伏期和穿越平台次数分别代表认知能力中的学习能力和记忆能力。
1.3.3 海马区组织病理学检查和海马神经元凋亡状况观察 麻醉后脊椎脱臼处死,断头取脑并去除小脑、脑干后,置于4%多聚甲醛溶液中固定72 h,梯度乙醇脱水和二甲苯透明后行石蜡包埋、4 μm厚度切片,梯度乙醇脱蜡水化。①行常规苏木精-伊红(HE)染色,中性树胶封片后通过光学显微镜观察海马区组织病理学改变;②参照TUNEL试剂盒说明进行处理,50%甘油封片后观察神经元凋亡状况;凋亡指数(apoptosis index,AI)计算:每只大鼠分别取10张TUNEL染色切片,观察显微镜下细胞总数和凋亡细胞数,AI(%)=(凋亡细胞数/细胞总数)×100%。
1.3.4 电子显微镜观察海马神经元超微结构 随机取各组10只大鼠,麻醉后开胸暴露心脏,由“左心室-右心耳”通路依次灌注300 mL生理盐水和4%多聚甲醛溶液300 mL,断头取脑并剥离海马体,切割成1 mm3后置于4 ℃浓度3%戊二醛溶液中固定2 h,梯度乙醇脱水、还氧丙烷置换、环氧树脂Epon812浸透、包埋、60 nm超薄切片,醋酸铀和柠檬酸铅染色后,采用电子显微镜观察海马神经元超微结构。
1.3.5 生化分子法检测海马组织MDA含量和SOD、过氧化氢酶(CAT)活性 取各组剩余的10只大鼠,麻醉后脊椎脱臼处死、断头取脑并剥取海马组织,称量左侧海马组织并加入9倍量4 ℃裂解液后研磨匀浆,4 ℃离心(离心半径10 cm,转速3 500 r/min,时间5 min)后取上清液,按照试剂盒说明,采用硫代巴比妥酸法检测MDA含量,分别采用黄嘌呤氧化法、钼酸铵法检测SOD、CAT活性。
1.3.6 免疫印迹法(Western Blotting)检测海马组织Nrf2、HO-1蛋白表达 取海马组织匀浆液,4 ℃行两次离心(6 000 r/min、离心10 min,取上清液;12 000 r/min、离心30 min,取沉淀),Bradford法测定总蛋白含量,95 ℃水浴使蛋白变性,以30 μg蛋白量上样,SDS-PAGE凝胶电泳分离、转聚偏氟乙烯(PVDF)膜、5%脱脂牛奶室温封闭1 h、滴加目标蛋白和β-actin一抗4 ℃孵育过夜、洗膜后滴加IgG二抗室温孵育2 h,滴加电化学发光(ECL)显色并采用凝胶成像仪形成条带;通过条带灰度值,以β-actin为内参计算目标蛋白相对表达量。
1.3.7 逆转录-聚合酶链式反应(RT-PCR)法检测海马组织Nrf2mRNA、HO-1mRNA表达 取右侧海马组织头部0.1 g,采用TriQuick Reagent总RNA提取试剂盒分离纯化总RNA,通过核酸分析仪检测RNA浓度和纯度后,按照逆转录试剂盒操作说明将RNA逆转录成cDNA。按照RT-PCR试剂盒操作说明进行RT-PCR扩增,设置RT-PCR程序为94 ℃反应30 s、60 ℃反应30 s、72 ℃反应60 s,共40个循环,凝胶分析仪成像。以β-actin为内参,目的基因的相对表达量采用2-ΔΔCt法计算。Nrf2、HO-1、β-actin的RT-PCR引物序列见表1。

表1 RT-PCR引物序列

2 结 果
2.1 各组大鼠学习记忆能力比较 与假手术组比较,模型组逃逸潜伏期延长,穿越平台次数减少(P<0.01);与模型组比较,Bre中剂量组、Bre高剂量组和NMP组逃逸潜伏期缩短,穿越平台次数增加(P<0.01);与NMP组比较,Bre高剂量组逃逸潜伏期缩短,(P<0.05),穿越平台次数增加(P<0.05)。详见表2。

表2 各组大鼠学习记忆能力比较(±s)
2.2 各组大鼠海马CA1区组织病理学改变 假手术组大鼠海马CA1区神经元形态正常(圆形或椭圆形),结构完整,排列整齐、层次清晰,核膜核仁边界清晰。模型组海马CA1区神经元数量减少,排列紊乱、层次减少,胞体呈三角形或多边形,核膜、核仁边界不清,胞核固缩深染等病理学改变,病理分级明显提高。与模型组比较,Bre各剂量组和NMP组海马CA1区病理学改变呈不同程度减轻,病理分级明显降低。其中Bre高剂量组神经元排列较为整齐、层次清晰、形态较正常、结构较完整。详见图1。

图1 各组大鼠海马区组织病理学改变(HE,×200)
2.3 各组大鼠海马CA1区神经元超微结构 假手术组大鼠海马CA1区神经元胞膜、核膜完整,染色质分布均匀,线粒体结构清晰;模型组神经元胞膜肿胀破裂,胞核形态异常,核仁边界不清,染色质固缩,异染色质增多,线粒体肿胀、分裂、嵴溶解消失等超微结构病变;与模型组比较,Bre各剂量组和NMP组上述超微结构病变不同程度减轻。详见图2。

图2 各组大鼠海马CA1区神经元超微结构(×10 000)
2.4 各组大鼠海马CA1区神经元凋亡状况 假手术组大鼠海马CA1区可见极少量的凋亡神经元;与假手术组比较,模型组凋亡神经元明显增多,AI升高[(47.26±7.94)%与(3.50±0.61)%,P<0.01];与模型组比较,Bre各剂量组和NMP组凋亡神经元不同程度减少,Bre中剂量组、Bre高剂量组和NMP组AI降低[(22.39±4.85)%、(14.18±2.90)%、(17.45±3.11)%和(47.26±7.94)%,P<0.01];与NMP组比较,Bre高剂量组AI降低[(14.18±2.90)%和(17.45±3.11)%,P<0.05]。详见图3。
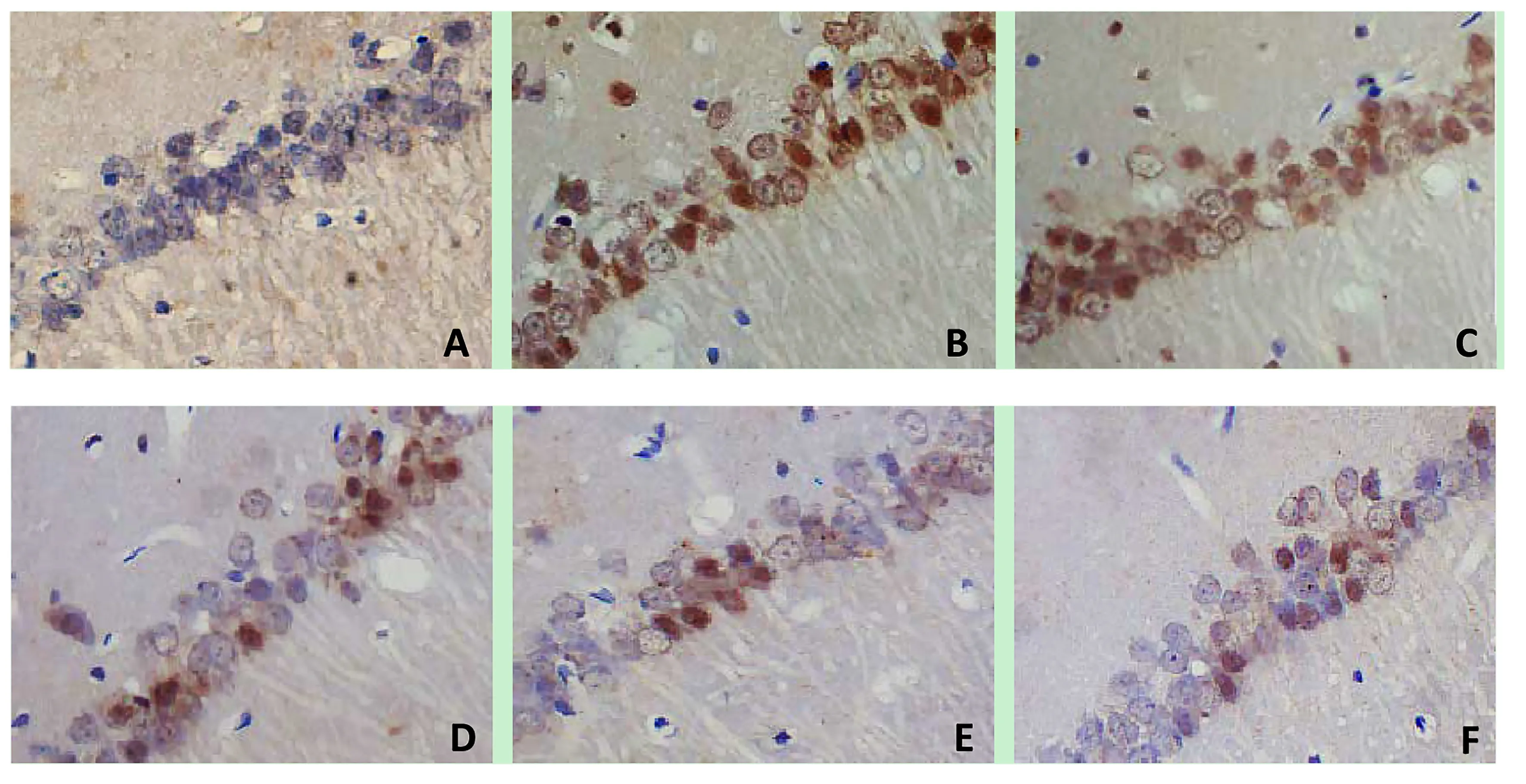
图3 各组大鼠海马神经元凋亡状况(TUNEL,×200)
2.5 各组大鼠海马组织MDA含量和SOD、CAT活性比较 与假手术组比较,模型组海马组织MDA含量升高,SOD、CAT活性降低(P<0.01);与模型组比较,Bre中剂量组、Bre高剂量组和NMP组MDA含量降低,SOD、CAT活性升高(P<0.01);与NMP组比较,Bre高剂量组MDA含量降低,SOD活性升高(P<0.05)。详见表3。

表3 各组大鼠海马组织MDA含量和SOD、CAT活性比较(±s)
2.6 各组大鼠海马组织Nrf2、HO-1蛋白表达比较 与假手术组比较,模型组大鼠海马组织Nrf2、HO-1蛋白表达降低(P<0.01);与模型组比较,Bre中剂量组、Bre高剂量组和NMP组Nrf2、HO-1蛋白表达升高(P<0.01);与NMP组比较,Bre高剂量组Nrf2、HO-1蛋白表达升高(P<0.01)。详见图4、表4。

图4 各组大鼠海马组织Nrf2、HO-1蛋白表达电泳图

表4 各组大鼠海马组织Nrf2、HO-1蛋白表达比较(±s)
2.7 各组大鼠海马组织Nrf2 mRNA、HO-1 mRNA表达比较 与假手术组比较,模型组大鼠海马组织Nrf2 mRNA、HO-1 mRNA表达降低(P<0.01);与模型组比较,Bre中剂量组、Bre高剂量组和NMP组Nrf2 mRNA、HO-1 mRNA表达升高(P<0.01);与NMP组比较,Bre高剂量组Nrf2 mRNA、HO-1 mRNA表达升高(P<0.01)。详见图5、表5。

图5 各组大鼠海马组织Nrf2 mRNA、HO-1 mRNA表达电泳图

表5 各组大鼠海马组织Nrf2 mRNA、HO-1 mRNA表达比较(±s)
3 讨 论
随着人口老龄化加剧,脑血管疾病发病率升高,VD患病人数逐年增加,严重影响老年人生命健康和生活质量。病理生理学研究发现,脑血流低灌注引发氧化应激反应,导致脑组织损伤进行性加重是VD发生发展的关键机制[11]。大脑海马CA1区与认知功能密切相关,也是对缺血缺氧敏感的脑区,因此,抑制氧化应激反应为靶点,寻找保护CA1区的新型药物对改善VD预后具有重要的临床意义。
Bre是中药灯盏花的主要活性成分,具有良好的抗氧化活性。谢雄根等[10]研究显示,Bre具有改善VD大鼠认知功能的作用,但其机制尚不明确。本研究采用国际认可的双侧颈动脉结扎法制备VD大鼠模型,腹腔注射灯盏花素进行治疗并以临床治疗VD一线用药尼莫地平为阳性对照药物,Morris水迷宫实验结果显示:经Bre治疗14 d后,VD大鼠逃逸潜伏期缩短且穿越平台次数提高;且经Bre治疗14 d后,能明显改善海马CA1区组织病变并降低病理分级,改善海马CA1区神经元超微结构病变和神经元凋亡状况,且Bre高剂量组优于NMP组,提示Bre对VD大鼠海马CA1区病理改变及学习记忆能力具有保护作用。VD多继发于脑卒中等脑血管疾病,血流持续低灌注使线粒体电子传递链受阻导致氧自由基(ROS)大量生成,以ROS为底物的SOD、CAT等抗氧化酶被过度消耗,致使ROS不能被还原代谢而蓄积,破坏核酸、DNA、蛋白质、多肽等生物大分子结构而诱导细胞凋亡[9];ROS攻击生物膜中的不饱和脂肪酸发生脂质过氧化生成MDA[12];进而导致VD发生后海马CA1区病变持续加重。
Nrf2是体内细胞普遍存在的一种核转录因子,Deshmukh等[13]研究显示,Nrf2可诱导抗氧化酶转录与表达,从而对机体的机体氧化应激反应起到重要的调控作用。HO-1是Nrf2下游基因,氧化应激状态下Nrf2被激活入核后将启动HO-1转录表达而催化降解血红素、一氧化氮等,抑制氧化应激损伤[14-15]。本研究结果显示,经灯盏花素治疗14 d后,能显着降低VD大鼠海马区组织MDA含量并提高SOD、CAT活性,明显上调Nrf2、HO-1 蛋白和mRNA表达,提示Bre具有抑制VD大鼠海马区组织氧化应激损伤的作用,可能与激活Nrf2/HO-1通路有关。
综上所述,Bre对VD大鼠海马CA1区病理改变和学习记忆能力具有保护作用,其机制可能与激活Nrf2/HO-1通路进而抑制氧化应激反应有关。VD的病理机制复杂,灯盏花素对VD的治疗作用机制有待于进一步研究。



