郭 亮,李亚洁
缺血性心律失常是心肌梗死病人常见的并发症,可减少病人冠状动脉血流量,促进心肌缺血进展,加重心肌损伤,是导致病人猝死的主要原因之一,因此,防治缺血性心律失常对提高冠心病等心血管疾病病人生活质量和存活率具有重要的临床意义[1-2]。炎症参与介导缺血性心律失常的发病过程,并促进其进展,使用抗炎药物可改善心肌缺血引发的心律失常症状[3-4]。miR-146a-5p是一种具有显着抗炎作用的微小RNA,参与介导哮喘、慢性阻塞性肺疾病、心律失常等炎性疾病的发生发展过程,过表达miR-146a通过阻止核转录因子-κB(NF-κB)信号激活抑制炎症[5],且miR-146a-5p可作为心房颤动的生物标志物,经药物治疗后其血浆水平升高[6],Notch2是其靶基因。有研究表明,miR-146a-5p可直接靶向下调Notch2表达,进而保护心肌细胞免受缺氧/复氧损伤[7-8],提示miR-146a-5p/Notch2可作为缺血性心律失常的重要治疗靶点。Hipk1是一种环状RNA,可调控炎症发生及进展,下调Hipk1表达可减少炎性因子表达分泌,抑制炎症,抑制宫颈炎进展[9],同时促进心肌细胞生长和增殖,改善心肌缺血损伤后不良心脏重塑和心功能障碍[10],因而推测干扰CircRNA Hipk1可能对缺血性心律失常具有治疗作用。本研究建立缺血性心律失常大鼠模型,探讨CircRNA Hipk1调控miR-146a-5p/Notch2轴对缺血性心律失常大鼠心肌细胞凋亡的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SD大鼠购自辽宁长生生物技术股份有限公司[SCXK(辽)2020-0001],质量合格证号No.210726200100192861,体质量(200±20)g,无特定病原体(SPF)级,雄性,参照《中华人民共和国实验动物管理条例》于我院实验动物中心饲养,分笼饲养,每笼8只,照明12 h/12 h昼夜节律,食水充足,通风良好,温度20~25 ℃,相对湿度50%~60%。
1.1.2 实验试剂与仪器 Hipk1、miR-146a-5p、U6、Notch2及GAPDH引物、CircRNA Hipk1 siRNA腺相关病毒、miR-146a-5p Antagomir、CircRNA Hipk1 siRNA阴性对照腺相关病毒、miR-146a-5p Antagomir阴性对照均购自上海吉玛制药技术有限公司;2,3,5-氯化三苯基四氮唑(TTC)染液(D025-1-1)、末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL)染色检测试剂盒(G001-1-1)、苏木精-伊红(HE)染色试剂盒(D006-1-1)、大鼠白细胞介素(IL)-17测试盒(H014-1)、大鼠IL-1β测试盒(H002)、TRIzol总RNA提取试剂(N065)、一步法逆转录实时定量聚合酶链式反应(RT-qPCR)试剂盒(N123)购自南京建成生物工程研究所有限公司。
小动物呼吸机(Kent)购自肯特企业集团公司;生物机能实验系统(BL-420F)购自成都泰盟软件有限公司;酶标仪(PT-DR200B)购自北京普天新桥技术有限公司;倒置显微镜(IX51)购自日本OlymPus公司;冰冻切片机(CM1950)购自德国Leica公司;RT-qPCR仪(Roche Light Cycler480 Ⅱ)购自瑞士罗氏公司等。
1.2 方法
1.2.1 制备缺血性心律失常大鼠模型及分组给药 SD大鼠禁食12 h后腹腔注射60 mg/kg的戊巴比妥钠麻醉,参照文献[11]制备缺血性心律失常模型:仰卧固定后气管插管,采用小动物呼吸机进行机械通气(呼吸频率70次/min,潮气量6~7 mL),将大鼠四肢皮下连接到生物机能实验系统,随时观察心电变化,大鼠前胸备皮消毒,开胸暴露心脏,钝性分离肺动脉并结扎,观察到结扎线下左心室前壁出现发绀,且标准Ⅱ导联心电图ST段抬高,表明心肌缺血成功,0.5 h后,放开结扎线,恢复血流灌注2 h,即完成造模。将大鼠随机分为模型组、CircRNA Hipk1 siRNA腺相关病毒(干扰CircRNA Hipk1)组、miR-146a-5p Antagomir(miR-146a-5p抑制剂)组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组、阴性对照(CircRNA Hipk1 siRNA腺相关病毒阴性对照+miR-146a-5p Antagomir阴性对照)组,每组12只;另外随机选择12只大鼠,仅开胸暴露心脏,不结扎肺动脉,作为假手术组。
将购买的RNA抑制剂及阴性对照溶解于生理盐水,配制成8 mg/mL的CircRNA Hipk1 siRNA腺相关病毒药液、8 mg/mL的miR-146a-5p Antagomir药液、8 mg/mL的CircRNA Hipk1 siRNA阴性对照腺相关病毒药液、8 mg/mL的miR-146a-5p Antagomir阴性对照药液、8 mg/mL的CircRNA Hipk1 siRNA腺相关病毒药液和8 mg/mL的miR-146a-5p Antagomir混合药液、8 mg/mL的CircRNA Hipk1 siRNA腺相关病毒阴性对照药液和8 mg/mL的miR-146a-5p Antagomir阴性对照混合药液,参照文献[12]及说明书,药物干预组大鼠均于放开结扎线前5 min,分组尾静脉注射10 mL/kg剂量的药液,间隔1 d后,再次注射,共注射3次,假手术组和模型组以相同方法注射等量生理盐水。
1.2.2 测定大鼠心律失常症状 药物干预后24 h,采用生物机能实验系统记录大鼠心电图并进行分析,根据室性期前收缩(ventricular premature beat,VP)、非持续性室性心动过速(nonsustained VT,NSVT)、室性心动过速(ventricular tachycardia,VT)、房室传导阻滞(atrioventricular block,AVB)等心律失常症状发生情况进行心律失常评分,评分标准:无心律失常计0分,单个VP计1分,2个VP计2分,3个VP或NSVT计3分,VT或AVB计4分,死亡计5分。
1.2.3 测量大鼠心肌梗死面积及标本采集 心律失常评分完成后,参照1.2.1方法采用戊巴比妥钠麻醉大鼠,使用注射器刺入颈动脉采集血液约1.2 mL,离心(4 ℃,15 min,3 000 r/min),吸出上清并得到血清,保存于-80 ℃冰箱中;断头处死大鼠,解剖取出心脏,每组随机选取6只大鼠心脏,清洗后,剪下约0.8 g心肌组织并保存于液氮中,剩余心肌组织置于包埋剂中,使用液氮快速冷冻,再用冰冻切片机进行连续病理切片备用;每组剩余6只大鼠心脏沿左心室长轴方向切成厚约2 mm薄片,浸入TTC染液中,37 ℃下孵育30 min,之后以4%多聚甲醛固定24 h,取出后采用Image J软件分析计算,心肌梗死面积=心肌损伤面积/总心肌面积×100%。
1.2.4 观察大鼠心肌组织病理形态及心肌细胞凋亡 取出1.2.3中的心肌组织冰冻切片,室温下复温15 min,以冰丙酮固定,各取出3张,分别使用试剂盒进行HE及TUNEL染色,具体步骤参照说明书进行,之后分别以蒸馏水漂洗后,铺在载玻片上,封片后以显微镜观察,任意选出每张切片上5个视野拍照,以Image J软件分析计算,心肌细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.2.5 测定血清IL-1β、IL-17水平 取出1.2.3中大鼠血清,置于冰水浴中提前解冻,采用相应试剂盒检测血清IL-1β、IL-17水平,具体步骤按照试剂盒说明进行。
1.2.6 测定大鼠心肌组织CircRNA Hipk1、miR-146a-5p及Notch2 mRNA表达水平 取出1.2.3中大鼠心肌组织,采用TRIzol提取其中总RNA后通过试剂盒进行RT-qPCR反应,具体步骤按照试剂盒说明进行,反应体系为20 μL,方法按照试剂盒说明书进行,反应条件:预变性(95 ℃)3 min,变性(95 ℃)12 s,退火(62 ℃)40 s,40个循环,通过2-ΔΔCt法分析数据,采用相对定量法,以U6作为miR-146a-5p的内参,以GAPDH作为CircRNA Hipk1及Notch2 mRNA的内参,检测CircRNA Hipk1、miR-146a-5p及Notch2 mRNA相对表达水平,各基因扩增引物序列见表1。

表1 各基因引物序列
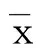
2 结 果
2.1 各组大鼠心律失常评分比较 与假手术组比较,模型组大鼠心律失常评分升高(P<0.05);与模型组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组比较,CircRNA Hipk1 siRNA腺相关病毒组大鼠心律失常评分降低(P<0.05),miR-146a-5p Antagomir组大鼠心律失常评分升高(P<0.05);阴性对照组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组与与模型组大鼠心律失常评分比较,差异无统计学意义(P>0.05)。详见表2。
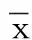
表2 各组大鼠心律失常评分比较(±s) 单位:分
2.2 各组大鼠心肌梗死面积比较 与假手术组比较,模型组大鼠心肌梗死面积增大(P<0.05);与模型组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组比较,CircRNA Hipk1 siRNA腺相关病毒组大鼠心肌梗死面积减小(P<0.05),miR-146a-5p Antagomir组大鼠心肌梗死面积增大(P<0.05);阴性对照组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组与模型组大鼠心肌梗死面积比较,差异无统计学意义(P>0.05)。详见表3、图1。
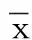
表3 各组大鼠心肌梗死面积比较(±s) 单位:%
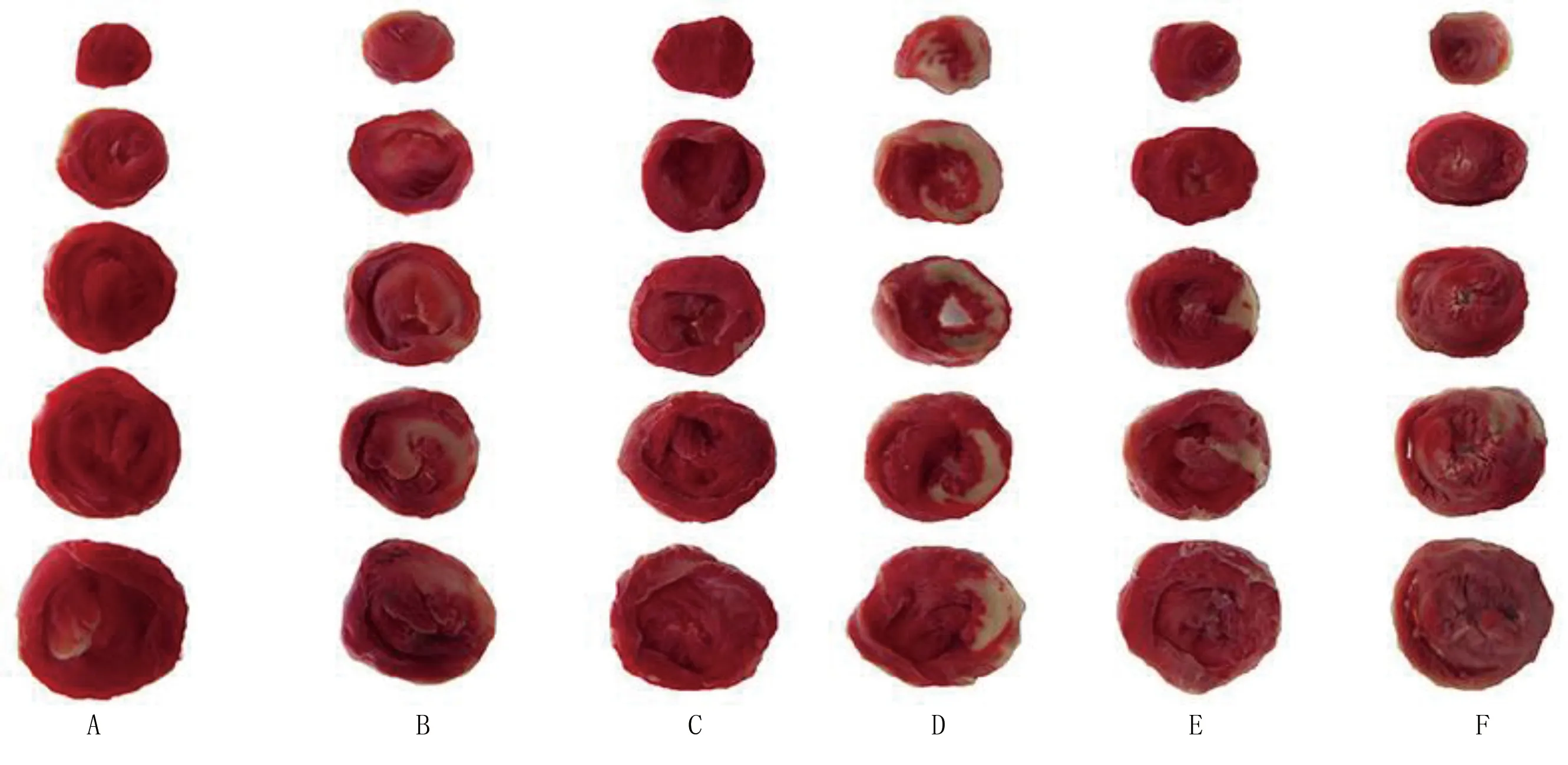
图1 TTC染色测定大鼠心肌梗死大体情况(A为假手术组;B为模型组;C为CircRNA Hipk1 siRNA腺相关病毒组;D为miR-146a-5p Antagomir组;E为CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组;F为阴性对照组)
2.3 各组大鼠心肌组织病理形态结果比较 假手术组大鼠心肌组织无明显损伤;模型组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组、阴性对照组大鼠心肌组织结构紊乱,细胞轮廓不清,排列紊乱,有炎症细胞浸润,呈明显损伤;CircRNA Hipk1 siRNA腺相关病毒组大鼠心肌组织相关病理损伤减轻;miR-146a-5p Antagomir组大鼠心肌组织上述病理损伤加重。详见图2。
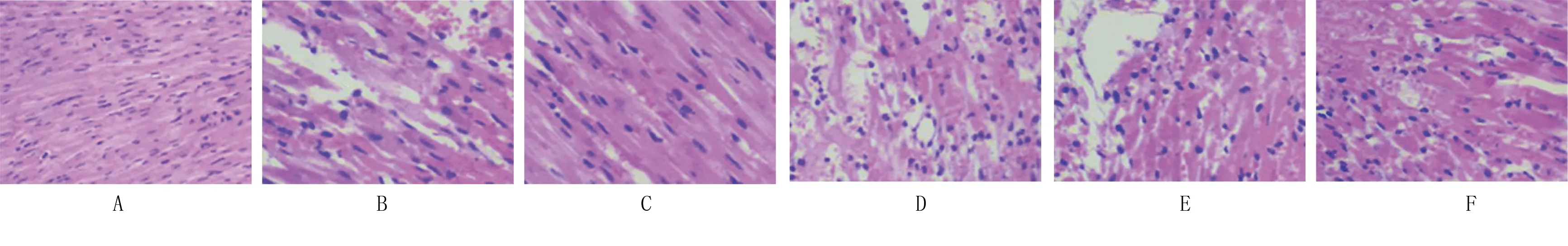
图2 HE染色测定大鼠心肌组织病理形态(A为假手术组;B为模型组;C为CircRNA Hipk1 siRNA腺相关病毒组;D为miR-146a-5p Antagomir组;E为CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组;F为阴性对照组)
2.4 各组大鼠心肌细胞凋亡率比较 与假手术组比较,模型组大鼠心肌细胞凋亡率升高(P<0.05);与模型组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组比较,CircRNA Hipk1 siRNA腺相关病毒组大鼠心肌细胞凋亡率降低(P<0.05),miR-146a-5p Antagomir组大鼠心肌细胞凋亡率升高(P<0.05);阴性对照组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组与模型组大鼠心肌细胞凋亡率比较,差异均无统计学意义(P>0.05)。详见图3、表4。
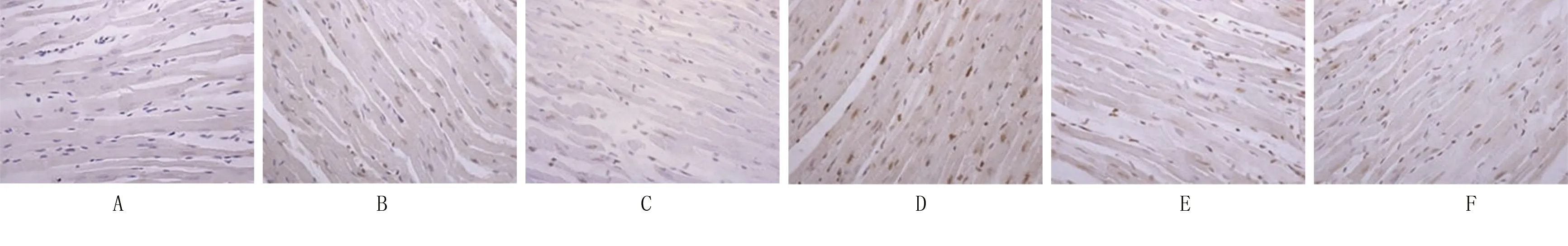
图3 TUNEL染色测定大鼠心肌细胞凋亡情况(A为假手术组;B为模型组;C为CircRNA Hipk1 siRNA腺相关病毒组;D为miR-146a-5p Antagomir组;E为CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组;F为阴性对照组)
表4 各组大鼠心肌细胞凋亡率比较(±s) 单位:%
2.5 各组大鼠血清IL-1β、IL-17水平比较 与假手术组比较,模型组大鼠血清IL-1β、IL-17水平升高(P<0.05);与模型组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组比较,CircRNA Hipk1 siRNA腺相关病毒组大鼠血清IL-1β、IL-17水平降低(P<0.05),miR-146a-5p Antagomir组大鼠血清IL-1β、IL-17水平升高(P<0.05);阴性对照组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组大鼠与模型组血清IL-1β、IL-17水平比较,差异均无统计学意义(P>0.05)。详见表5。
表5 各组大鼠血清IL-1β、IL-17水平比较(±s) 单位:pg/mL
2.6 各组大鼠心肌组织CircRNA Hipk1、miR-146a-5p及Notch2 mRNA水平比较 与假手术组比较,模型组大鼠心肌组织CircRNA Hipk1、Notch2 mRNA表达水平升高(P<0.05),miR-146a-5p mRNA表达水平降低(P<0.05)。与模型组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组比较,CircRNA Hipk1 siRNA腺相关病毒组大鼠心肌组织CircRNA Hipk1、Notch2 mRNA表达水平降低(P<0.05),miR-146a-5p mRNA表达水平升高(P<0.05);miR-146a-5p Antagomir组大鼠心肌组织CircRNA Hipk1、Notch2 mRNA表达水平升高(P<0.05),miR-146a-5p mRNA表达水平降低(P<0.05)。阴性对照组、CircRNA Hipk1 siRNA腺相关病毒+miR-146a-5p Antagomir组与模型组大鼠心肌组织CircRNA Hipk1、miR-146a-5p及Notch2 mRNA表达水平比较,差异均无统计学意义(P>0.05)。详见表6。
表6 各组大鼠心肌组织CircRNA Hipk1、miR-146a-5p及Notch2 mRNA表达水平比较(±s)
3 讨 论
心律失常作为冠心病、急性心肌梗死等心血管疾病的常见并发症,是导致心源性猝死的主要原因,心律失常的防治一直是临床工作的难点和重点。有研究表明,心肌梗死面积越大,心律失常症状越严重,因此,减轻急性心肌缺血后损伤对改善心律失常症状至关重要[13-14]。本研究通过结扎肺动脉方法建立缺血性心律失常模型,结果显示,造模大鼠心律失常评分、心肌梗死面积、心肌细胞凋亡率、血清IL-1β与IL-17水平升高,且心肌组织结构紊乱,细胞轮廓不清,排列紊乱,有炎性细胞浸润,呈明显损伤,表明心肌缺血再灌注后炎性细胞因子大量产生,引发强烈的心肌炎症,造成心肌细胞凋亡,损害心肌组织,导致心律失常,提示模型构建成功。
炎症反应在心律失常发生及病情进展过程中发挥着关键的作用,抑制炎症的发生发展,可减轻心肌缺血损伤,改善心律失常症状[15-16]。Hipk1是一种参与调控炎症和过氧化反应的环状RNA,下调其表达,可减轻炎症,改善急性呼吸窘迫综合征小鼠肺损伤,同时减少心肌缺血引发的心肌细胞凋亡,缓解心脏不良重塑,改善心功能障碍[10,17],提示Hipk1可作为防治缺血性心律失常的一个潜在作用靶点。本研究结果显示,以CircRNA Hipk1 siRNA腺相关病毒处理缺血性心律失常大鼠,可减轻心肌组织病理损伤,减小心肌梗死面积,降低心律失常评分、心肌细胞凋亡率、血清IL-1β与IL-17水平,表明下调CircRNA Hipk1表达,可减小心肌梗死面积,抑制心肌缺血引发的炎性因子过度表达,减轻心肌炎症损伤,减少心肌细胞凋亡,改善大鼠心律失常症状。
miR-146a-5p作为一种有较强抗炎活性的微小RNA,在心肌缺血损伤过程中发挥重要的调控作用,促进其表达,可降低活性氧过度释放,减轻心肌炎症,抑制心肌细胞凋亡,保护心功能[18]。Notch2作为其靶基因[7],可调控氧糖剥夺引发的严重及氧化应激反应,下调Notch2表达,可阻碍炎症发生发展,保护神经细胞免受氧糖剥夺诱导的损伤[19],同时抑制内皮间质转化,减轻高糖诱导的心肌纤维化[20],缓解缺氧/复氧导致的心肌细胞损伤[8],因此,miR-146a-5p/Notch2可作为防治缺血性心律失常的一个重要靶点。本研究结果显示,以miR-146a-5p Antagomir下调缺血性心律失常大鼠miR-146a-5p表达,可加重心肌组织病理损伤,增大心肌梗死面积,升高心律失常评分、心肌细胞凋亡率、血清IL-1β与IL-17水平、心肌组织Notch2 mRNA表达水平,表明miR-146a-5p/Notch2参与介导缺血性心律失常的发生发展过程,下调Hipk1表达,可升高miR-146a-5p表达水平,且miR-146a-5p Antagomir可减弱干扰CircRNA Hipk1表达对缺血性心律失常大鼠心肌炎症损伤及心律失常症状的改善作用,逆转对心肌细胞凋亡的抑制作用,表明下调CircRNA Hipk1表达可促进miR-146a-5p表达,降低Notch2表达,减轻心肌炎症,缓解缺血性心律失常大鼠心肌细胞凋亡及心律失常症状。
综上所述,CircRNA Hipk1参与介导缺血性心律失常的发病及进展过程,下调其表达,可上调miR-146a-5p表达,降低Notch2表达,阻碍炎症发生发展,减轻心肌病理损伤,抑制心肌细胞凋亡,改善心肌梗死及心律失常症状,调节miR-146a-5p/Notch2信号传导是其发挥抗心律失常作用的分子机制,本研究为缺血性心律失常的临床治疗提供了新靶点。



