邱雨美,李冰涛,欧阳长生,谢梦蝶,李洪铭,涂 珺,尚广彬,汤喜兰,4
研究显示,2019年全球心血管疾病患病人数为5.23亿例,死亡人数为1 860万例[1]。我国心血管疾病现患人数为3.3亿例,因心血管疾病死亡占城乡居民总死亡原因的首位,受城镇化进程及人口老龄化加速的影响,我国心血管疾病的患病率及死亡率仍处于上升阶段[2]。临床上多种心血管疾病如高血压、冠心病及心肌炎等都会引起心脏肥大。心脏肥大早期仍可维持正常的心脏功能,但持续的心脏肥大会导致心力衰竭、心律失常及猝死等严重后果[3]。
西洋参(Panax quinquefolius)为五加科人参属植物,主产于加拿大安大略和魁北克、美国威斯康辛等地,已在我国吉林和山东等地引种栽培[4]。西洋参味甘、微苦,性凉,入心、肺、肾经,具有补气养阴、清热生津的功效,用于治疗气虚阴亏、虚热烦倦、咳喘痰血、内热消渴、口燥咽干等症[5]。西洋参主要含有人参皂苷、多糖、挥发油、有机酸、甾醇、氨基酸及蛋白质类等成分[6],具有保护心脏[7]、抗氧化[8]、抗肿瘤[9]、降血糖[10]及增强免疫力[11]等作用。研究表明,西洋参对于冠状动脉结扎、异丙肾上腺素及血管紧张素Ⅱ等多种因素诱导的大鼠心脏肥大、心力衰竭模型具有良好的保护作用[12-14],但西洋参抗心脏肥大的作用机制尚未明确。因此,本研究通过网络药理学方法分析西洋参抗心脏肥大的作用靶点及机制,进一步在大鼠H9c2心肌细胞肥大模型上对作用靶点进行验证,以期为西洋参用于心血管疾病的防治提供参考。
1 资料与方法
1.1 西洋参活性成分及药物靶点的筛选 利用中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com)收集西洋参的主要化学成分,以“西洋参”为关键词,后对其包含的所有化合物根据吸收、分布、代谢和排泄(ADME)相关参数进行潜在活性成分筛选,参数设置为:口服生物利用度(OB)≥30%,类药性(DL)≥0.18。运用中医药百科全书(ETCM,http://ww.tcmip.cn/ETCM/)和查找已发表的文献进一步补充西洋参的活性成分。将成分输入有机小分子生物活性数据库(PubChem,http://pubchem.ncbi.nlm.nih.gov),根据类药五原则(Lipinski原则,氢键供体数≤5个、氢键受体数≤10个、相对分子量≤500、脂水分配系数≤5、化合物中可旋转键的数量不超过10个),选择符合2项规则以上的成分,获取Canonical SMILES号,并通过基于多靶点定量构效关系的靶点预测平台数据库(Targetnet,http://targetnet.scbdd.com/)和小分子药物靶点预测在线平台(Swiss Target Prediction,http://www.swisstargetprediction.ch/)以显着性水平(Prob)>0为原则筛选西洋参的作用靶点;利用蛋白质数据库Uniprot(https://www.uniprot.org/)查询每个蛋白靶点对应的基因名,确定物种来源为“Human”并建立数据库,用于后续分析。
1.2 心脏肥大疾病靶点的筛选 通过人类孟德尔遗传数据库(OMIM,http://www.omim.org)、药物靶标数据库(TTD,http://bidd.nus.edu.sg/group/cjttd)、基因名片数据库(GeneCards,http://www.genecards.org/),以“cardiomyocyte hypertrophy”为关键词,收集已知验证的与心脏肥大相关的人类基因,删去重复项,取并集,获得心脏肥大相关靶点。
1.3 西洋参抗心脏肥大潜在靶点的获取 将西洋参成分靶点与心脏肥大疾病靶点导入Venny 2.1.0(http://bioinfogp.cnb.csic.es/tools/venny/index.html),提取同时出现在药物靶点与疾病靶点中的共同靶点,即为西洋参治疗心脏肥大的潜在作用靶点。
1.4 西洋参抗心脏肥大潜在靶点相互作用网络的构建 打开STRING数据库(https://string-db.org/),进入页面首先选择“multiple proteins”条目,输入获得的交集靶点名称,物种限定为“Homo sapiens”,最低相互作用阈值设为中等“Medium confidence(0.400)”,隐藏游离节点,其余参数保持默认值进行检索,下载蛋白-蛋白相互作用(PPI)结果(tsv格式文件),而后将其导入Cytoscape 3.8.0软件进行可视化分析,通常根据度中心性Degree值,计算其平均数,以大于平均数的靶点在网络中为重要靶点,大于平均数2倍的为关键靶点,获得西洋参治疗心脏肥大的PPI网络图。
1.5 生物信息学基因本体(GO)功能注释和京都基因与基因组百科全书(KEGG)通路富集分析 使用注释、可视化和综合发现数据库(DAVID,https://david.ncifcrf.gov/home.jsp)对上述筛选得到的重要靶点进行生物功能及分子信号通路的富集分析。其中,从生物过程(biological process,BP)、细胞组分(cell component,CC)和分子功能(molecular function,MF)3个水平进行GO富集分析,选择BP校正P值最小的前15个条目进行可视化;并使用基迪奥生物信息云平台(Omicshare在线平台,https://www.omicshare.com/)将KEGG富集程度较高的前20条通路绘制成气泡图。
1.6 体外实验验证
1.6.1 细胞株、药物和试剂 大鼠H9c2细胞株购自协和医科大学细胞实验中心;异丙肾上腺素(中国食品药品检定研究院,批号:Z21N10X103254,纯度≥99.2%);DMEM高糖培养基(美国Gibco公司,批号:8121192);胎牛血清(美国Gemini公司,批号:A15H74K);磷酸盐缓冲液(PBS)(武汉赛维尔生物科技有限公司,批号:GP21010070226);0.25%胰蛋白酶(美国Gibco公司,批号:2120732);噻唑蓝(MTT)试剂(广州赛国生物科技有限公司,批号:EZ3455C328);DEPC处理水(上海生工生物工程技术服务有限公司,批号:G430KA5395);RNA提取试剂盒、反转录试剂及实时荧光定量PCR(qPCR)试剂[Takara宝生物工程(大连)有限公司,批号分别为:AJG1902A、AL12354A、AK81975A]。
1.6.2 仪器 MI52-N倒置显微镜(广州明美光电技术有限公司),Spectra Max Plus384 全波长酶标仪(美国Molecular Devices公司),TGL20M台式高速冷冻离心机(盐城凯特实验仪器有限公司),CFX96TMReal-Time PCR仪(美国Bio-rad公司)。
1.6.3 细胞培养与细胞活力检测 将H9c2心肌细胞置于含10%胎牛血清的DMEM高糖培养基中培养。将生长状态良好的细胞以每孔5×103个接种于96孔板中,培养24 h后加入不同浓度的西洋参,根据加入西洋参浓度的不同分为12.5 μg/mL西洋参组、25.0 μg/mL西洋参组、50.0 μg/mL西洋参组、100.0 μg/mL西洋参组、200.0 μg/mL西洋参组,将加入含0.1%二甲基亚砜(DMSO)的培养基作为正常组。药物作用24 h后进行MTT法检测,在酶标仪492 nm波长处检测各孔吸光度(OD),计算细胞增殖抑制率(IC%)=(正常组OD-西洋参各浓度组OD)/正常组OD×100%,观察西洋参对心肌细胞活力的影响。
1.6.4 心肌细胞表面积检测 采用异丙肾上腺素10 μmol/L复制H9c2心肌细胞肥大模型,以心肌细胞表面积增大和心脏肥大相关胚胎基因心房钠尿肽(ANP)、β-肌球蛋白重链(β-MHC)、α-骨骼肌肌动蛋白(α-SKA)表达上调表明模型制作成功。将5×103个处于对数生长期的心肌细胞接种至35 mm培养皿中,接种24 h后将细胞分为正常组(加入与其他各组等体积的溶媒0.2% DMSO)、模型组(加入异丙肾上腺素10 μmol/L)、西洋参干预组(预先1 h加入西洋参100.0 μg/mL,而后加入异丙肾上腺素10 μmol/L)、西洋参单独组(加入西洋参100.0 μg/mL)。药物作用24 h后,采用明美显微数码测量分析系统拍照并运用ImageJ软件测量心肌细胞面积。
1.6.5 逆转录聚合酶链反应(qRT-PCR) 将1×105个心肌细胞接种于35 mm的培养皿中,接种24 h后,实验分组和加药同1.6.4。药物作用24 h后,按照Trizol试剂盒说明书提取总RNA并定量。取1 μg RNA逆转录为cDNA后进行扩增反应,扩增条件:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。以18S rRNA为内参基因,采用10倍稀释制作内参基因和目的基因的标准曲线,稀释范围为10-5~1,根据双标准曲线法计算心脏肥大相关胚胎基因ANP、β-MHC、α-SKA及关键靶点基因血管内皮生长因子A(VEGFA)、丝氨酸/苏氨酸蛋白激酶1(AKT1)、表皮生长因子受体(EGFR)、肿瘤坏死因子(TNF)、丝裂原活化蛋白激酶1(MAPK1)的相对表达水平。引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 qRT-PCR引物序列
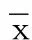
2 结 果
2.1 西洋参潜在活性化合物及其作用靶点 通过TCMSP平台及ETCM共检索到西洋参活性成分45个,去除无明确对应靶点的化学成分共获得有效活性成分42个(见表2),去除重复项得到西洋参作用靶点共558个。
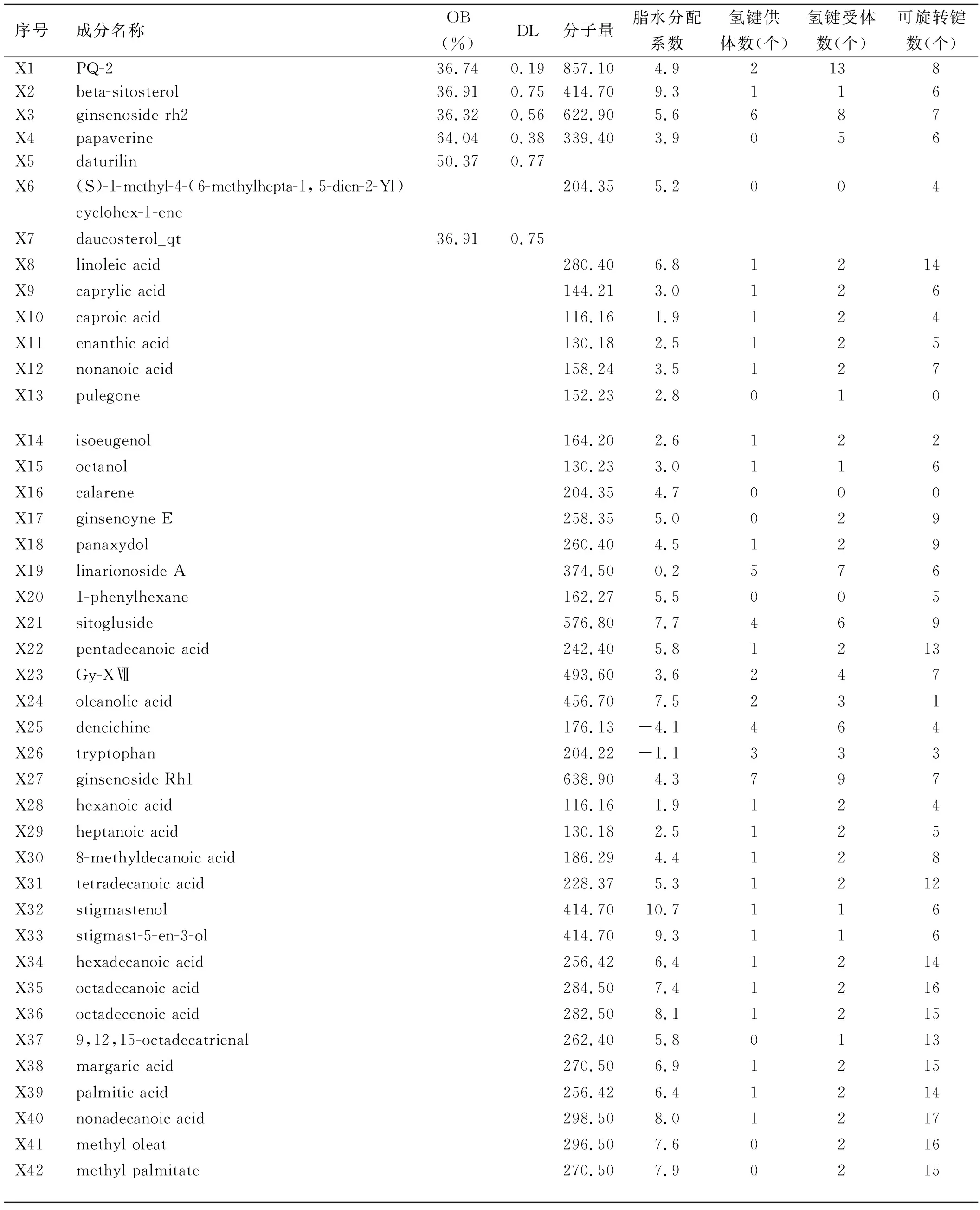
表2 西洋参活性成分信息
2.2 西洋参治疗心脏肥大的潜在作用靶点 经过数据库检索,删除重复项靶点获得心脏肥大疾病靶点809个,通过Venny 2.1.0软件获取西洋参和心脏肥大的作用靶点交集,其中共同作用靶点41个,约占集合总数的3.1%,获得西洋参和心脏肥大的Venny图,详见图1。
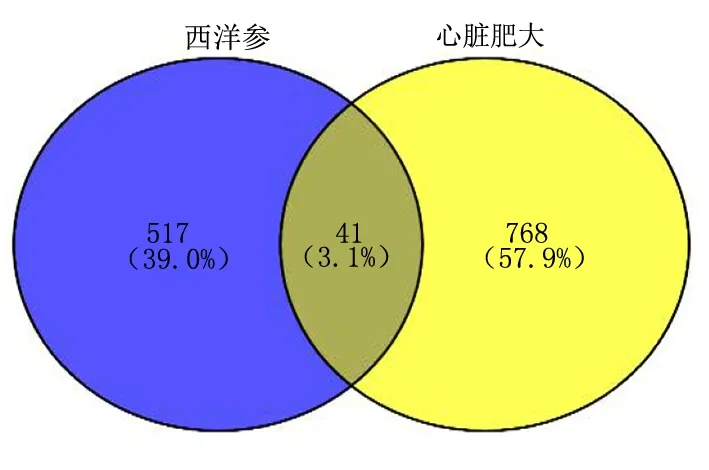
图1 西洋参活性成分靶点与心脏肥大相关靶点Venny图
2.3 西洋参抗心脏肥大潜在靶点相互作用网络的构建 将获得的交集靶点输入STRING数据库构建PPI网络图,并借助Cytoscape 3.8.0进行可视化,删除游离项(见图2)。图中节点为靶点,边为靶点之间的联系;节点的颜色及大小反映节点的Degree值,颜色越深、节点越大则其Degree值越大,边的粗细反映连接程度,边越粗,连接越紧密。在西洋参抗心脏肥大作用PPI网络中,有21个靶点的Degree值大于平均值,其中VEGFA(28)、AKT1(26)、EGFR(25)、TNF(25)、MAPK1(24)是Degree值大于平均数2倍的靶点,为关键靶点,可能在西洋参治疗心脏肥大的过程中发挥重要作用。
2.4 GO功能富集分析与KEGG通路富集分析 利用DAVID在线平台对PPI网络中大于平均Degree值的21个关键靶点进行富集分析。GO分析共获得247个条目,其中BP分类主要包括一氧化氮合成过程的正调控(positive regulation of nitric oxide biosynthetic process)、脂多糖介导的信号通路(lipopolysaccharide-mediated signaling pathway)、肽基-丝氨酸磷酸化的正调控(positive regulation of peptidyl-serine phosphorylation)等193个条目;CC分类主要包括细胞膜质(plasma membrane)、细胞表面(cell surface)、蛋白质复合物(protein complex)等26个条目;MF分类主要包括酶结合(enzyme binding)、一氧化氮合酶调节活性(nitric-oxide synthase regulator activity)、支架蛋白结合(scaffold protein binding)等28个条目。根据错误发现率(FDR值)由小到大排序,筛选出BP结果中前15条绘图(见图3)。KEGG富集分析共获得89条信号通路,80条信号通路的阈值P<0.05,选取前20条信号通路,借助Omicshare平台绘制西洋参作用于心脏肥大的可视化气泡图(见图4)。西洋参抗心脏肥大主要与癌症蛋白多糖(proteoglycans in cancer)、血管内皮生长因子信号通路(VEGF signaling pathway)、缺氧诱导因子-1信号通路(HIF-1 signaling pathway)等有关。上述结果提示西洋参主要活性成分的作用靶点涉及的生物学过程的多样化,并分布于不同的代谢通路。
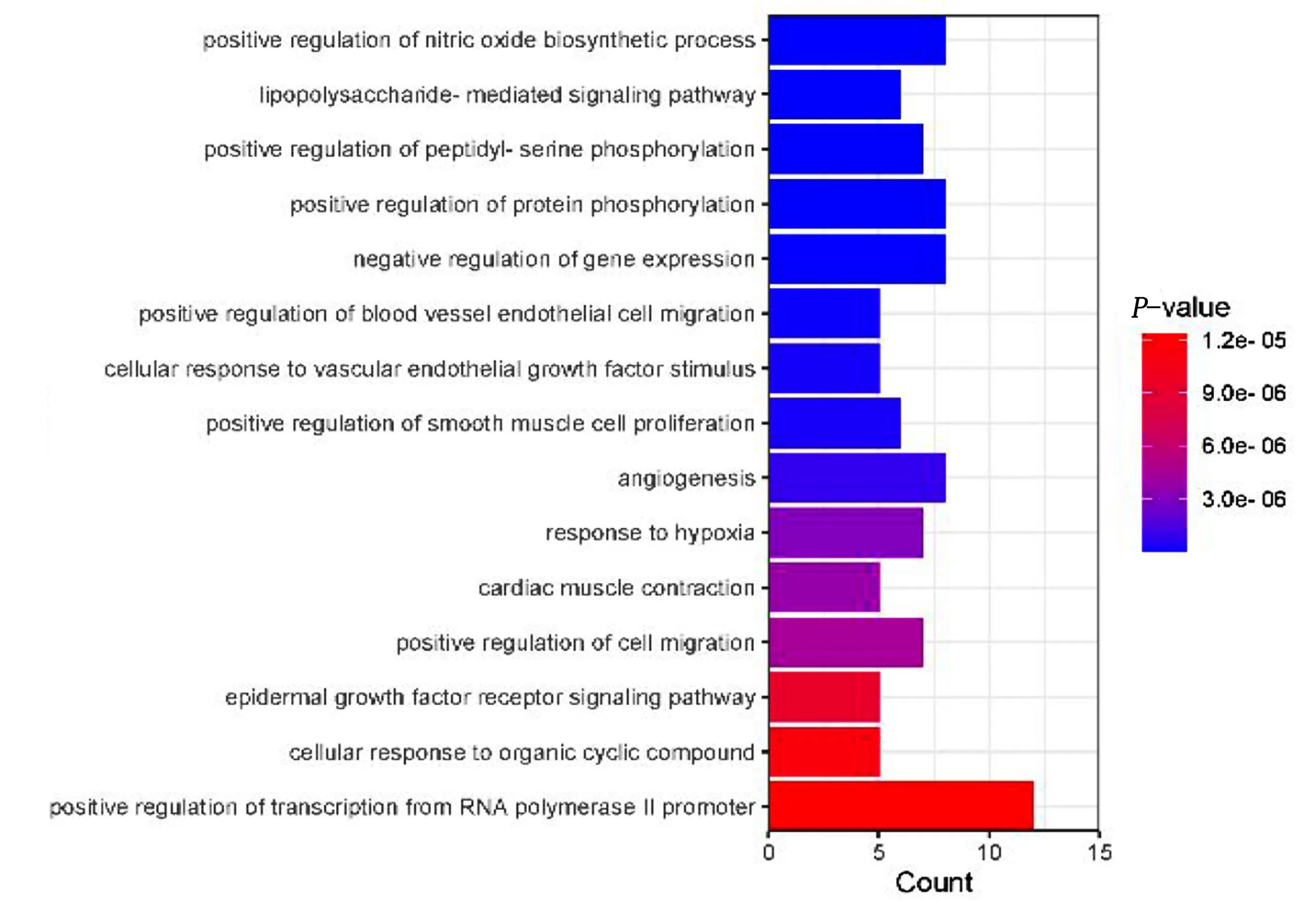
图3 西洋参治疗心脏肥大GO生物过程富集分析
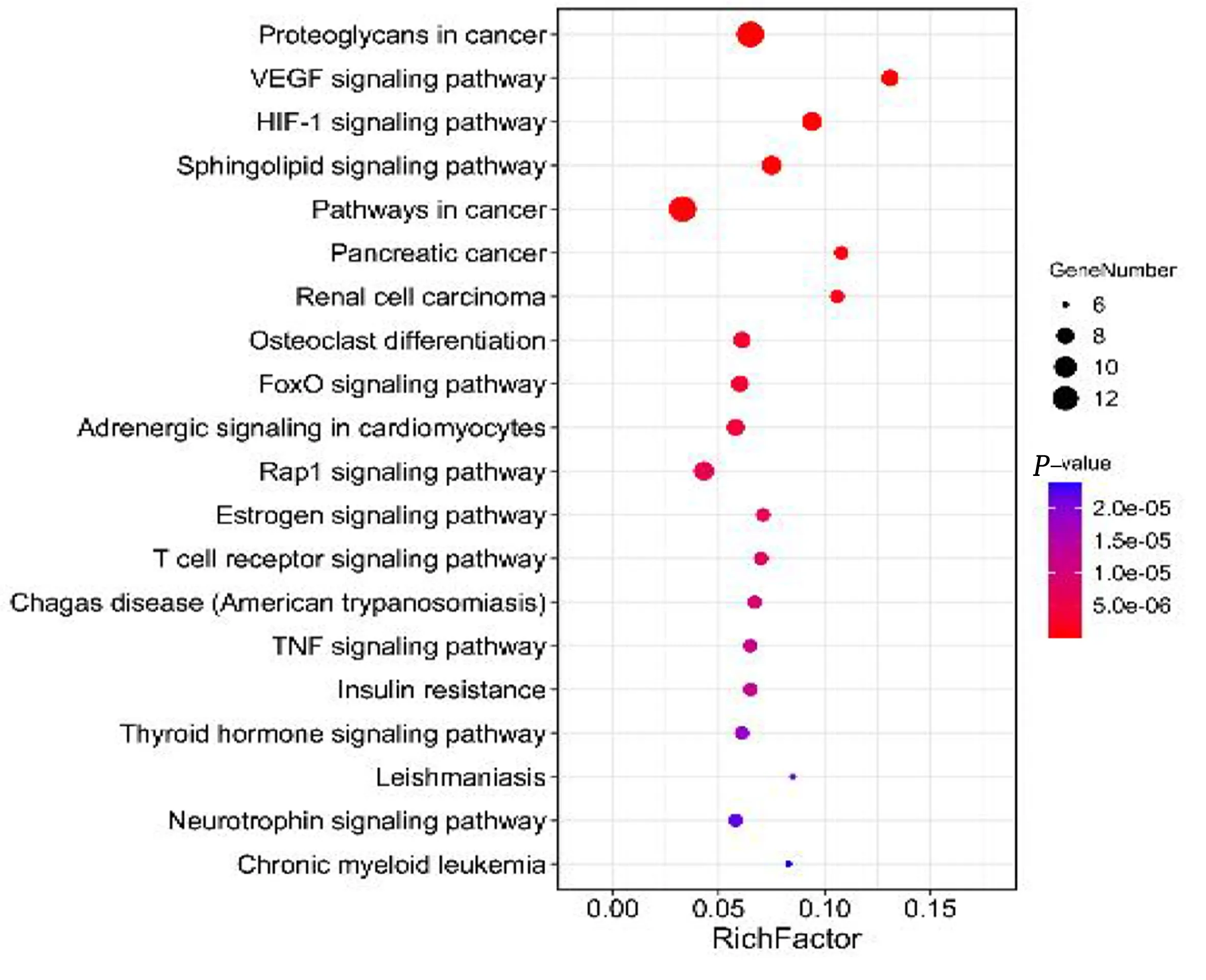
图4 西洋参治疗心脏肥大的KEGG富集分析
2.5 细胞实验验证
2.5.1 不同浓度西洋参对H9c2心肌细胞活力的影响 12.5 μg/mL西洋参组、25.0 μg/mL西洋参组、50.0 μg/mL西洋参组、100.0μg/mL西洋参组心肌细胞抑制率与正常组比较,差异均无统计学意义(P>0.05),而200 μg/mL西洋参组与正常组比较,差异有统计学意义(P<0.05)。故本研究选用100.0 μg/mL的西洋参用于评价对异丙肾上腺素诱导的心肌细胞肥大的影响。详见表3。
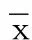
表3 不同浓度西洋参对H9c2心肌细胞活力的影响(±s)
2.5.2 西洋参对异丙肾上腺素诱导的心肌细胞肥大的影响 与正常组比较,模型组心肌细胞表面积增加,ANP、β-MHC、α-SKA mRNA表达上调,差异均有统计学意义(P<0.05)。与模型组比较,西洋参干预组心肌细胞表面积降低,ANP、β-MHC、α-SKA mRNA表达均下调,差异均有统计学意义(P<0.05)。与正常组比较,西洋参单独组心肌细胞表面积及ANP、β-MHC、α-SKA mRNA表达,差异均无统计学意义(P>0.05)。详见图5、图6。
与正常组比较,* P<0.05;与模型组比较,# P<0.05。图5 西洋参对异丙肾上腺素诱导的心肌细胞表面积的影响(n=6)

与正常组比较,* P<0.05;与模型组比较,# P<0.05。图6 西洋参对异丙肾上腺素诱导的心肌细胞肥大基因表达的影响(A为ANP mRNA相对表达量,B为β-MHC mRNA相对表达量,C为α-SKA mRNA相对表达量,n=6)
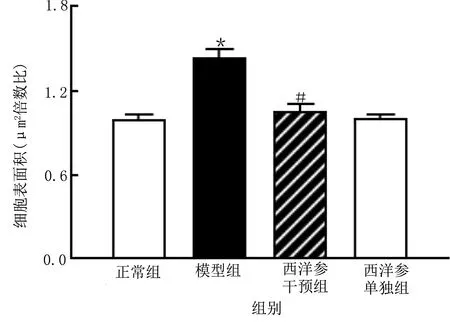
2.5.3 西洋参对异丙肾上腺素诱导的心肌细胞VEGFA、AKT1、EGFR、TNF、MAPK1基因表达的影响 网络药理学富集分析筛选显示VEGFA、AKT1、EGFR、TNF、MAPK1可能是西洋参干预心脏肥大的关键靶点。qRT-PCR验证实验结果表明,与正常组比较,模型组心肌细胞VEGFA、AKT1、EGFR、TNF、MAPK1 mRNA表达上调,差异均有统计学意义(P<0.05),与模型组比较,西洋参干预组心肌细胞VEGFA、AKT1、EGFR、TNF、MAPK1 mRNA表达下调,差异均有统计学意义(P<0.05)。详见图7、图8。
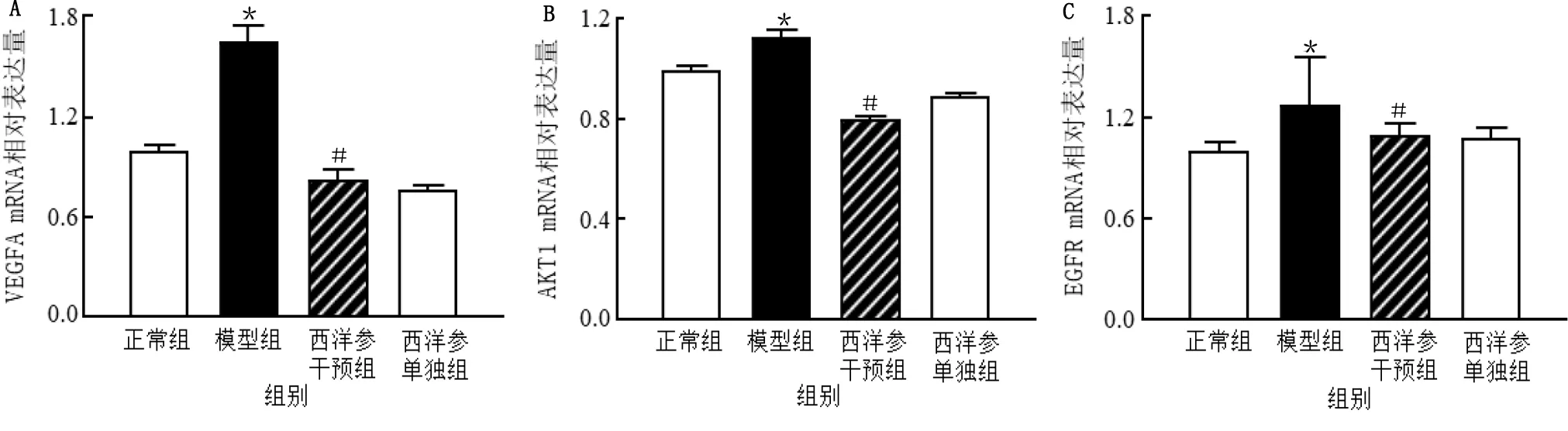
与正常组比较,*P<0.05;与模型组比较,# P<0.05。图7 西洋参对异丙肾上腺素诱导的心肌细胞VEGFA、AKT1、EGFR基因表达的影响(A为VEGFA mRNA相对表达量,B为AKT1 mRNA相对表达量,C为EGFR mRNA相对表达量,n=5)
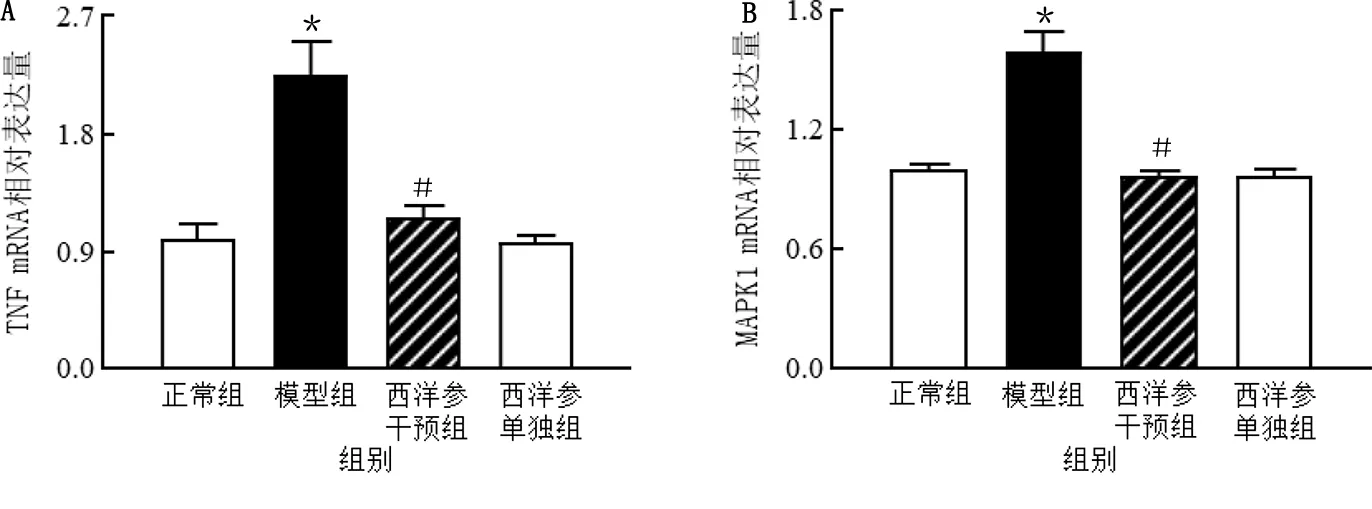
与正常组比较,*P<0.05;与模型组比较,# P<0.05。图8 西洋参对异丙肾上腺素诱导的心肌细胞TNF、MAPK1基因表达的影响(A为TNF mRNA相对表达量,B为MAPK1 mRNA相对表达量,n=5)
3 讨 论
心脏肥大是心肌组织为适应多种病理刺激如血流动力学超负荷、循环激素增加等因素而产生的适应性反应,是多种心血管疾病如高血压、冠心病等的常见并发症,其病理改变表现为心肌细胞体积增大、心脏胚胎基因重编程和一些心脏发育期的转录因子重新激活、心脏收缩和舒张功能降低、胶原纤维沉积及心脏重构等[3,15]。西洋参以其多成分、多靶点、多途径的优势在心脏肥大等心血管疾病的防治研究和应用较为广泛。西洋参及其活性成分具有抑制心肌细胞凋亡、改善血液循环、抑制氧化应激和炎症反应等多方面的作用[16]。研究表明,西洋参提取物可通过阻断p115Rho鸟嘌呤核苷酸交换因子-Ras同源基因家族成员A/Rho相关卷曲螺旋蛋白激酶(p115RhoGEF-RhoA/ROCK)依赖的丝裂原活化蛋白激酶(p38 MAPK)激活而抑制瘦素诱导心肌细胞肥大[17],可通过阻断蛋白激酶A(PKA)激活和环磷酸腺苷反应元件结合蛋白(CREB)磷酸化而减轻异丙肾上腺素诱导的心脏肥大[13],还可通过调节脂肪酸和葡萄糖的氧化缓解血管紧张素Ⅱ诱导的心脏肥大[14]。
本研究利用网络药理学的方法从TCMSP和ETCM数据库及相关文献中共筛选出42种西洋参活性成分,再与OMIM、TTD 以及GeneCards数据库筛选出的心脏肥大相关靶点进行比对,获得西洋参抗心脏肥大靶点41个。进一步PPI网络分析表明,VEGFA、AKT1、EGFR、TNF和MAPK1可能是西洋参抗心脏肥大的关键靶点。VEGFA是血管生成的关键介质,其与心脏的关系是双向的,一方面,受炎症、机械应力、内皮素-1和转化生长因子-β等刺激因素的影响,心肌细胞分泌和释放VEGFA;另一方面,VEGFA诱导心肌细胞激活,促进心肌组织的血管生成,增强心肌的收缩和存活[18]。研究表明,在异丙肾上腺素或主动脉弓缩窄术诱导的小鼠心脏肥大模型中,VEGFA表达上调[19-20]。AKT1为丝/苏氨酸蛋白激酶,参与调节心脏生长、增殖、迁移和代谢,与心脏肥大密切相关[21]。研究表明,心脏中长期AKT1的激活可降低心肌线粒体的氧化能力而导致心脏肥大[22]。AKT1在血管紧张素Ⅱ灌注诱导的心脏肥大模型和高血压心肌纤维化模型中均表达上调[23-24]。EGFR是受体型蛋白酪氨酸激酶,广泛表达于心脏和血管组织中,EGFR通路参与细胞增殖、分化和周期调控等生物过程,与心血管疾病的发生发展密切相关。研究表明,EGFR激活可促进内脂素、血管紧张Ⅱ等诱导的心肌肥大[25-26],抑制EGFR活性和EGFR依赖的细胞内信号通路可缓解心脏肥大[27-28]。TNF-α介导的核转录因子-κB(NF-κB)激活参与了心脏肥大,人参皂苷Rg1抑制TNF-α/NF-κB信号通路可缓解主动脉弓缩窄术诱导的大鼠心脏肥大[29]。MAPK1参与多种炎性因子的信号转导,调控细胞增殖、分化和凋亡。研究发现,在主动脉弓缩窄术或异丙肾上腺素诱导小鼠心脏肥大时,心肌细胞外信号调节激酶2(ERK2)蛋白磷酸化水平增加[30]。
为进一步探讨西洋参抗心脏肥大的作用机制,本研究对西洋参抗心脏肥大关键靶点进行GO和KEGG富集分析。GO功能富集分析显示西洋参抗心脏肥大的作用机制涉及CC的细胞膜质、细胞表面和蛋白质复合物,BP主要与一氧化氮合成过程的正调控、脂多糖介导的信号通路以及肽基-丝氨酸磷酸化的正调控相关,MF主要与酶结合、一氧化氮合酶调节活性以及支架蛋白结合相关。KEGG通路富集分析表明,西洋参抗心脏肥大主要与癌症蛋白多糖、血管内皮生长因子信号通路、缺氧诱导因子-1信号通路等有关。
在网络药理学分析的基础上,本研究选择大鼠H9c2心肌细胞为研究对象,观察了西洋参抗心肌细胞肥大作用,并对关键靶点VEGFA、AKT1、EGFR、TNF和MAPK1的基因表达进行了验证。异丙肾上腺素属于儿茶酚胺类物质,可兴奋心肌细胞的β受体,诱导心肌细胞肥大、心脏胚胎基因重新激活表达[15]。本研究结果显示,西洋参100.0 μg/mL可抑制异丙肾上腺素诱导的心肌细胞面积增加及心脏胚胎基因ANP、β-MHC与α-SKA mRNA的表达上调。进一步的qRT-PCR实验表明,西洋参100 .0μg/mL抑制异丙肾上腺素诱导的VEGFA、AKT1、EGFR、TNF、MAPK1 mRNA表达上调,这与网络药理学分析结果相一致。
本研究通过网络药理学对西洋参抗心脏肥大的作用靶点及通路进行了分析,而后通过体外实验验证了西洋参抗心脏肥大作用,并对其抗心脏肥大的关键靶点进行了验证和探讨,为深入研究西洋参防治心血管疾病的药理机制和临床应用提供参考。



