刘 盼,王晓英,韩 丹
冠心病具有高发病率和高死亡率等特点,心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MI/RI)是冠心病的主要病理表现,主动脉血管壁斑块破裂可促进血栓形成并阻塞血管腔,造成心肌缺血性损伤,在一定时间内恢复血液供应,导致心肌二次受损,这一过程被称为MI/RI[1-2]。MI/RI发病机制复杂,其中氧化应激、细胞凋亡、炎症等因素均参与MI/RI发生发展[3]。近年来研究发现,铁死亡是导致MI/RI发展的重要因素[4]。铁死亡是一种新的细胞死亡方式,具有铁离子依赖性,铁离子在细胞内代谢失衡可增加细胞内铁离子的蓄积,进而催化细胞膜不饱和脂肪酸发生脂质过氧化反应,诱导细胞铁死亡[5]。研究发现,蛋白激酶B(protein kinase B,AKT)/核因子红细胞系2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/谷胱甘肽过氧化酶4(glutathione peroxidase 4,GPX4)信号通路的激活可抑制铁死亡[6-7]。地黄苷A(Rehmannioside A,ReA)是玄参科植物地黄中的重要活性成分,具有抗氧化、抗炎、抗凋亡等疗效[8]。研究发现,ReA可通过激活AKT/Nrf2/GPX4信号通路,抑制神经元铁死亡,从而发挥神经保护作用[9]。而ReA能否通过调控AKT/Nrf2/GPX4信号通路介导的铁死亡改善MI/RI尚鲜见报道。为此,本研究以铁死亡为切入点,旨在探究ReA对MI/RI大鼠的影响及其作用机制。
1 材料与方法
1.1 实验动物
90只体质量为220~250 g的无特定病原体(SPF)级SD大鼠,购自湖北贝恩特生物科技有限公司,生产许可证号为SCXK(鄂)2021-0027。所有大鼠均饲喂于温度24 ℃和湿度50%的动物房中,并提供12 h光/暗循环。
1.2 主要试剂
ReA(货号:YT61748)购自北京伊塔生物科技有限公司;Ferrostatin-1(Fer-1)(货号:F27030)购自上海吉至生化科技有限公司;perifosine(货号:S43190)购自上海源叶生物科技有限公司;乳酸脱氢酶(LDH)(货号:E-EL-R0576)、肌酸激酶同工酶MB(CK-MB)(货号:E-EL-R1327)和心肌肌钙蛋白I(cTnI)(货号:E-EL-R1253)检测试剂盒均购自上海恒斐生物科技有限公司;氯代三苯基四氮唑(TTC)(货号:S0022)购自上海远慕生物科技有限公司;苏木素-伊红(HE)染色试剂盒(货号:C0105)和原位末端标记测定法(TUNEL)染色试剂盒(货号:C1086)均购自上海碧云天生物技术有限公司;谷胱甘肽过氧化物酶(GSH-Px)(货号:BC1190)、超氧化物歧化酶(SOD)(货号:BC0170)和丙二醛(MDA)(货号:BC0020)检测试剂盒均购自北京索莱宝科技有限公司;Fe2+含量检测试剂盒(货号:E1050)购自北京普利莱基因技术有限公司;兔源p-AKT(货号:ab192623)、AKT(货号:ab179463)、Nrf2(货号:b92946)、GPX4(货号:ab125066)、转铁蛋白受体1(TfR1)(货号:ab269513)、GAPDH(货号:ab199554)和辣根过氧化物酶(HRP)标记的山羊抗兔二抗(货号:ab205718)均购自Abcam公司。
1.3 动物分组及MI/RI大鼠模型建立
90只大鼠适应性喂养1周后,随机分为假手术组(Sham组)、模型组(Model组)、ReA低剂量组(ReA-L组)、ReA高剂量组(ReA-H组)、铁死亡抑制剂Fer-1组(Fer-1组)及ReA高剂量+AKT抑制剂perifosine组(ReA-H+perifosine组),每组15只。ReA-L组、ReA高剂量组大鼠分别腹腔注射40、80 mg/kg ReA[10],Fer-1组大鼠腹腔注射2 mg/kg ferrostatin-1[11],ReA-H+perifosine组大鼠腹腔注射80 mg/kg ReA及20 mg/kg perifosine[12],Sham组和Model组大鼠腹腔注射等量生理盐水,每日1次,连续给药2周。除Sham组外,各组大鼠在末次给药1 h后建立MI/RI大鼠模型,参照文献[13]方法,应用左冠状动脉前降支结扎法:将大鼠用1%戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,以仰卧位姿势固定在手术台上;胸部皮肤经备皮消毒后,在大鼠左侧第3肋与第4肋骨间行开胸手术,暴露心脏;在冠状动脉左前降支进行30 min结扎,此时可观察到心肌由红色变为白色;30 min后打开结扎线再灌注2 h,心肌由白色变为红色,提示建模成功。Sham组大鼠除不进行冠状动脉结扎外,其余操作同建模大鼠一致。
1.4 血清心肌酶水平检测
造模结束后,采集各组大鼠腹主动脉血液5 mL离心获得血清;按LDH、CK-MB和cTnI酶联免疫试剂盒要求检测大鼠血清LDH、CK-MB和cTnI的水平。
1.5 心肌梗死面积检测
每组取5只大鼠经颈椎脱臼处死,采集左心室组织;使用切片刀将左心室切割为5片,每片2 mm厚;将切割完成的心肌组织置于1% TTC溶液中进行染色;随后转移到10%甲醛溶液中固定;正常心肌组织呈红色,梗死区心肌组织呈白色。采用Image J计算梗死面积,梗死面积为每片切片梗死心肌面积总和占左心室面积的百分比。
1.6 心肌组织病理形态学观察
每组再取5只大鼠经颈椎脱臼处死后,采集左心室缺血区心肌组织固定于4%多聚甲醛中;固定24 h后,心肌组织依次经脱水、透明、包埋后,采用连续切片机进行5 μm连续切片;依次将切片置入苏木素染色液和伊红染色液中进行染色;光学显微镜下观察心肌组织染色结果。
1.7 心肌细胞凋亡率检测
取心肌组织切片经脱蜡至水后,再切片添加蛋白酶K工作液孵育;滴加破膜工作液破膜;将TUNEL试剂盒内的TDT酶、dUTP和buffer按1∶5∶50比例混合配制反应液;滴加反应液到切片孵育;DAPI染液复染细胞核;荧光显微镜下观察染色结果。
1.8 心肌组织抗氧化能力评估
每组另取5只大鼠经颈椎脱臼处死后,采集左心室缺血区心肌组织置于匀浆管中进行匀浆;按SOD、GSH-Px和MDA酶联免疫试剂盒要求评估心肌组织抗氧化能力。
1.9 心肌组织Fe2+含量检测
取心肌组织匀浆,加入Fe2+检测试剂,具体操作依照Fe2+含量检测试剂盒说明书进行,然后在550 nm波长处测定吸光度值,并按照标准曲线计算Fe2+含量。
1.10 心肌组织蛋白表达检测
取心肌组织匀浆,在匀浆液中加入RAPI裂解液离心后获得总蛋白;使用二喹啉甲酸法(BCA)蛋白检测试剂盒检测其浓度;然后行SDS-PAGE、转膜及封膜处理;将p-AKT(1∶1 000)、AKT(1∶1 000)、Nrf2(1∶500)、GPX4(1∶1 000)、TfR1(1∶1 000)和GAPDH(1∶1 000)一抗加入膜中并在室温下孵育过夜;将HRP标记的二抗加入膜孵育;采用Image LabTM软件分析蛋白的灰度值。
1.11 统计学处理

2 结 果
2.1 各组大鼠血清心肌酶水平比较
与Sham组比较,Model组大鼠血清LDH、CK-MB和cTnI水平升高(P<0.05);与Model组比较,ReA-L组、ReA-H组、Fer-1组大鼠血清LDH、CK-MB和cTnI水平降低,且随ReA剂量增加,大鼠血清LDH、CK-MB和cTnI水平进一步降低(P<0.05);与ReA-H组比较,ReA-H+perifosine组大鼠血清LDH、CK-MB和cTnI水平升高(P<0.05)。详见表1。

表1 各组大鼠血清LDH、CK-MB和cTnI水平比较
2.2 各组大鼠心肌梗死面积比较
Model组大鼠的心肌梗死面积高于Sham组(P<0.05);与Model组相比,ReA-L组、ReA-H组、Fer-1组大鼠心肌梗死面积降低,且随着ReA剂量增加,大鼠心肌梗死面积进一步减少(P<0.05);与ReA-H组比较,ReA-H+perifosine组大鼠心肌梗死面积升高(P<0.05)。详见表2、图1。
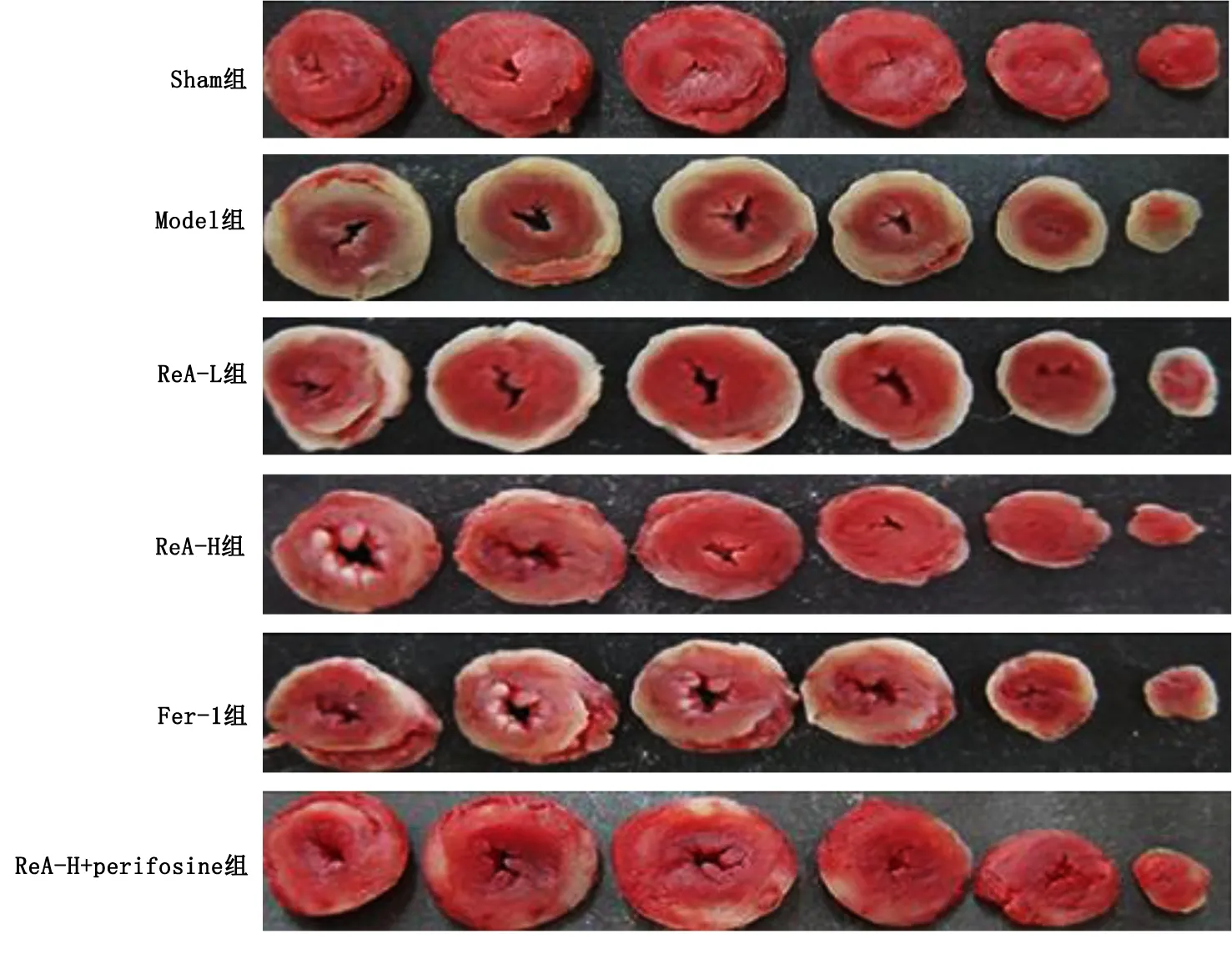
图1 TTC观察大鼠心肌梗死面积

表2 各组大鼠心肌梗死面积比较
2.3 各组大鼠心肌组织病理学损伤比较
Model组与Sham组比较,大鼠心肌组织明显受损,心肌细胞肿胀且杂乱排列,心肌纤维紊乱,有大量炎性细胞浸润;ReA-L组、ReA-H组、Fer-1组大鼠心肌组织损伤明显减轻,且随ReA剂量增加,效果越明显;与ReA-H组相比,ReA-H+perifosine组大鼠心肌组织损伤明显加重。详见图2。
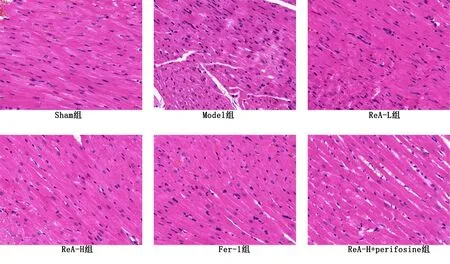
图2 大鼠心肌组织病理形态学变化(HE染色,×400)
2.4 各组大鼠心肌细胞凋亡情况比较
Model组与Sham组比较,心肌细胞凋亡率升高(P<0.05);与Model组比较,ReA-L组、ReA-H组、Fer-1组心肌细胞凋亡率降低(P<0.05);ReA-H+perifosine组与ReA-H组相比,心肌细胞凋亡率升高(P<0.05)。详见图3、表3。
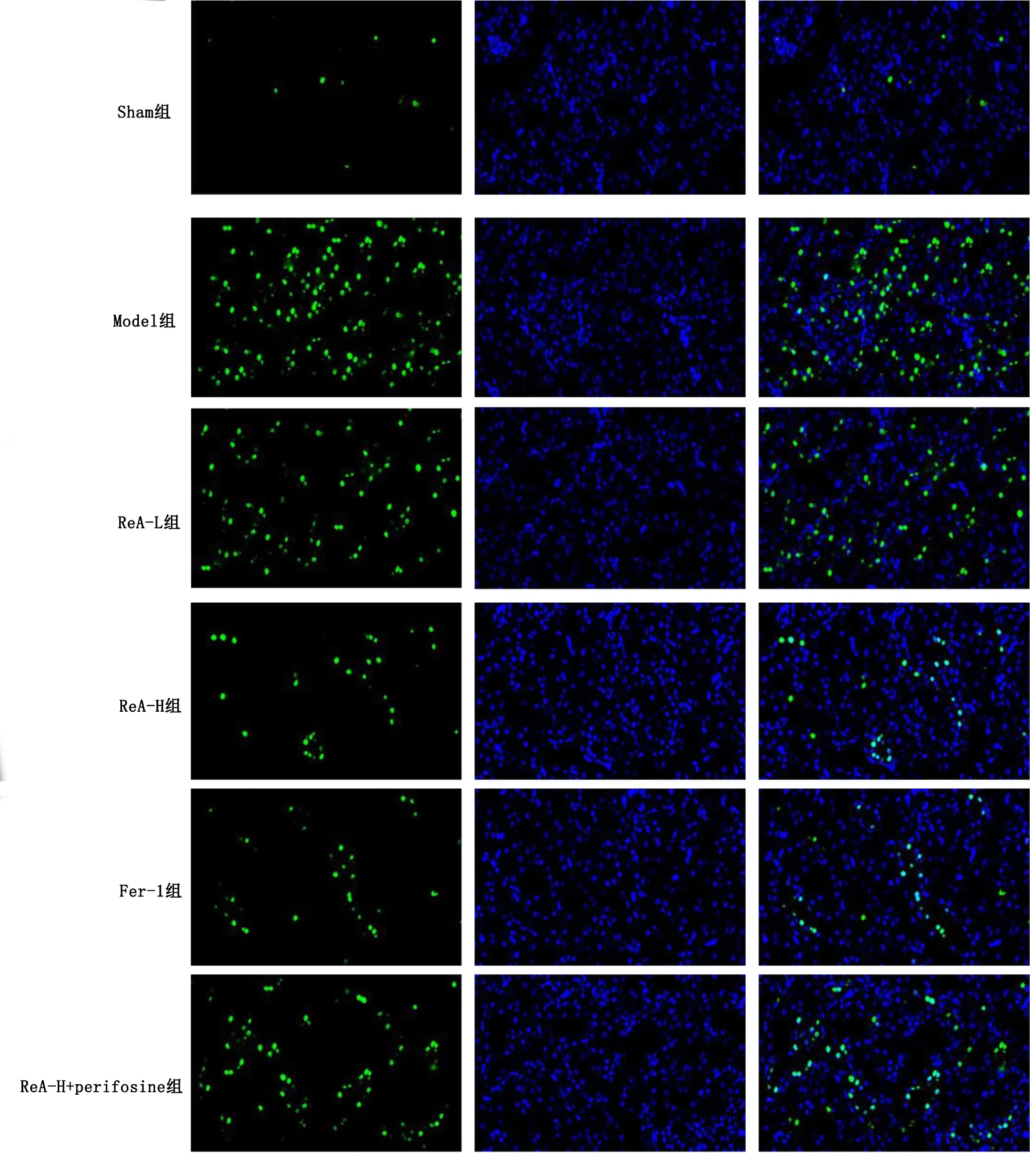
图3 TUNEL染色检测大鼠心肌细胞凋亡率变化(×200)

表3 各组大鼠心肌细胞凋亡率比较
2.5 各组大鼠心肌组织抗氧化指标水平比较
Model组与Sham组相比,心肌组织GSH-Px和SOD水平降低,MDA水平升高(P<0.05);ReA-L组、ReA-H组、Fer-1组与Model组比较,心肌组织GSH-Px和SOD水平升高,MDA水平下降,ReA各剂量组间GSH-Px、SOD、MDA水平差异有统计学意义(P<0.05);与ReA-H组比较,ReA-H+perifosine组GSH-Px和SOD水平下降,MDA水平增高(P<0.05)。详见表4。

表4 各组大鼠心肌组织GSH-Px、SOD和MDA水平比较
2.6 各组大鼠心肌组织Fe2+含量比较
Model组与Sham组比较,Fe2+含量增加(P<0.05);ReA-L组、ReA-H组、Fer-1组与Model组比较,Fe2+含量降低,且ReA各剂量组间Fe2+含量差异有统计学意义(P<0.05);与ReA-H组比较,ReA-H+perifosine组大鼠心肌组织Fe2+含量升高(P<0.05)。详见表5。

表5 各组大鼠心肌组织Fe2+含量比较
2.7 各组大鼠心肌组织蛋白p-AKT/AKT、Nrf2、GPX4和TfR1表达比较
Model组与Sham组比较,p-AKT/AKT、Nrf2和GPX4蛋白水平下调,TfR1蛋白水平升高(P<0.05);与Model组比较,ReA-L组、ReA-H组、Fer-1组心肌组织p-AKT/AKT、Nrf2和GPX4蛋白水平升高,TfR1蛋白水平下调,随ReA剂量增加,大鼠心肌组织p-AKT/AKT、Nrf2和GPX4蛋白水平进一步升高,TfR1蛋白水平进一步降低(P<0.05);与ReA-H组比较,ReA-H+perifosine组大鼠心肌组织p-AKT/AKT、Nrf2和GPX4蛋白表达降低,TfR1蛋白表达增高(P<0.05)。详见图4、表6。

图4 Western Blot检测各组大鼠心肌组织p-AKT/AKT、Nrf2、GPX4和TfR1蛋白表达条带图

表6 各组大鼠心肌组织p-AKT/AKT、Nrf2、GPX4和TfR1蛋白表达比较
3 讨 论
MI/RI是心肌缺血恢复血液供应后心肌损伤反而加重的一种现象,是冠心病的主要病理表现[14]。伴随着MI/RI发展可造成急性心肌梗死的发生,而急性心肌梗死是导致冠心病病人死亡的主要原因[15]。控制MI/RI发生发展是改善冠心病病人预后的关键。MI/RI发病机制复杂尚未完全阐明,因此,阐明MI/RI发病机制对控制MI/RI发展具有重要意义。本研究采用左冠状动脉前降支结扎法建立MI/RI大鼠模型,结果显示,与Sham组比较,Model组大鼠心肌梗死面积及心肌细胞凋亡率增加,心肌组织形态结构严重受损;此外,血清中心肌酶LDH、CK-MB和cTnI水平上升,这可能是大量心肌细胞损伤,导致胞内心肌酶释放到血液中的结果,以上结果进一步提示了MI/RI大鼠模型成功建立。研究发现,MI/RI发生后,心肌细胞中往往存在大量铁离子蓄积,进而促进细胞脂质过氧化发生,诱导细胞铁死亡,加重组织损伤[16]。在本研究中,与Sham组相比,Model组大鼠心肌组织中Fe2+含量增加,且心肌组织中GSH-Px和SOD水平降低,MDA水平升高,提示了铁死亡与MI/RI发生密切相关。
当前,尚无十分有效的治疗方法来保护心脏免受MI/RI,因此,寻求及开发新策略来预防MI/RI具有重要的临床意义。ReA来源于玄参科植物地黄的干燥块根,已被证实具有抗氧化、抗炎、抗凋亡等生物学功能[17]。研究报道,ReA可提高认知障碍模型大鼠脑组织中GSH-Px和内皮型一氧化氮合成酶(eNOS)水平,降低MDA产生,进而抑制脂质过氧化、细胞凋亡和细胞铁死亡的发生[9]。在本研究中,低、高剂量ReA及Fer-1处理后大鼠心肌组织中Fe2+含量及MDA水平降低,GSH-Px和SOD水平上升,且血清中心肌酶LDH、CK-MB和cTnI水平下降,心肌梗死面积及心肌细胞凋亡率降低,心肌组织损伤减轻,提示ReA可能通过抑制心肌细胞铁死亡,改善心肌组织损伤。
细胞铁死亡机制与细胞内铁离子代谢失衡及氧化损伤密切相关[18]。TfR1是调控细胞内铁离子代谢的重要蛋白,负责循环中Fe3+跨膜转运到细胞内被还原为Fe2+所利用,研究发现,敲低TfR1可通过抑制细胞铁死亡改善MI/RI[19]。细胞发生铁死亡时Fe2+可在细胞内蓄积,因Fe2+具有强氧化性,可与细胞内H2O2反应引起大量羟自由基生成,促进脂质过氧化发生,进而损伤细胞膜[20]。GPX4是调节细胞铁死亡的关键蛋白,GPX4表达降低可打破细胞内氧化平衡,诱导脂质过氧化发生,进而促进细胞铁死亡[21]。Nrf2受AKT的调控,是维持细胞氧化还原稳态的关键转录因子,AKT-Nrf2通路的激活可促使下游GPX4表达升高,抑制细胞铁死亡的发生[7]。本研究结果显示,Model组大鼠心肌组织p-AKT/AKT、Nrf2和GPX4蛋白水平下调,TfR1蛋白水平升高,而经低、高剂量ReA及Fer-1处理后心肌组织p-AKT/AKT、Nrf2和GPX4蛋白水平上升,TfR1蛋白水平下降,提示ReA可能通过激活AKT/Nrf2/GPX4信号通路抑制心肌细胞铁死亡,改善心肌组织损伤。为验证ReA是否通过激活AKT/Nrf2/GPX4信号通路,抑制心肌细胞铁死亡,本研究采用AKT抑制剂perifosine处理干预高剂量ReA大鼠,结果显示,与ReA-H组比较,ReA-H+perifosine组大鼠心肌组织p-AKT/AKT、Nrf2和GPX4蛋白水平降低,心肌细胞内Fe2+含量增高,心肌组织损伤严重,以上结果提示perifosine减弱了高剂量ReA对MI/RI大鼠铁死亡的抑制作用,证实了ReA能够通过抑制心肌细胞铁死亡进而改善心肌组织损伤,这可能与AKT/Nrf2/GPX4信号通路的激活有关。
综上所述,ReA能够抑制心肌细胞铁死亡,进而改善MI/RI,这可能是通过激活AKT/Nrf2/GPX4信号通路实现的。本研究为开发预防和治疗MI/RI新药提供了理论依据。然而,ReA对MI/RI发生后心肌组织的保护作用可能还涉及其他通路,仍需进一步探究。



