罗聪 钟崛 邓敏敏 肖潇 黄丹霞 范慧 王盼
摘要 目的:探讨田蓟苷(TIL)对脑出血(ICH)大鼠认知功能、神经元损伤及腺苷酸激活蛋白激酶(AMPK)/沉默调节蛋白1(SIRT1)/过氧化物酶体增殖活化受体γ辅助活化因子1α(PGC1α)信号通路的影响。方法:采用Ⅳ型胶原酶注射法构建ICH大鼠模型,将造模成功的ICH大鼠随机分为模型组(ICH组)、TIL组(16 mg/kg)、AMPK抑制剂组(Compound C组,250 μg/kg)、TIL+AMPK抑制剂组(TIL+Compound C组),另设假手术组(Sham组),每组12只。采用改良的Garcia JH法、Morris水迷宫实验和敞箱实验评价大鼠的神经功能和认知功能;苏木素-伊红(HE)和脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TUNEL)法行脑组织病理学和神经元凋亡观察;蛋白质印迹法(Western Blot)检测AMPK/SIRT1/PGC1α通路蛋白表达。结果:与Sham组相比,ICH组大鼠脑组织出现细胞核皱缩、排列紊乱等损伤,神经功能评分、穿越平台次数、垂直活动得分和水平活动得分、磷酸化AMPK(p-AMPK)/AMPK、SIRT1、PGC1α蛋白水平均明显下降(P<0.05),找寻平台时间、神经元凋亡率、半胱氨酸蛋白酶-3(Caspase-3)、B淋巴细胞瘤-2(Bcl-2)蛋白表达水平均明显增加(P<0.05);与ICH组相比,TIL组大鼠脑组织损伤减轻,神经功能评分、穿越平台次数、垂直活动得分和水平活动得分、p-AMPK/AMPK、SIRT1、PGC1α蛋白水平均明显增加(P<0.05),找寻平台时间、神经元凋亡率、Caspase-3、Bcl-2蛋白表达水平均明显降低(P<0.05);而Compound C组大鼠以上指标呈现相反的趋势。且TIL对ICH大鼠脑组织及认知功能的保护作用均被AMPK抑制剂Compound C减弱(P<0.05)。结论:TIL可能通过激活AMPK/SIRT1/PGC1α通路,改善ICH大鼠认知功能,减轻神经元损伤。
关键词 脑出血;田蓟苷;腺苷酸激活蛋白激酶/沉默调节蛋白1/过氧化物酶体增殖活化受体γ辅助活化因子1α通路;认知功能;神经元;实验研究
doi:10.12102/j.issn.1672-1349.2024.02.012
Influences of Tilianin on Cognitive Function and Neuronal Damage in Rats with Cerebral Hemorrhage
LUO Cong, ZHONG Jue, DENG Minmin, XIAO Xiao, HUANG Danxia, FAN Hui, WANG Pan
Wuhan Sixth Hospital, Wuhan 430015, Hubei, China
Corresponding Author ZHONG Jue, E-mail: zhongjue1985@163.com
Abstract Objective:To investigate the influences of tilianin(TIL) on cognitive function and neuronal damage in rats with intracerebral hemorrhage(ICH).Methods:The ICH rat model was established by Ⅳ collagenase injection.The successful modeling ICH rats were randomly dvided into model group(ICH group),TIL group(16 mg/kg),AMP-activated protein kinase(AMPK) inhibitor group (Compound C group,250 μg/kg),TIL+AMPK inhibitor group (TIL+Compound C group),and sham operation group(Sham group),with 12 rats in each group.The neurological and cognitive functions of rats were evaluated by modified Garcia JH method,Morris water maze test,and open-box test.The brain histopathology and neuronal apoptosis were observed by hematoxylin-eosin(HE) and Terminal-deoxynucleoitidyl Transferase Mediated Nick End Labeling(TUNEL) staining.The expression of AMPK/Sirtuin type 1(SIRT1)/peroxisome proliferator-activated receptor gamma coactivator 1α (PGC1α) pathway proteins was measured by Western Blot.Results:Compared with Sham group,nucleus shrinkage disordered arrangement and other damages was observed in the rat brain tissue,the neurological score,platform crossing times,vertical activity score,horizontal activity score,and phosphorylated AMPK(p-AMPK)/AMPK,SIRT1,PGC1α protein levels decreased obviously(P<0.05),the searching platform time,neuron apoptosis rate,and Caspase-3,Bcl-2 protein levels of ICH group increased obviously(P<0.05).Compared with ICH group,the brain tissue damage of TIL group reduced,the neurological deficit score,platform crossing times,vertical activity score,horizontal activity score,and p-AMPK/AMPK,SIRT1,PGC1α protein levels increased obviously(P<0.05),the searching platform time,neuron apoptosis rate,and Caspase-3,Bcl-2 protein levels decreased obviously(P<0.05).The above indicators in Compound C group showed the opposite trends.The protective effects of TIL for brain tissue and cognitive function of ICH rats were attenuated by AMPK inhibitor Compound C(P<0.05).
Conclusion:TIL may improve cognitive function and reduce neuronal damage in ICH rats by activating AMPK/SIRT1/PGC1α pathway.
Keywords intracerebral hemorrhage; tilianin; AMP-activated protein kinase/Sirtuin type 1/peroxisome proliferator-activated receptor gamma coactivator 1α pathway; cognitive function; neuron; experimental study
基金项目 武汉市医学科研项目(No.WX21Q15)
作者单位 1.武汉市第六医院(武汉 430015);2.武汉市第三医院(武汉 430061)
通讯作者 钟崛,E-mail:zhongjue1985@163.com
引用信息 罗聪,钟崛,邓敏敏,等.田蓟苷调节AMPK/SIRT1/PGC1α信号通路对脑出血大鼠认知功能和神经元损伤的影响[J].中西医结合心脑血管病杂志,2024,22(2):274-279.
脑出血(intracerebral hemorrhage,ICH)是以脑部自发性和非创伤性出血为特征的脑卒中类型,具有较高的发病率和死亡率[1]。目前,神经外科医生已采用各种医疗和手术方式来预防和治疗该疾病,然而成功率并不理想[2]。田蓟苷(Tilianin,TIL)是香青兰总黄酮中的主要活性成分,具有抗炎、抗氧化和抑制神经元凋亡等作用,已应用于对动脉粥样硬化的防治[3]。研究发现,TIL可能对脑缺血再灌注损伤具有保护作用[4]。而TIL是否对ICH大鼠也有一定治疗作用的研究较少。腺苷酸激活蛋白激酶(AMPK)是代谢功能的中心调节剂,包括脂质代谢和线粒体功能,AMPK通过其在苏氨酸172处的磷酸化而被激活,发挥神经保护作用[5]。报道称,激活AMPK/沉默调节蛋白1(SIRT1)通路可以在ICH病理过程中发挥神经保护作用[6]。因此,本研究构建ICH大鼠模型,观察TIL对ICH大鼠认知功能和神经元损伤的影响,并初步探究AMPK/SIRT1/过氧化物酶体增殖活化受体γ辅助活化因子1α(PGC1α)通路在其中的作用。
1 材料与方法
1.1 实验动物
无特定病原体(SPF)级雄性SD大鼠,体质量260~275 g,7周龄,购自广东南模生物科技有限公司,动物许可证号SCXK(粤)2022-0062。本实验得到医院动物伦理委员会批准。
1.2 主要试剂及仪器
TIL(货号:SND-1786),由滁州仕诺达生物科技有限公司生产;AMPK抑制剂Compound C(货号:HY-145432),购自MCE公司;脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TUNEL)神经元凋亡检测试剂盒(货号:FS-79507),购自上海抚生实业有限公司;AMPK(货号:ab32112)、磷酸化AMPK(p-AMPK)(货号:ab133448),购自美国abcam公司;SIRT1(货号:9475)、PGC1α(货号:ab544481)、半胱氨酸蛋白酶-3(Caspase-3)(货号:9661)、促凋亡基因(Bax)(货号:2774),购自英国Biorbyt公司。
荧光显微镜(货号:FMA-04),购自香港友诚生物科技有限公司;石蜡切片机(货号:S700/S700A),购自深圳市瑞沃德生命科技有限公司。
1.3 ICH模型的构建及分组
ICH模型构建参照文献[7-8],通过将Ⅳ型胶原酶注射到大脑纹状体区来建立。假手术组(Sham组)手术过程同ICH模型,用生理盐水代替Ⅳ型胶原酶。共造模成功48只ICH大鼠。随机将造模成功的48只大鼠分为4个处理组,分别为模型组(ICH组)、TIL组、AMPK抑制剂组(Compound C组)、TIL+AMPK抑制剂组(TIL+Compound C组),每组12只。另设Sham组12只。TIL组灌胃16 mg/kg TIL,Compound C组尾静脉注射250 μg/kg Compound C[9],ICH+TIL组在灌胃TIL前15 min尾静脉注射250 μg/kg Compound C,Sham组和ICH组给予等量的生理盐水,每日1次,连续7 d。
1.4 神经功能评分
末次灌胃TIL后,采用改良的Garcia JH法评价大鼠的神经功能。神经行为研究包括以下6项测试内容:自发活动、四肢运动的对称性、前爪伸展、攀爬、身体本体感觉和对触须触摸的反应。神经系统评分最低为3分,最高为18分,评分越低表明神经功能缺损越严重。
1.5 Morris水迷宫实验
在1.4项完成后,进行Morris水迷宫实验。在水池里放1个平台,标上记号,记录大鼠从进入水池到找到平台所花费的时间,连续记录4 d。完成后,撤去平台,记录大鼠120 s内经过原平台的次数。
1.6 敞箱实验
在1.5项完成后,将大鼠放入敞开的箱子内,以大鼠双脚离开底面直立次数为垂直活动得分,以大鼠3只脚跨入邻格的次数记为水平活动得分,测定10 min内两种得分情况。
1.7 标本采集
在1.6项完成后,麻醉处死,每组取6只大鼠的出血部位脑组织固定于4%多聚甲醛中,剩余大鼠的出血部位脑组织储存于-80 ℃。
1.8 脑组织病理学变化
脑组织经4%多聚甲醛溶液固定后,脱水、包埋、切成5 μm左右的石蜡切片,用苏木素-伊红(HE)染色后在光学显微镜下观察。
1.9 TUNEL法检测神经元凋亡情况
按照TUNEL神经元凋亡检测试剂盒产品说明书进行。在荧光显微镜下观察脑神经元凋亡情况,凋亡神经元呈绿色荧光。
1.10 蛋白质印迹法(Western Blot)检测AMPK/SIRT1/PGC1α蛋白表达
用RIPA裂解缓冲液提取脑组织总蛋白,将蛋白质进行变性、定量、电泳、转膜,将膜室温封闭2 h后分别加入一抗AMPK(1∶1 000)、p-AMPK(1∶2 000)、SIRT1(1∶2 000)、p-SIRT1(1∶2 000)、PGC1α(1∶1 000)、Caspase-3(1∶1 000)、Bcl-2(1∶1 000)和甘油醛-3-磷酸脱氢酶(GAPDH)抗体(1∶1 000),4 ℃孵育过夜,加入二抗,室温孵育2 h,加入电化学发光(ECL)试剂检测蛋白质印迹。使用Image LabTM软件分析目标蛋白的灰度值。
1.11 统计学处理
采用SPSS 25.0软件进行数据分析。符合正态分布的定量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,采用SNK-q检验进行两两比较。以P<0.05为差异有统计学意义。
2 结 果
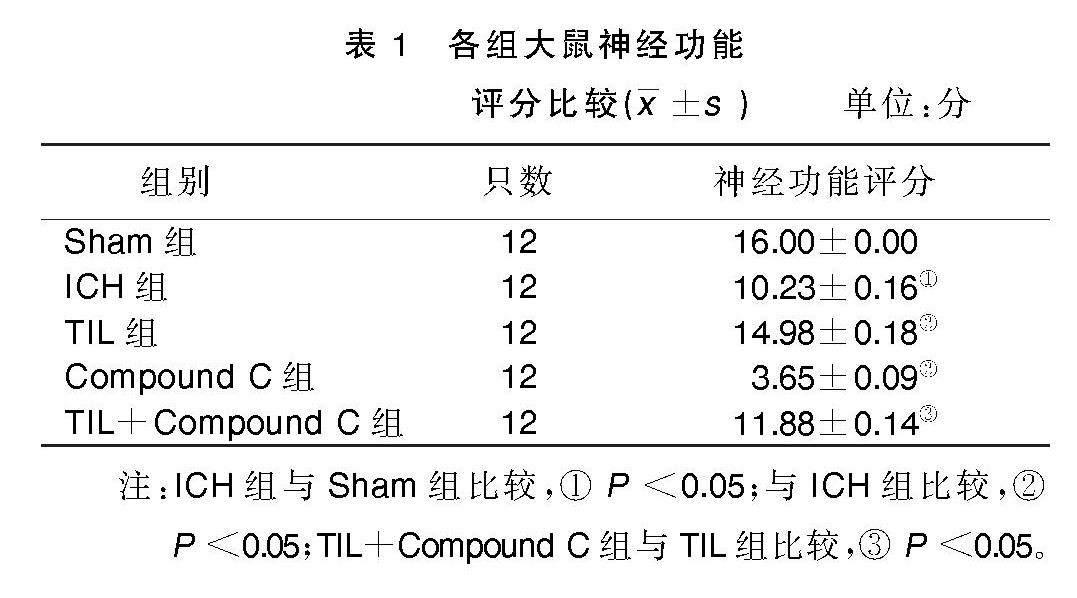
2.1 各组大鼠神经功能评分比较
与Sham组相比,ICH组大鼠神经功能评分明显降低(P<0.05);与ICH组相比,TIL组大鼠神经功能评分明显升高(P<0.05),Compound C组大鼠神经功能评分明显降低(P<0.05);与TIL组相比,TIL+Compound C组大鼠神经功能评分明显降低(P<0.05)。详见表1。
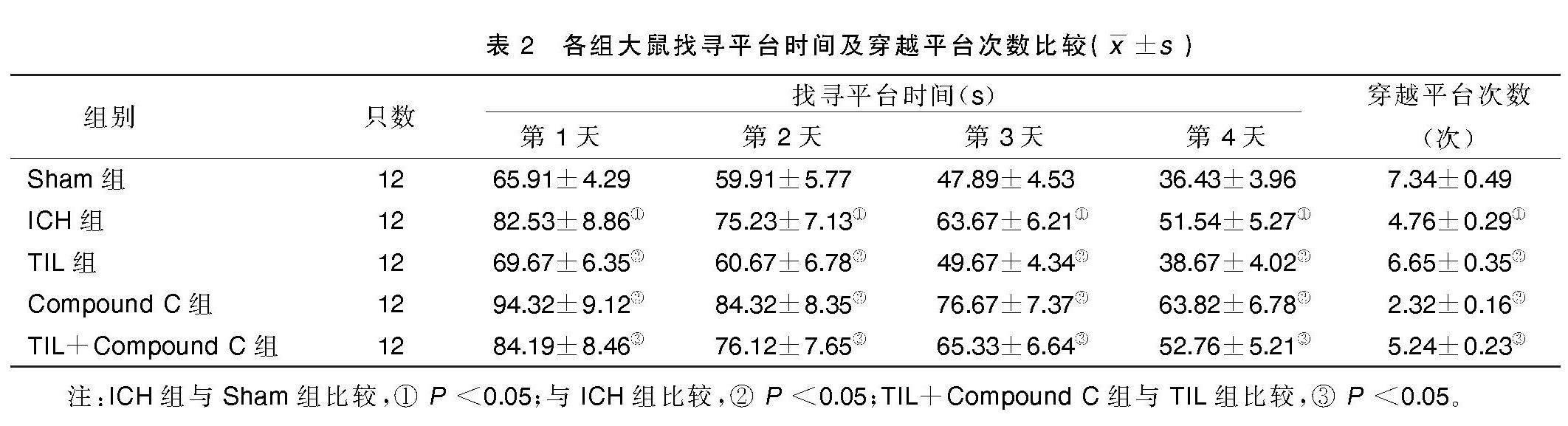
2.2 Morris水迷宫实验结果
与Sham组相比,ICH组大鼠找寻平台时间明显延长(P<0.05),穿越平台次数明显减少(P<0.05);与ICH组相比,TIL组大鼠找寻平台时间明显缩短(P<0.05),穿越平台次数明显增加(P<0.05),Compound C组大鼠找寻平台时间明显延长(P<0.05),穿越平台次数明显减少(P<0.05);与TIL组相比,TIL+Compound C组大鼠找寻平台时间明显延长(P<0.05),穿越平台次数明显减少(P<0.05)。详见表2。
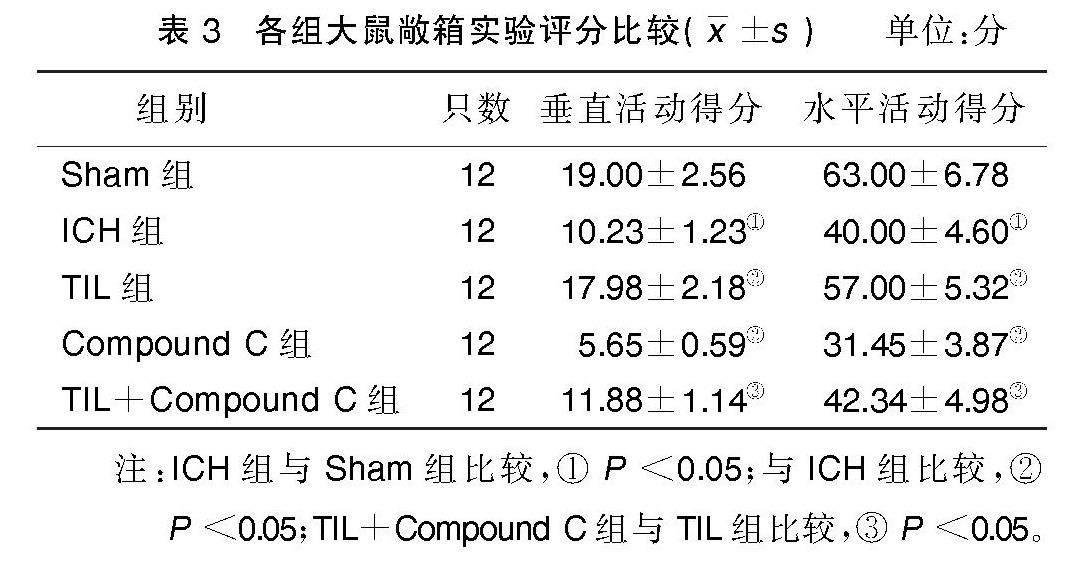
2.3 敞箱实验结果
与Sham组相比,ICH组大鼠垂直活动得分和水平活动得分均明显降低(P<0.05);与ICH组相比,TIL组大鼠垂直活动得分和水平活动得分均明显升高(P<0.05),Compound C组大鼠垂直活动得分和水平活动得分均明显降低(P<0.05);与TIL组相比,TIL+Compound C组大鼠垂直活动得分和水平活动得分均明显降低(P<0.05)。详见表3。
2.4 HE染色结果
Sham组大鼠脑组织结构清晰,细胞排列整齐,无异常现象;与Sham组相比,ICH组大鼠脑组织出现细胞核皱缩、细胞数量减少、排列紊乱等损伤;TIL组细胞排列较ICH整齐,脑组织结构趋于Sham组;Compound C组细胞排列最乱,脑组织损伤最重;TIL+Compound C组细胞减少且排列紊乱,脑组织结构与ICH组相似。详见图1。
2.5 各组大鼠脑组织神经元凋亡情况比较
与Sham组相比,ICH组脑组织神经元凋亡率明显升高(P<0.05);与ICH组相比,TIL组脑组织神经元凋亡率明显下降(P<0.05),Compound C组脑组织神经元凋亡率明显升高(P<0.05);与TIL组相比,TIL+Compound C组脑组织神经元凋亡率明显升高(P<0.05)。详见图2、表4。
2.6 各组大鼠脑组织AMPK/SIRT1/PGC1α通路蛋白表达水平比较
与Sham组相比,ICH组大鼠脑组织p-AMPK/AMPK、SIRT1、PGC1α蛋白表达水平明显下降(P<0.05),Caspase-3、Bcl-2蛋白表达水平明显升高(P<0.05);与ICH组相比,TIL组大鼠脑组织p-AMPK/AMPK、SIRT1、PGC1α蛋白表达水平明显升高(P<0.05),Caspase-3、Bcl-2蛋白表达水平明显降低(P<0.05),Compound C组大鼠脑组织p-AMPK/AMPK、SIRT1、PGC1α蛋白表达水平明显下降(P<0.05),Caspase-3、Bcl-2蛋白表达水平明显升高(P<0.05);与TIL组相比,TIL+Compound C组大鼠脑组织p-AMPK/AMPK、SIRT1、PGC1α蛋白表达水平明显下降(P<0.05),Caspase-3、Bcl-2蛋白表达水平明显升高(P<0.05)。详见图3、表5。
3 讨 论
ICH是预后最差的脑卒中类型[10]。58%的ICH病人在1年内死亡,66.7%的幸存者处于中度甚至重度残疾状态[11-12]。因此,探究ICH的发病机制,可能为寻找ICH新药物提供方向。本研究通过注射Ⅳ型胶原酶构建ICH模型,发现ICH组大鼠脑组织出现细胞核皱缩、细胞排列紊乱等损伤,神经功能评分、穿越平台次数、垂直活动得分和水平活动得分明显降低,找寻平台时间明显延长,提示ICH模型构建成功。TIL是香青兰总黄酮中含量最高的成分,可通过减轻脂质沉积和炎症反应,对动脉粥样硬化起到一定改善作用[13]。既往研究发现,TIL可以促进脑血管新生,对脑组织起到一定保护作用[4]。本研究结果显示,TIL可明显减轻ICH大鼠脑组织损伤,提高神经功能评分、穿越平台次数、垂直活动得分和水平活动得分,缩短大鼠找寻平台的时间,提示TIL可能减轻ICH大鼠脑损伤,并对其认知功能起到积极改善作用。
神经元凋亡在ICH后继发性脑损伤的病理生理过程中起关键作用[14]。Caspase-3、Bcl-2等凋亡蛋白是细胞凋亡的关键效应物,可反映细胞凋亡程度。Huang等[15]研究发现,促进神经元凋亡会加重ICH损伤。Li等[16]研究发现,抑制神经元凋亡可以对ICH起到一定保护作用。本研究结果显示,ICH大鼠脑组织神经元凋亡率以及Caspase-3、Bcl-2蛋白表达水平明显升高,而TIL可以明显降低神经元凋亡率以及Caspase-3、Bcl-2蛋白表达水平,表明TIL可能对ICH大鼠神经元损伤起到一定修复作用。
AMPK作为细胞能量传感器,是调节生物能量代谢的关键分子,活化后可上调SIRT1、PGC1α的表达并增加其活性,进而在线粒体生物合成、能量代谢和氧化应激中发挥重要调节作用[17-18]。AMPK/SIRT1/PGC1α通路的激活有利于维持神经元的氧化还原平衡,保护神经元氧化应激、衰老等诱导的凋亡[19]。Xu等[20]研究发现,通过激活AMPK通路可以减轻蛛网膜下腔出血造成的大鼠脑损伤,改善神经功能受损情况。本研究结果显示,ICH组大鼠脑组织p-AMPK/AMPK、SIRT1、PGC1α水平明显下降,表明ICH大鼠可能通过调节AMPK/SIRT1/PGC1α信号通路加重认知功能障碍和神经元损伤;而TIL组p-AMPK/AMPK、SIRT1、PGC1α水平明显升高,表明TIL可能通过抑制AMPK/SIRT1/PGC1α信号通路减轻认知功能障碍和神经元损伤。为了验证推测,本实验利用AMPK抑制剂Compound C进行干预,结果显示,与TIL组相比,TIL+Compound C组大鼠认知功能变差,脑组织神经元凋亡率、Caspase-3、Bcl-2蛋白表达水平均明显增加,p-AMPK/AMPK、SIRT1、PGC1α蛋白表达水平均明显下降,进一步证实TIL可能通过抑制AMPK/SIRT1/PGC1α信号通路对ICH大鼠的认知功能和神经元起到保护作用。
综上所述,TIL可能通过抑制AMPK/SIRT1/PGC1α信号通路来减轻ICH大鼠的认知功能障碍和神经元损伤。然而,黄酮类药物是否都有此类功效,需要进一步探究。
参考文献:
[1] AL-KAWAZ M N,HANLEY D F,ZIAI W.Advances in therapeutic approaches for spontaneous intracerebral hemorrhage[J].Neurotherapeutics,2020,17(4):1757-1767.
[2] ABUNIMER A M,ABOU-AL-SHAAR H,CAVALLO C,et al.Minimally invasive approaches for the management of intraventricular hemorrhage[J].Journal of Neurosurgical Sciences,2018,62(6):734-744.
[3] 曹文疆,信盼,赵云丽,等.田蓟苷对动脉粥样硬化模型小鼠的改善作用及机制研究[J].中国药房,2022,33(1):19-25.
[4] 马丽月,曾诚,郑瑞芳,等.田蓟苷对脑缺血再灌注损伤模型大鼠脑组织的保护作用研究[J].中国药房,2018,29(20):2805-2810.
[5] FORRESTER S J,KIKUCHI D S,HERNANDES M S,et al.Reactive oxygen species in metabolic and inflammatory signaling[J].Circ Res,2018,122(6):877-902.
[6] DONG X L,WANG Y H,XU J,et al.The protective effect of the PDE-4 inhibitor rolipram on intracerebral haemorrhage is associated with the cAMP/AMPK/SIRT1 pathway[J].Scientific Reports,2021,11(1):19737.
[7] PI Z D,LIU J Y,XIAO H,et al.L-3-n-butylphthalide promotes restoration after an experimental animal model of intracerebral hemorrhage[J].International Journal of Medical Sciences,2021,18(12):2607-2614.
[8] 何文婧,刘亚东,米思蓉,等.脂联素通过减少NLRP3炎症体的表达来减轻脑出血大鼠模型认知障碍的机制[J].临床和实验医学杂志,2021,20(13):1348-1353.
[9] 赵云丽,袁勇,马晓莉,等.基于AMPK/SIRT1/PGC-1α信号通路研究香青兰总黄酮对大鼠心肌缺血再灌注损伤的保护机制[J].中国药房,2021,32(3):278-283.
[10] CHEN Y H,CHEN S P,CHANG J B,et al.Perihematomal edema after intracerebral hemorrhage:an update on pathogenesis,risk factors,and therapeutic advances[J].Frontiers in Immunology,2021,12:740632.
[11] VELTKAMP R,PURRUCKER J.Management of spontaneous intracerebral hemorrhage[J].Current Neurology and Neuroscience Reports,2017,17(10):80.
[12] LATTANZI S,DI NAPOLI M,RICCI S,et al.Matrix metalloproteinases in acute intracerebral hemorrhage[J].Neurotherapeutics,2020,17(2):484-496.
[13] 姜雯,杨浩,席梅,等.田蓟苷对高脂饮食ApoE-/-小鼠抗动脉粥样硬化活性及作用机制[J].中成药,2021,43(8):2024-2029.
[14] WU C H,TSAI Y C,TSAI T H,et al.Valproic acid reduces vasospasm through modulation of Akt phosphorylation and attenuates neuronal apoptosis in subarachnoid hemorrhage rats[J].International Journal of Molecular Sciences,2021,22(11):5975.
[15] HUANG D J,LI Y,YANG Z X,et al.Association of the TLR4-MyD88-JNK signaling pathway with inflammatory response in intracranial hemorrhage rats and its effect on neuronal apoptosis[J].European Review for Medical and Pharmacological Sciences,2019,23(11):4882-4889.
[16] LI B,ZHANG Y,LI H Y,et al.Miro1 regulates neuronal mitochondrial transport and distribution to alleviate neuronal damage in secondary brain injury after intracerebral hemorrhage in rats[J].Cellular and Molecular Neurobiology,2021,41(4):795-812.
[17] YANG X P,LIU Q H,LI Y P,et al.The diabetes medication canagliflozin promotes mitochondrial remodelling of adipocyte via the AMPK-Sirt1-Pgc-1α signalling pathway[J].Adipocyte,2020,9(1):484-494.
[18] TIAN L,CAO W J,YUE R J,et al.Pretreatment with Tilianin improves mitochondrial energy metabolism and oxidative stress in rats with myocardial ischemia/reperfusion injury via AMPK/SIRT1/PGC-1 alpha signaling pathway[J].Journal of Pharmacological Sciences,2019,139(4):352-360.
[19] LIN J Y,KUO W W,BASKARAN R,et al.Swimming exercise stimulates IGF1/PI3K/Akt and AMPK/SIRT1/PGC1α survival signaling to suppress apoptosis and inflammation in aging hippocampus[J].Aging,2020,12(8):6852-6864.
[20] XU W L,YAN J,OCAK U,et al.Melanocortin 1 receptor attenuates early brain injury following subarachnoid hemorrhage by controlling mitochondrial metabolism via AMPK/SIRT1/PGC-1α pathway in rats[J].Theranostics,2021,11(2):522-539.
(收稿日期:2022-08-11)
(本文编辑王丽)



