薛 瑞,章 激,张玉洁,李 灿
(湖北文理学院附属襄阳市中心医院,湖北 襄阳 441021)
参麦注射液对荷H22小鼠免疫功能的影响
薛 瑞,章 激,张玉洁,李 灿
(湖北文理学院附属襄阳市中心医院,湖北 襄阳 441021)
目的 研究参麦注射液对荷瘤小鼠免疫功能的影响。方法 建立 H22细胞小鼠移植瘤模型,将荷瘤小鼠随机分为模型组(荷瘤空白组),参麦注射液三个剂量组,另设空白参考组,每日灌胃给药,通过测定对白细胞总数及分类,sIL-2R、IL-2、IL-4含量,脾淋巴细胞增殖及迟发超敏反应能力的影响,探讨参麦注射液的免疫调节作用。结果 参麦注射液可提高荷瘤小鼠白细胞总数;降低荷瘤小鼠血清 sIL-2R的含量,提高 IL-2,IL-4水平,改善小鼠脾淋巴细胞增殖和迟发型超敏反应能力。结论
参麦注射液具有增强机体免疫功能的作用。
参麦注射液;H22;白细胞;sIL-2R;IL-2;IL-4;脾淋巴细胞增殖;迟发超敏反应
恶性肿瘤是严重危害人类健康的疾病之一,其发病率逐年上升。目前治疗肿瘤的常用有效手段为放疗及化疗,但由于其细胞毒作用,常引起机体免疫能力下降[1-2]。因此寻找安全有效的抗肿瘤药物具有重要意义。参麦注射液具有益气固精,养阴生津等功效。方中人参益气、固脱生津、养心;麦冬定肺气、安五脏,两药配伍益气固脱,养阴生津[3]。临床上参麦注射液与化疗药物联用可扶正培本,改善气阴两虚和脾胃失和证候等。本实验拟观察参麦注射液对荷H22小鼠外周白细胞总数、sIL-2R、IL-2,IL-4含量,脾淋巴细胞增殖及迟发超敏反应能力的影响来探讨其对小鼠免疫功能的影响。
1 材料
1.1 动物与仪器 ICR小鼠 60只,SPF级,体重18~20 g,雌雄兼用,由襄阳医学院动物实验中心提供。合格证号:襄医动字第2001001号。雅培血细胞分析仪,美国雅培 -1700;电子天平AY-120,日本岛津;Model 550型酶联免疫检测仪,美国 BIO-RAD公司。
1.2 瘤株 H22细胞株,华中科技大学同济医学院提供。
1.3 药物与试剂 参麦注射液(正大青春宝药业有限公司,批号:1206235);RPMI 1640培养基(Gbico公司);美洲商陆(PMW)、刀豆蛋白A和MTT(Sigma公司);可溶性白介素-2受体(sIL-2R)定量 EIA试剂盒(上海森雄科技实业有限公司);IL-2和IL-4酶联免疫检测试剂盒(GDB公司);超纯水为自制;其余试剂均为国产分析纯。
2 方法
2.1 荷 H22移植瘤小鼠模型的建立 传代:取武汉同济大学相关科研组已建的H22腹水瘤模型小鼠(已传代至第8天)数只,颈椎脱臼处死,抽取腹水,灭菌 NS调瘤细胞数至 1×107·mL-1,计数活细胞数为98%以上可用,取0.2 mL瘤细胞悬液接种于小鼠腹腔。按照此法体内传代 3次。接种:将接种6~8 d后腹水生长良好的小鼠颈椎脱臼处死,抽取腹水,用 NS稀释。取 ICR小鼠 45只,雌雄兼用,(20±2)g。除空白参考组外,每鼠接种0.2 mL瘤细胞悬液于右腋窝皮下。
2.2 分组及给药 分组:接种24 h后,取初步观测认定建模成功的小鼠 40只(后续试验中将给以检验认定),随机分为以下4组,每组10只:
A1:模型组(荷瘤模型对照组);A2:参麦20组(给参麦注射液20 mL·kg-1);A3:参麦 40组(给参麦注射液40 mL·kg-1);A4:参麦80组(给参麦注射液80 mL·kg-1)。
此外,建立A0:空白参考组,即未建立H22移植瘤模型的空白鼠 4只。
给药:空白参考组和模型组均灌胃生理盐水0.2 mL·d-1,连续灌胃7d;A2、A3及 A4等三个给药组分别按照 20、40和 80 mL·kg-1·d-1灌胃。连续给药7 d。
此外,取4只空白鼠作为A0:空白参考组。2.3 检测小鼠血常规 末次给药后 24 h,眶静脉丛采血,检测血常规中白细胞(WBC)、淋巴细胞(LY)、中性粒细胞(NEUT)、单核细胞(MONO)、嗜酸性粒细胞(EO)及嗜碱性粒细胞(BASO)的浓度。
2.4 检测血清 sIL-2R的含量 末次给药后 24 h,眶静脉丛采血,收集血清,按试剂盒说明书用双抗体夹心ABC-ELISA法测定 sIL-2R的含量。
2.5 检测血清 IL-2,IL-4的含量 末次给药后24 h,眶静脉丛采血,收集血清,按试剂盒说明书采用 ELISA法测定 IL-2,IL-4的含量。
2.6 脾淋巴细胞增殖实验 采血后,颈椎脱臼处死小鼠,无菌分离小鼠的脾脏,常规制备脾淋巴细胞,RPMI 1640,体积分数为 0.1的 FBS,5×10-5mol·L-12-巯基乙醇培养液重悬细胞,调整细胞浓度至2×109·L-1,接种于96孔板,加入终浓度为5 mg·L-1的PWM,常规培养70 h后,MTT法检测各孔活细胞总数的情况,由以下公式计算刺激指数:
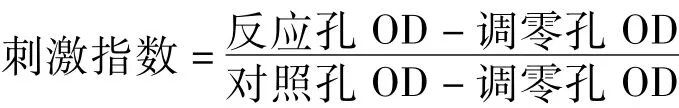
2.7 迟发型超敏反应实验 给药 d 2小鼠背部剃毛,在1×1 cm2范围内涂抹20 μL丙酮致敏,给药d 5,各组小鼠右耳用0.08 mol·L-1DNFB丙酮20 μL进行攻击,48 h后颈椎脱臼处死小鼠,剪下双耳,打孔称重,以左右耳重量之差作为耳廓肿胀度。
2.8 统计分析 采用SPSS16.0软件进行统计学分析,计量资料以±s表示,均通过正态性检验。多组间的比较为单因素方差分析,各组间两两比较(多重比较)为 HSD-q检验。显着性水准 α=0.05。
3 结果
3.1 对免疫抑制小鼠血常规的影响 数据见表1。与空白参考组相比,模型组WBC总数明显降低,分类结果显示比例失调;与模型组相比,参麦三个剂量组的白细胞(WBC)、淋巴细胞(LY)均明显增高(P<0.05);中性粒细胞(NEUT)绝对数(总数×比例)明显较低(P<0.05),符合外周血WBC等组成特点。各指标具体的统计比较结果见表 1,不再逐一评价。
3.2 对荷瘤小鼠血清sIL-2R含量的影响 数据列示于表2。与空白参考组相比,荷瘤小鼠血清中sIL-2R含量明显升高;参麦三个剂量组均可降低荷瘤小鼠血清中 sIL-2R含量。统计分析如下:
A1~A4等四个组整体比较(单因素方差分析)为有显着性差异(P<0.05);各组两两多重比较(HSD-q检验):参麦各组与模型组相比,差异均为显着(P<0.05);参麦各组间比较,也多有显着性意义(P<0.05)。

表 1 参麦对荷瘤小鼠外周血白细胞的影响(Mean±Sd,n=10)

表 2 参麦对荷瘤小鼠血清 sIL-2R、IL-2,IL-4含量的影响(Mean±Sd,n=10)
3.3 对荷瘤小鼠血清 IL-2,IL-4含量的影响 数据仍见表2。总的变化趋势和前述 sIL-2R相反:即荷瘤小鼠血清IL-2,IL-4明显低于空白参考组;参麦各剂量组尤其是高、中剂量组,其血清 IL-2,IL-4水平均明显高于模型组。统计分析如下:
IL-2,IL-4这二指标,A1~A4等四个组整体比较,差异均有显着性意义(P<0.05);各组两两比较:参麦各组与模型组相比,参麦各组间比较,差异也多为显着(P<0.05);详见表2。
3.4 对荷瘤小鼠系统免疫功能的影响 数据见表3。由数据看出:与空白参考组相比,荷瘤小鼠脾脏淋巴细胞的体外增殖及其迟发型超敏反应能力明显降低;与模型组比较,参麦对PWM刺激的小鼠脾淋巴细胞增殖和迟发型超敏反应能力有明显改善作用。统计分析如下:
刺激指数及耳廓肿胀度这两指标,A1~A4等四个组整体比较,差异均有显着性意义(P<0.05);各组两两比较:参麦各组与模型组相比,差异均为显着;参麦各组间比较,部分为差异显着(P<0.05);详见表3。
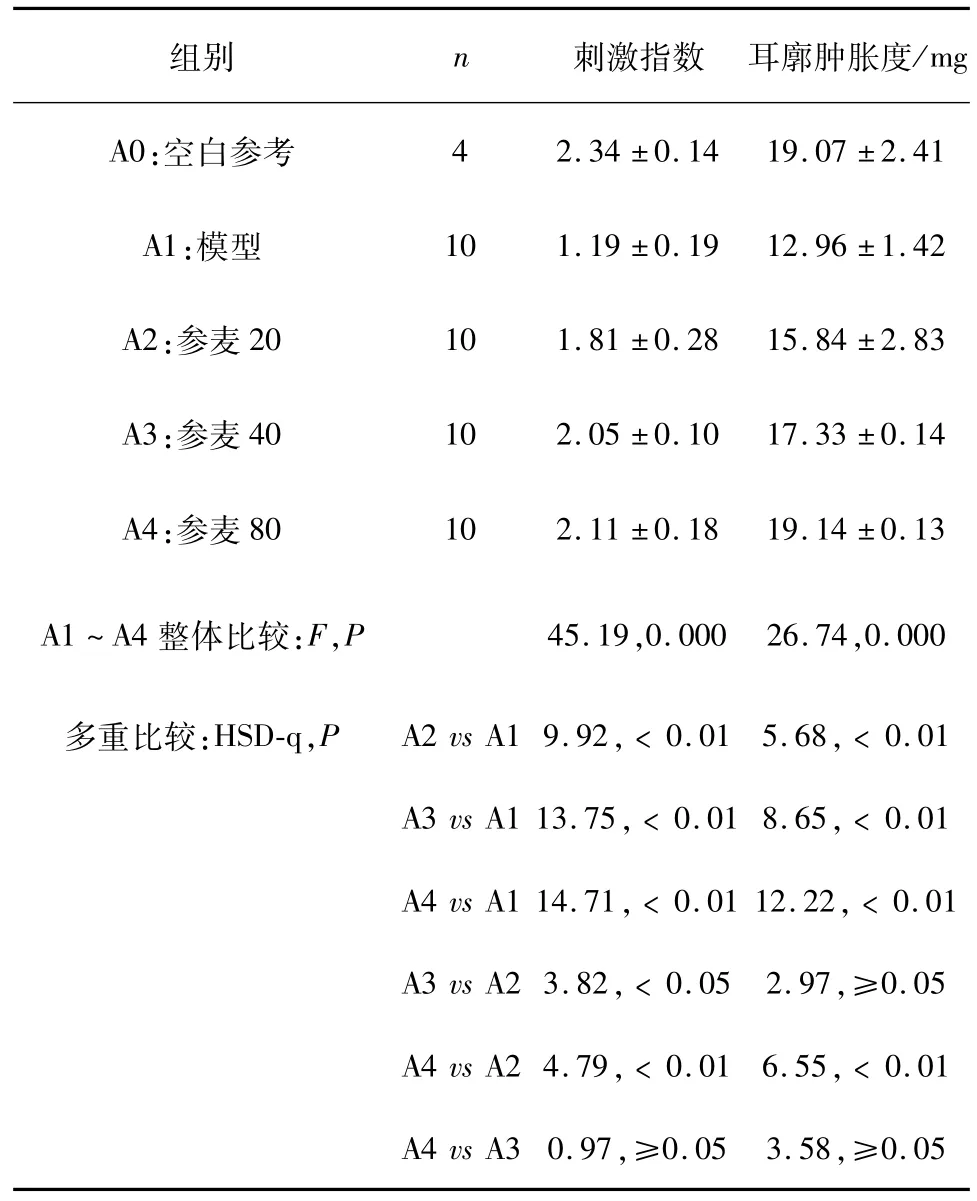
表3 参麦对荷瘤小鼠脾淋巴细胞增殖和迟发超敏反应的影响(Mean±Sd,n=6)
4 讨论
机体的免疫功能状态与肿瘤的发生和发展有着密切的关系,当宿主免疫功能低下或者受到抑制时,肿瘤的发生率明显增高,在肿瘤进行性生长时肿瘤患者的免疫功能也受到抑制[4-5]。外周白细胞为机体重要的免疫细胞;可溶性白细胞介素2受体(Solvable Interleukin-2 Receptor,sIL-2R)是一种重要的免疫抑制物[6];IL-2是参与免疫应答的重要细胞因子,具有调节机体免疫作用[7],sIL-2R可与 IL-2R竞争性结合 IL-2,从而抑制后者的抗肿瘤等生物学活性;IL-4是 B细胞活化的启动因子,可促进 B细胞增殖、成熟及分化产生 IgE,从而促进体液免疫应答。IL-4的免疫作用机制复杂,但它与其他白介素在体内的含量比率应趋于平衡状态,过高或过低都提示免疫系统可能受到损伤[8-9]。
本实验观察到参麦注射液可显着升高荷瘤小鼠的白细胞总数,降低荷瘤小鼠血清sIL-2R的含量,显着提高血清 IL-2,IL-4的水平,提示参麦注射液对荷 H22小鼠的免疫功能具有一定的改善和调节作用。
小鼠迟发型超敏反应是因 DNFB与小鼠腹壁皮肤蛋白结合可形成一种完全蛋白,并由此刺激 T淋巴细胞增殖成致敏淋巴细胞,再用DNFB进行抗原攻击,致使局部肿胀,其肿胀的程度可以反应迟发型超敏反应程度,属细胞特异性免疫能力[10]。参麦注射液对 PWM刺激的小鼠脾淋巴细胞增殖和迟发型超敏反应能力有明显改善作用。综上提示参麦注射液对荷瘤小鼠的系统免疫状态有改善和调节作用,这对恶性肿瘤等疾病的防治具有重要意义。
[1] 王晓慧,严玲微.恶性肿瘤放化疗后白细胞下降致医院感染调查与护理对策[J].中华医院感染学杂志,2012,22(1):91-92.
[2] 梁福贵,罗军强,梁汉昌.灯盏花素对肝癌细胞HepG2和正常肝细胞LO-2的体外增殖抑制作用[J].安徽医药,2012,16 (10):1423-1425.
[3] 沈培强,徐玲杰,白 洋,等.参麦注射液对小鼠血常规的影响及其脏器保护作用[J].中国新药杂志,2012,21(13):1532-1535.
[4] 王春花,胡 冰.CIK免疫治疗对肿瘤患者生活质量影响的观察[J].安徽医药,2013,17(3):406-408.
[5] Hobeika AC,Morse MA,Osada T,et a1.Depletion of Human Regu1atory T Cells[J].Methods Mol Biol,2011,707:219-231.
[6] 高 智,蒋 之,万 轲.初治肺结核患者强化治疗前后检测IL-2、SIL-2R及IL-4的临床意义[J].安徽医药,2012,16(2):215-216.
[7] 徐贤柱,饶 华,蔡险峰,等.杜仲叶多糖提取及对小鼠免疫功能影响研究[J].时珍国医国药,2013,24(3):541-542.
[8] 王佳华,毛 薇,王晓华,等.特应性皮炎患者外周血IFN-γ、IL-4、IL-18的检测[J].中国麻风皮肤病杂志,2013,29(1):21 -22.
[9] 张继成,吕文利.银杏叶提取物对双酚 A活化RBL-2H3细胞株表达IL-4和TNF-α的影响[J].现代免疫学,2013,33(2):119-122.
[10]李 覃,王 火,陈 虹,等.土槿乙酸调节特异性免疫应答的初步研究[J].中国药理学通报,2013,29(2):184-189.
Immunomodulatory effect of shenmai injection on mice with H22
XUE Rui,ZHANG Ji,ZHANG Yu-jie,et al
(Xiangyang Central Hospital Affiliated to Hubei University of Arts and Science,Xiangyang Hubei 441021,China)
Objective To study the immunomodulatory effect of shenmai injection on mice with H22.Methods After subcutaneous implantation of the H22 cells,the tumor-bearing mice were randomized into control group,three shenmai doses groups and normal control group.Those mice were given the different doses of shenmai.Immunity function of Shenmai was explored by determining its influence on leukocytes and classification,the serum content of sIL-2R,IL-2,IL-4,the spleen lymphocyte proliferation and delayed hypersensitivity thymus index.Results Shenmai injection significantly increased the white blood cells,IL-2 and IL-4,decreased the content of sIL-2R,promoted spleen lymphocyte proliferation and delayed hypersensitivity.Conclusion Shenmai injection modulates the immunity function on mice with H22.
shenmai injection;H22;leukocyte;sIL-2R;IL-2;IL-4;splenic lymphocyte proliferation;delayed hypersensitivity
10.3969/j.issn.1009-6469.2014.05.008
2013-10-05,
2014-01-08)
章 激,男,副主任药师,研究方向:肿瘤药理,E-mail:22751520@qq.com



