赵 扬,李 玮,阚家义,桂双英
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽食品药品检验研究院,安徽合肥 230051)
地红霉素属第二代类红霉素大环内酯类药物,该药物克服了红霉素在低pH下的不稳定性[1],其肠溶片于1995年FDA批准在美国销售。2005年在国内上市,现已纳入国家基本药物[2]。有文献报道[3]单剂量口服国产地红霉素(试验片)和进口地红霉素(参比剂),得到国产与进口地红霉素具有生物等效性。国内地红霉素肠溶片现有9个生产厂家。中国药典未收载地红霉素及其制剂,美国药典36版中收载了地红霉素原料和地红霉素肠溶片,EP8.0收载了地红霉素原料。因此国内各企业执行不同的国家食品药品监督管理局颁标准。目前主要采用高效液相色谱法测定地红霉素的含量[4-8]。本文综合7个不同厂家的企业标准,通过不同批号的样品实验,最终确定了适宜的地红霉素肠溶片主药含量的测定方法。
在水分的检测项目下,其中 YBH23982005、YBH40212005、YBH07012009、YBH12442006 标准并没有规定水分的含量测定,为此考察水分测定的必要性。参考 USP[9]水分测定项下 5.0%,本实验对3个厂家的地红霉素肠溶片进行了检查。
1 仪器与试药
TitroLine KF卡尔费休氏滴定仪(D55122 Mainz);高效液相色谱仪:戴安 ULTIMATE 3000 HPG-3400SD;分析天平:德国sartorius ME235S。
地红霉素对照品(中国药品生物制品检定所);地红霉素肠溶片;甲醇和乙腈为色谱纯,磷酸氢二钾和磷酸二氢钾为分析纯。
2 方法和结果
2.1 水分测定 在23℃,相对湿度35%环境下,此环境对实验结果影响不大[10]。取不同批号地红霉素肠溶片细粉适量,按照水分测定法(中国药典2010年版二部附录VIII M第一法A)测定,结果见表1。
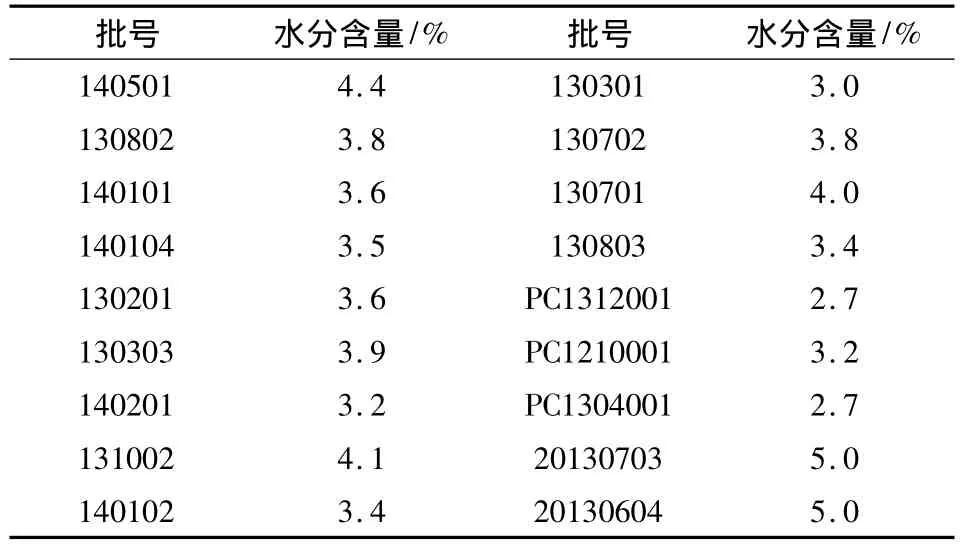
表1 地红霉素肠溶片水分含量
2.2 地红霉素含量测定
2.2.1 色谱条件 色谱柱为 Eclipse XDB-C18柱(250 mm ×4.6 mm,5 μm);乙腈—磷酸盐缓冲液(取1.41 g磷酸氢二钾与6.91 g磷酸二氢钾,加水1 000 mL 溶解后,过滤,即得)—甲醇(44∶37∶19)为流动相;检测波长205 nm,柱温40℃。
2.2.2 样品的前处理 取不同厂家不同批号的地红霉素肠溶片,首先测定地红霉素的含量,然后拆去包装,处理条件是样品平均裸露在温度70℃,相对湿度75%的变温箱中,放置5 d后,取出。
2.2.3 方法学的考察 (1)专属性:实验结果表明,空白溶剂与辅料在5 min前出峰,不影响样品测定。
(2)稳定性:本实验采用了丙酮、四氢呋喃、甲醇、乙腈、二甲基甲酰胺等有机溶剂,考虑其溶解性与稳定性因素,选择乙腈∶甲醇(7∶3)为溶剂,称取地红霉素对照品适量,稀释到2.0 g·L-1,分别于0、1、2、4、6、8 h 进样 20 μL 测定,结果表明 8 h 内,16R-地红霉素的峰面积 RSD为5.06%,而16R与16S的总峰面积RSD为1.26%。
(3)标准曲线及线性:精密取地红霉素对照品适量,用乙腈∶甲醇(7∶3)溶剂溶解稀释制成0.5、1.0、1.5、2.0、2.5 g·L-1的溶液,按高效液相色谱法测定,分别得到线性回归方程为Y=14.754X+0.0674(r2=0.999 9)。
(4)回收:精密称取地红霉素 15、20、25 mg,按处方比例加入空白辅料,分别用乙腈∶甲醇(7∶3)溶剂溶解稀释制成1.5、2.0 和2.5 g·L-1。按高效液相色谱法测得16R与16S-地红霉素峰面积按外标法计算测得量和回收率。结果表明,三个剂量的回收率分别为 99.5%、99.9%、100.1%。
2.2.4 测定 采用不除包衣进行地红霉素肠溶片中地红霉素的含量测定[11]。取本品20片,精密称定,研细,精密称取适量(约相当于地红霉素50 mg),置于25 mL容量瓶中,加乙腈∶甲醇(7∶3)混合液超声使其溶解,并稀释至刻度,摇匀,滤过,立即取滤液20μL注入液相色谱仪中,记录色谱图(图1~3);另取地红霉素适量,同法配制成2.0 g·L-1的溶液。按外标法将16R地红霉素与16S地红霉素的峰面积合并计算。含量结果见表2。
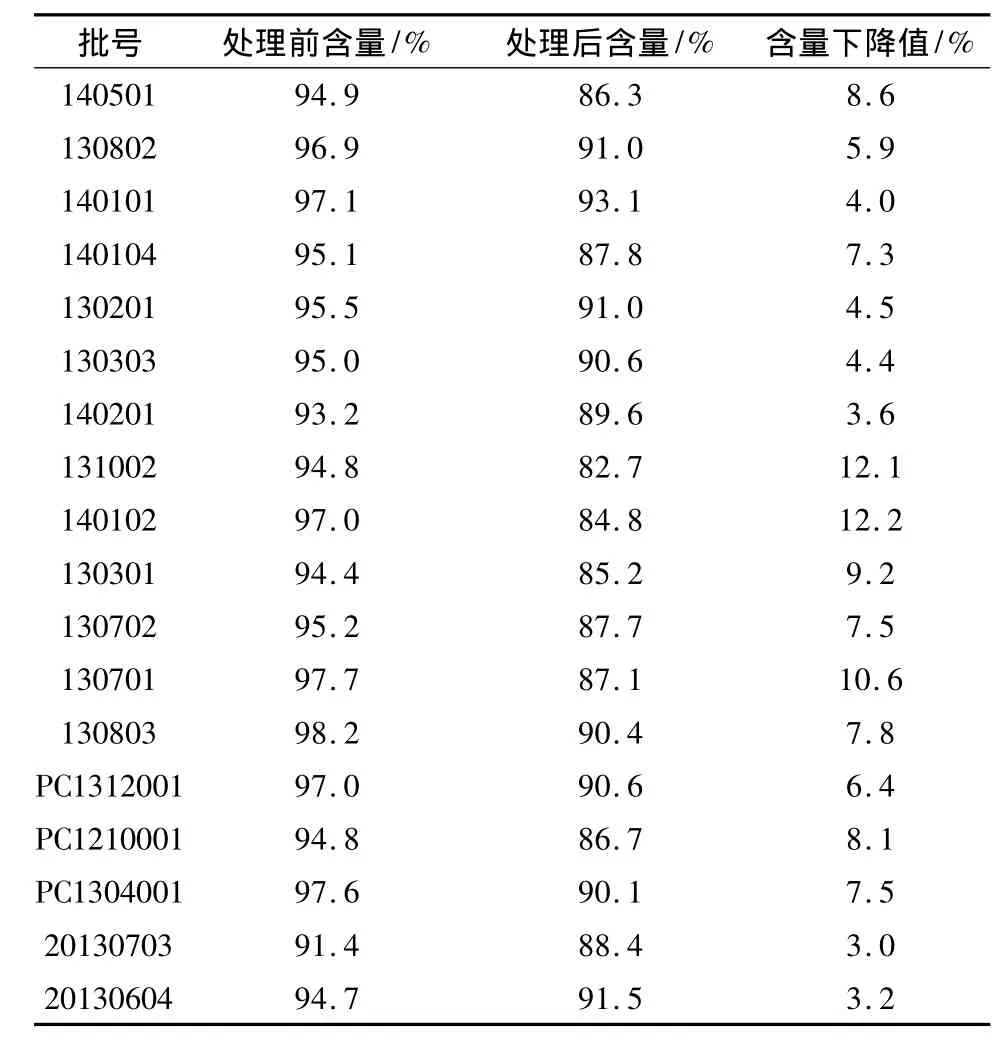
表2 样品在高温高湿处理前后地红霉素含量
2.3 数据分析结果 统计方法:使用SPSS17.0建立数据库并进行统计分析,定性资料采用相对数进行描述;定量资料使用均数±标准差进行描述,组间比较采用成组设计t检验,采用Pearson相关对水分与地红霉素肠溶片含量下降值进行相关分析,以P<0.05为差异有统计学意义。
统计结果:同水分的样品,经过相同的处理,含量下降值存在明显的差异,对样品处理前后的数据进行配对t检验,可知处理后地红霉素肠溶片含量(均数±标准差)低于处理前(均数±标准差),且差异有统计学意义(t=10.288,P <0.001)。再对样品的水分与含量下降值进行相关分析,水分与含量下降值间无相关性(r=-0.278,P=0.265)。
3 讨论
建立HPLC法测定地红霉素的主药含量,快速准确。通过相关分析结果显示,地红霉素肠溶片中水分的高低并不影响其主药稳定性,其稳定性可能与生产工艺有很大关系[12-13],建议国内各企业在生产的过程中,根据肠溶片的性质,严格控制其他工艺的处方比例;针对国内各企业执行不同的国家食品药品监督管理局颁标准中水分的检测项目下,建议地红霉素肠溶片检测项目下水分≤5%。
[1]张宇迪,夏海波,王 仲.长效安全的大环内酯类抗生素——地红霉素[J].中国临床药理学杂志,2011,27(6):467-471.
[2]韩 晗,秦 侃,范鲁雁.国外基本药物制度的特点及对我国基药政策制定的启示[J].安徽医药,2014,18(3):582-584.
[3]张岱云,裘福荣,冒国光,等.地红霉素片在中国健康志愿者体内的药代动力学和生物等效性[J].中国临床药理学杂志,2004,20(3):193-195.
[4]张树清,崔文奇,王东凯,等.HPLC法测定地红霉素肠溶微丸的有关物质[J].中国实用医药,2008,3(6):46-47.
[5]张亚杰,赫爱萍,张 斌.HPLC法测定地红霉素及其肠溶片、肠溶胶囊、肠溶颗粒的含量[J].中国药品标准,2004,5(5):43-46.
[6]刘新元.HPLC法测定地红霉素片含量[J].天津医科大学学报,2005,11(1):116-117.
[7]朱志宏,梁胜华.高效液相色谱法测定地红霉素肠溶片中地红霉素的含量[J].中南药学,2007,5(2):105-107.
[8]Diana J,Manyanga V,Hoogmartens J,et al.Development and validation of an improved liquid chromatographic method for the analysis of dirithromycin[J].Talanta,2006,70(5):1064-1072.
[9]United Stares Pharmacopeial Convention.Inc.The United States Pharmacopeia[S].The 23th,Tenth Supplement,1998:4819.
[10]王 君,胡昌勤,胡育筑.费休氏水分测定法的不确定度评定[J].药物分析杂志,2006,26(5):674-677.
[11]朱志宏,梁胜华.高效液相色谱法测定地红霉素肠溶片中地红霉素的含量[J].中南药学,2007,5(2):105-107.
[12]安 明.地红霉素的合成及质量研究[D].北京:中国协和医科大学,2003.
[13]崔文奇,王东凯,贺小玲,等.地红霉素肠溶微丸的处方与制备工艺研究[J].中国新药杂志,2009(12):1164-1167.



