叶记林,于有江,吴爱莲,王冬燕,彭建明,刘永春,刘延庆
(1.扬州市职业大学医学院,江苏 扬州 225009;2.江苏省苏北人民医院儿科,江苏 扬州 225000;3.扬州大学医学院,江苏扬州 225001)
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis inducing ligand,TRAIL)是一种具有良好前景的治疗肿瘤的药物,它能选择性诱导多种肿瘤细胞凋亡,而对正常组织无明显损伤。但较高浓度的TRAIL对人体正常细胞也有损伤,多种肿瘤细胞株对TRAIL诱导的凋亡并不敏感等问题阻碍了 TRAIL的应用[1]。弄清TRAIL诱导癌细胞凋亡的发生机制是突破点。近年来,越来越多的实验证明,TRAIL诱导多种肿瘤细胞凋亡与氧化应激密切相关[2-3]。然而TRAIL诱导肿瘤细胞凋亡的氧化应激作用的具体机制研究很少,现以Hela细胞为模型探讨TRAIL诱导肿瘤细胞凋亡的氧化应激作用,为临床肿瘤治疗提供参考。我们以往的实验证实TRAIL诱导Hela细胞凋亡中线粒体途径发挥了重要作用[6],本实验拟进一步探讨氧化应激作用与线粒体途径的关系。
1 材料与方法
1.1 材料 人宫颈癌 Hela细胞购自中国科学院上海细胞生物库。Human TRAIL蛋白购于 Millipore公司,DMEM培养基购于Gibco公司,小牛血清购于杭州四季青公司,MTT和二甲基亚砜(DMSO)购于Amresco公司,N-乙酰半胱氨酸(NAC)购于Calbiochem公司,GSH、MDA检测试剂盒购于南京建成生物工程研究所,Bcl-2、Cyt C、DR 4、DR 5 抗体购自Cell Signal公司,MRC-1024型激光共聚焦仪和流式细胞仪为美国BIO-RAD公司产品。
1.2 实验方法
1.2.1 细胞培养 Hela细胞用含10% 小牛血清的DMEM 培养液,在 37℃,5%CO2饱和湿度下培养。选择对数生长期的细胞用于实验。设生理盐水对照组、TRAIL组(终浓度为40μg·L-1)、抗氧化剂 NAC 组(终浓度为10 mmol·L-1)、TRAIL+NAC组(先用10 mmol·L-1NAC预处理细胞2 h,然后加入 TRAIL)。当细胞处理时,换含2%小牛血清的培养液进行培养。
1.2.2 MTT法检测细胞增值的抑制 取对数生长期细胞,以2×105/孔细胞接种于24孔板。分组处理细胞,每组设6个复孔。药物作用后每孔加入0.5 g·L-1MTT 300 μL,孵育 4 h后弃去培养液,每孔加入 DMSO 500μL,振荡10 min,完全显色后,转移至96孔板,用酶标仪在570/630 nm波长测吸光度OD值(OD值代表相对活细胞数)。
1.2.3 分光光度比色法分析 GSH、MDA含量的变化 分组处理细胞,将收集的细胞用预冷的 PBS(pH 7.2)重悬,超声破碎细胞制成匀浆液,4℃ 离心,取上清液,采用分光光度比色法检测细胞匀浆液总蛋白含量,GSH、MDA含量检测严格按试剂盒说明书进行。
1.2.4 流式细胞仪测定胞内活性氧水平 参照文献[7]方法,细胞用10μ mol·L-1DCFH-DA 在 37℃ 孵育45 min,然后分组加药处理细胞。细胞孵育后用PBS漂洗,用流式细胞仪以488 nm为激发波长,530 nm为发射波长测定细胞内的绿色荧光强度。每份样品记10 000个细胞。
1.2.5 Rh-123结合激光共聚焦检测线粒体膜电位(ΔΨm) 按照文献[6]的方法进行,收集处理后的各组细胞用PBS洗涤2次,然后加入罗丹明123(Rh-123),使其终浓度为 5 mg·L-1,37℃ 闭光孵育20 min,再用PBS洗3遍,激光共聚焦显微镜于505 nm激发光、534 nm发射光实时监测细胞胞内荧光强度。统计每个样品中所有受检测细胞的荧光强度值的均值,该值即反映相对ΔΨm的强度。
1.2.6 Western blot检测 Bcl-2、Cyt C、DR 4 和DR 5
收集处理后的各组细胞。按常规方法提取蛋白质,恒压进行SDS电泳分离,然后电转到 PVDF膜上,分别与 Bcl-2兔多抗、鼠抗人 DR 4单抗、鼠抗人DR 5单抗、4℃ 孵育过夜,再加入羊抗兔 IgGHRP室温孵育1 h,将膜洗涤干净后,加 TMB显色液显色、摄影。一部分细胞参照文献分离[8]细胞质蛋白。以 Cyt C鼠单抗为一抗检测 Cyt C蛋白含量。
1.2.7 统计与分析 应用 SigmaPlot 12.0及 Excel 2003统计软件,所有实验重复3次或以上,结果以x±s表示,多组间均数比较采用单因素方差分析,两独立组间比较采用LSD-t检验。以P<0.05为差异有显着性。
2 结果
2.1 TRAIL对 Hela细胞生长的影响 40μg·L-1TRAIL作用于Hela细胞12 h后,对细胞的生长具有显着的抑制作用 (P< 0.01)。40μg·L-1TRAIL+10 mmol·L-1NAC组虽然也对细胞生长有抑制作用,但与单独 TRAIL组比较,NAC能明显减弱 TRAIL对 Hela细胞的生长抑制作用,P=0.000。而单独的 NAC对细胞的生长没有明显影响(图1)。
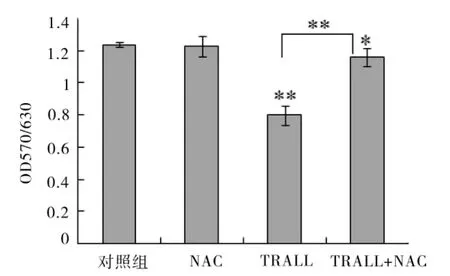
图1 TRAIL对Hela细胞增殖的抑制作用(x ±s,n=4)
2.2 TRAIL引起细胞GSH、MDA含量的变化
由表1可知,单独40μg·L-1TRAIL作用组,随着作用时间的延长,Hela细胞内抗氧化因子 GSH含量与对照组比较,从2 h开始均有显着降低 (P<0.01),且呈现时间依赖性;氧化应激产物 MDA含量在TRAIL作用2 h时基本不变,只是从4 h开始逐渐降低,且呈现时间依赖性。
40 μg·L-1TRAIL+10 mmol·L-1NAC 组,抗氧化因子 GSH含量从4 h开始才略有降低,到8 h GSH 含量仍然有(116.2 ± 4.7)mg·g-1Pro,明显高于单独 TRAIL处理8 h GSH含量(57.7±1.2)mg·g-1Pro,与对照组相比相差不多;而 MDA含量随着作用时间延长基本维持不变。
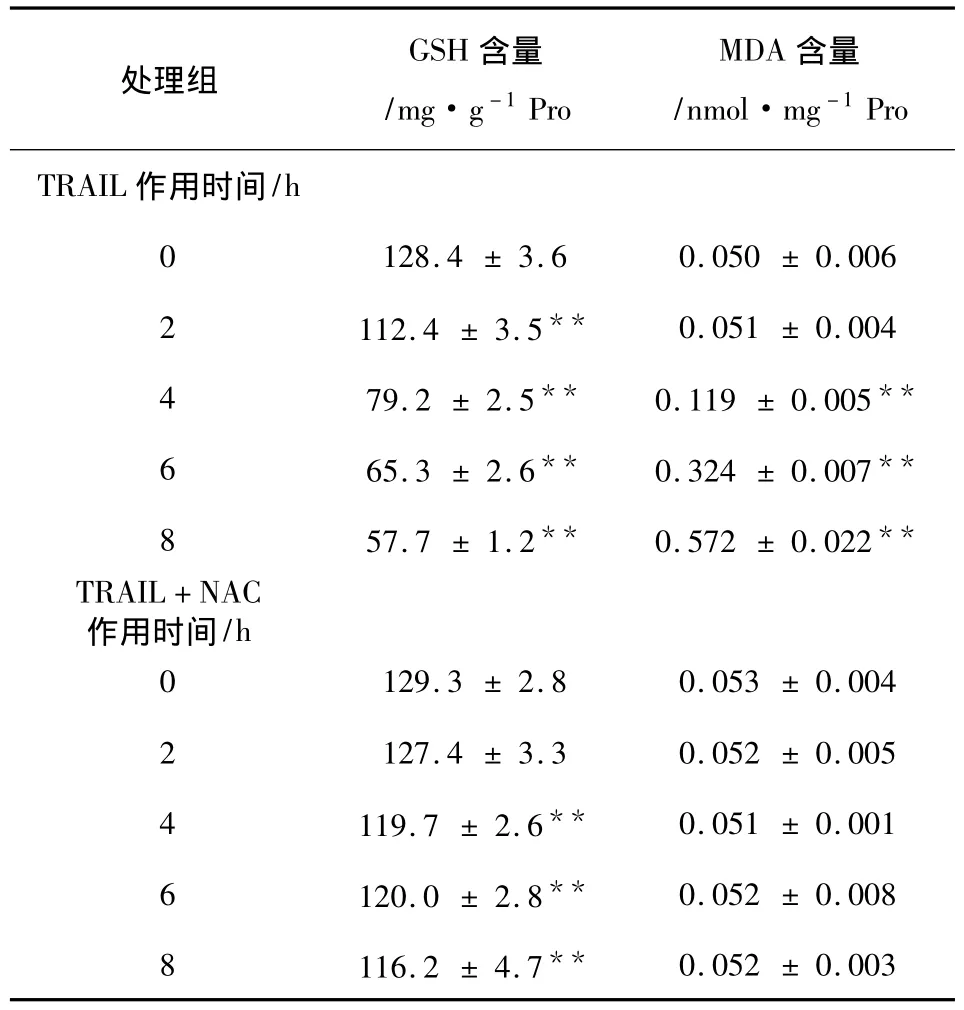
表1 TRAIL,NAC+TRAIL作用不同时间引起GSH、MDA含量变化(x ±s,n=4)
2.3 TRAIL引起细胞内 ROS含量变化 由图2可知,以DCFC-DA转化生成的平均荧光强度代表ROS含量,40μg·L-1TRAIL作用的细胞从2 h开始细胞内绿色荧光强度明显提高,产生的ROS量随着作用时间的延长不断升高,到4 h时ROS的含量已经达到了对照组的2.33倍。而 NAC能完全抑制TRAIL导致的细胞内 ROS的含量升高(数据未显示)。
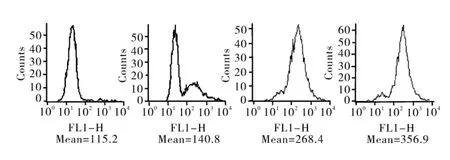
图2 流式细胞仪检测TRAIL引起细胞内ROS的变化
2.4 TRAIL引起 Hela细胞 ΔΨm 的变化 如图3所示,Rh-123荧光强度值反映的是线粒体膜电位(ΔΨm)的大小。TRAIL处理4 h组与对照组相比ΔΨm变化不大,随着处理时间的延长,ΔΨm逐渐降低,呈现明显的时间依赖性 (P<0.01)。而NAC能完全抑制TRAIL引起的ΔΨm下降。
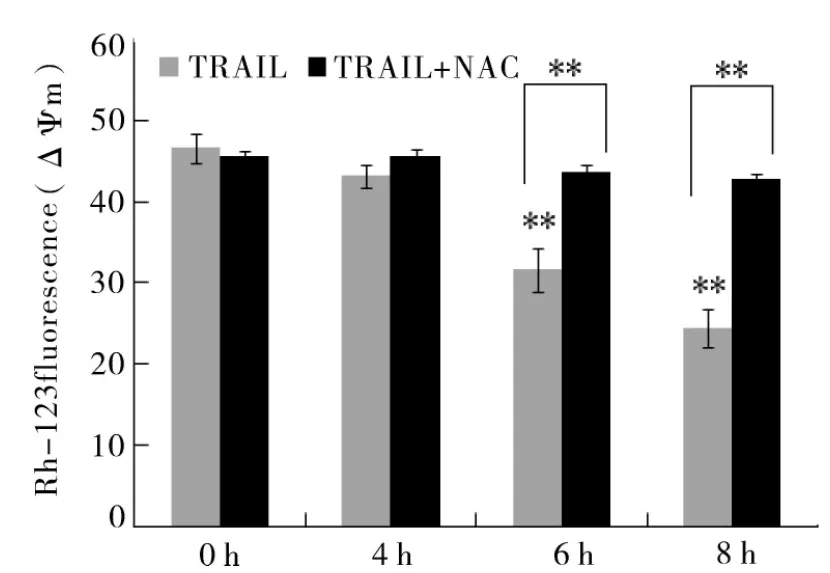
图3 激光共聚焦显微镜检测细胞线粒体的Rh-123荧光强度值变化(x ±s,n=4)**
2.5 TRAIL 引起 Hela 细胞 Bcl-2、Cyt C、DR4、DR5蛋白量的变化 图4(a)、4(b)显示,与对照组相比,40μg·L-1TRAIL作用8 h后能明显下调抗凋亡蛋白Bcl-2的表达,提高死亡受体DR 5的表达,引起细胞线粒体内Cyt C向细胞质的释放,但对死亡受体DR 4的表达基本没有影响。而 NAC能完全抵消TRAIL引起的这些蛋白量的改变。
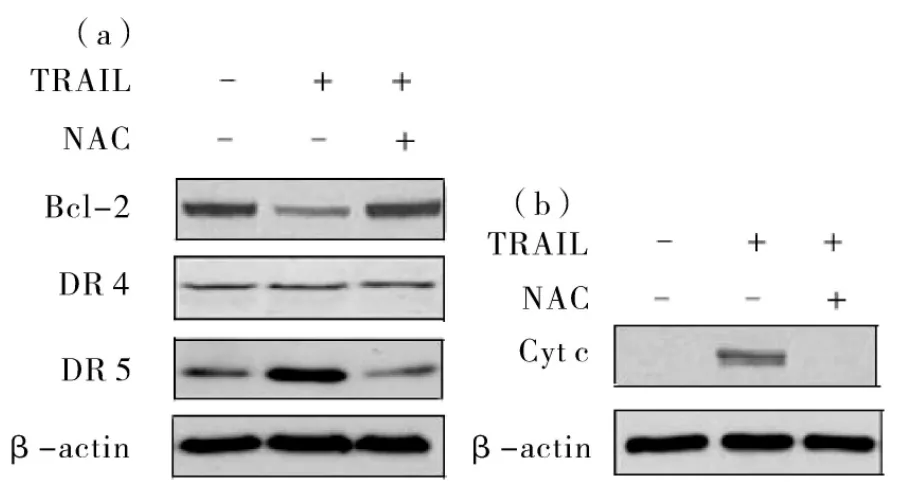
图4 TRAIL处理 Hela细胞中的Bcl-2、Cyt c、DR4、DR5蛋白量的变化
3 讨论
近年的研究证实,氧化应激与TRAIL引起的多种细胞凋亡密切相关[2-3]然而 TRAIL诱导肿瘤细胞凋亡的氧化应激作用的具体机制还不清楚。本实验结果显示TRAIL对Hela细胞的生长具有显着的抑制作用(图1),我们已经证实这种抑制主要是TRAIL通过诱导 Hela细胞凋亡进行的[4]。抗氧化剂NAC能明显减弱TRAIL对 Hela细胞的生长抑制作用,与Gatsinzi等报道的NAC能完全抑制多种药物联合TRAIL诱导的细胞凋亡作用结果相似[8]。这些表明氧化应激在TRAIL引起的Hela细胞凋亡中起重要作用。
经TRAIL处理后,Hela细胞内抗氧化代表物质GSH含量从2 h开始均有显着降低(表1),活性氧ROS的含量也是从2 h开始随着作用时间的延长不断升高。氧化应激主要产物 MDA含量在TRAIL作用2 h时基本不变,只是从4 h开始逐渐升高。而抗氧化剂NAC能基本消除TRAIL对Hela细胞产生的氧化应激作用 (表1)。GSH、ROS含量变化先于 MDA含量变化。这表明 TRAIL可以使细胞的氧化应激效应增强。而这可能是因为TRAIL首先抑制了抗氧化物质 GSH的生成,导致细胞清除ROS能力降低,使得ROS水平急剧升高,从而引发脂质过氧化反应而导致MDA含量的升高和细胞增值的抑制,与先前的报道相一致[7]。
在许多细胞的凋亡过程中,ROS的增加与线粒体凋亡途径关系密切[7-8]。而 TRAIL诱导 Hela细胞凋亡的可能途径之一是通过线粒体进行的[6]。本实验进一步探讨了 ROS的增加与线粒体凋亡途径的关系。TRAIL处理4 h组与对照组相比线粒体膜电位 ΔΨm变化不大,到6 h时 ΔΨm明显降低(图4)。另外,TRAIL作用8 h后能明显下调抗凋亡蛋白Bcl-2的表达,引起细胞线粒体内Cyt c向细胞质的释放(图4)。实验结果表明 ROS的升高 (TRAIL处理2 h时开始不断升高)是 TRAIL诱导Hela细胞凋亡的早期事件,要先于 ΔΨm下降 (TRAIL处理 6 h时开始明显降低)的发生。而NAC能抑制TRAIL引起的ΔΨm下降,也能完全抵消TRAIL引起的这些蛋白量的改变。提示ROS升高可直接或间接损伤线粒体而引发线粒体凋亡途径。其机制可能是ROS升高引起抗凋亡蛋白Bcl-2表达量下降和细胞线粒体氧化损伤,使线粒体膜电位下降,引起Cyt C等凋亡蛋白的释放,从而通过激活Caspases通路导致细胞凋亡。
TRAIL作用的主要途径是与死亡受体DR 4和DR 5结合,招募FADD(Fas-associated death domain protein),并进一步激活 Caspase-8,形成死亡诱导信号复合物,最后将活化信号传递并激活 Caspase-3,从而发挥诱导细胞凋亡的生物学功能,这是TRAIL凋亡的非线粒体途径[9-10]。本实验结果显示TRAIL处理后能上调死亡受体 DR 5的表达,但对死亡受体DR 4的表达基本没有影响。而 NAC能完全抑制 TRAIL所引起的 DR 5的升高 (图4)。提示TRAIL诱导Hela细胞凋亡的可能途径之一是通过ROS途径上调DR 5表达而进行的,与DR 4无关,这与以往的报道类似[11-12]。
综上所述,氧化应激在 TRAIL引起的 Hela细胞凋亡中起着重要作用,其机制可能是TRAIL导致抗氧化物质 GSH含量降低,清除 ROS能力降低,ROS水平急剧升高。ROS升高一方面导致抗凋亡蛋白Bcl-2表达量下降和细胞线粒体氧化损伤而激活线粒体凋亡通路。另一方面通过上调死亡受体DR 5表达而执行非线粒体凋亡途径。本实验为将TRAIL用于临床肿瘤治疗提供了一定的实验参考,也为TRAIL凋亡增敏剂的探索提供了研究基础。
[1] Dimberg LY,Anderson CK,Camidge R,et al.On the TRAIL to successful cancer therapy?Predicting and counteracting resistance against TRAIL-based therapeutics[J].Oncogene,2013,32(11):1341-1350.
[2] Park C,Jin CY,Hwang HJ,et al.J7,a methyl jasmonate derivative,enhances TRAIL-mediated apoptosis through up-regulation of reactive oxygen species generation in human hepatoma HepG2 cells[J].Toxicol In Vitro,2012,26(1):86 -93.
[3] Cao WQ,Li XL,Zheng SY,et al.Selenocysteine derivative overcomes TRAIL resistance in melanoma cells:evidence for ROS-dependent synergism and signaling crosstalk[J].Oncotarget,2014,5(17):7431 -7445.
[4] 叶记林,刘永春,于有江,等.TRAIL诱导 Hela细胞凋亡的线粒体信号通路[J].基础医学与临床,2011,31(10):1120-1123.
[5] Hussain AR,Uddin S,Ahmed M,et al.Ahmed Phosphorylated IκBα Predicts Poor Prognosis in Activated B -Cell Lymphoma and Its Inhibition with Thymoquinone Induces Apoptosis via ROS Release[J].PLOSOen,2013,8(3):e60540.
[6] Yuan CQ,Li YN,Zhang XF.Down-regulation of apoptosis-inducing factor protein by RNA interference inhibits UVA-induced cell death[J].Biochem Biophys Res Commun,2004,317(4):1108-1113.
[7] Su Z,Chen M,Xiao Y,et al.ROS - triggered and regenerating anticancer nanosystem:an effective strategy to subdue tumor's multidrug resistance[J].J Control Release,2014,196:370 -383.
[8] Gatsinzi T,Iverfeldt K.Sensitization to TRAIL - induced apoptosis in human neuroblastoma SK-N-AS cells by NF-jB inhibitors is dependent on reactive oxygen species(ROS)[J].J Neurooncol,2011,104(2):459 -472.
[9] Sessler T,Healy S,Samali A,et al.Structural determinants of DISC function:new insights into death receptor-mediated apoptosis signaling[J].Pharmacol Ther,2013,140(2):186 -199.
[10] Azijli K,Weyhenmeyer B,Peters GJ,et al.Non - canonical kinase signaling by the death ligand TRAIL in cancer cells:discord in the death receptor family[J].Cell Death Differ,2013,20(7):858-868.
[11] Hwang MK,Ryu BJ,Kim SH.AW00179 potentiates TRAIL-mediated death of human lung cancer H1299 cells through ROSJNK-c-Jun-mediated up-regulation of DR5 and down-regulation of anti- apoptotic molecules[J].Amino Acids,2012,43(4):1679-1687.
[12] Trivedi R,Maurya R,Mishra DP.Medicarpin,a legume phytoalexin sensitizes myeloid leukemia cells to TRAIL-induced apoptosis through the induction of DR5 and activation of the ROSJNK - CHOP pathway[J].Cell Death Dis,2014,5:e1465.



