杨 琳,谢瑞祥,杨 瑜,陈道光,邹思平
(福建医科大学教学医院、福建省肿瘤医院1.药剂科;2.内科,福建福州 350014)
MTX是一种抗叶酸代谢的抗肿瘤药,化学结构与叶酸类似,通过竞争性抑制细胞中二氢叶酸还原酶(DHPR)的活性,使二氢叶酸(FH2)还原为四氢叶酸(FH4)受阻,使5,10-甲酰四氢叶酸产生不足,从而使脱氧胸苷酸(dTMP)合成受阻,DNA合成障碍。MTX也可阻止嘌呤核苷酸的合成,因其环上的第2位和第8位碳原子是由四氢叶酸携带的一碳基团所供给,故能干扰蛋白质的合成[1]。
大剂量甲氨蝶呤(HD-MTX)指MTX剂量大于1 g·m-2,是治疗淋巴瘤及预防淋巴瘤中枢转移的主要药物之一[2-4],由于个体差异大,需要在血药浓度监测下使用,以保证用药安全[5]。MTX主要作用于快速增殖的肿瘤细胞和更新快的细胞,故其常见毒副反应有皮肤粘膜损伤、骨髓抑制,还可见胃肠道反应和肝肾毒性。CF作为四氢叶酸的甲酰衍生物,进入人体内后,通过四氢叶酸还原酶转变为四氢叶酸,能有效地对抗MTX引起的毒性反应[6]。MTX及其代谢物主要从肾脏排泄,所以肾功能不全的患者使用MTX化疗时应慎重,如果患者出现排泄延迟应及时水化、碱化尿液、增加CF解救剂量,以缓解MTX的细胞毒性,同时检查肝肾功能指标,严重时考虑血液透析,以降低血液MTX水平[7]。
临床上HD-MTX常用的给药方式为6 h或24 h恒速静脉滴注,这2种给药方式的峰浓度(Cmax)及浓度-时间曲线下面积(AUC)的不同,可导致药物疗效及安全性的差异,肿瘤患者由于个体差异可选择不同的给药方式。本研究收集我院HD-MTX单药化疗NHL患者44例(共124例次化疗),比较6 h持续滴注和24 h持续滴注2种不同给药方式在血药浓度和毒副反应方面的差异,以探讨较佳的给药方式;并分析MTX延迟排泄与毒副反应的关系,以期根据血药浓度进行毒副反应预测,保证临床的安全使用。
1 资料与方法
1.1 病例资料 筛选范围:我院2010年1月—2014年12月经病理学检查确诊为非霍奇金淋巴瘤的患者。筛选条件:(1)至少完成一个疗程HDMTX单药化疗;(2)化疗前血常规、肝肾功能正常。入组病例根据持续静脉滴注时间不同分为6h给药组和24h给药组。
1.2 HD-MTX给药方式 6 h给药组方案:化疗前12 h水化(3000ml补液量)、碱化(使尿PH>8),HD-MTX化疗期间,72 h维持补液。MTX总量1/10在30 min内用完,余量在5.5 h内均匀静脉滴注。24 h给药组方案:化疗前及化疗期间补液同6 h组方案,MTX总量1/10在30 min内用完,其余MTX在23.5 h内均匀静脉滴注。CF解救方案:在MTX滴注结束后12 h开始静脉推注,第一次剂量为30 mg·m-2,随后 15 mg· m-2,Q6h,至 MTX 血药浓度<1×10-7mol· L-1。如果监测中发生延迟排泄(C24h> 0.4 μmol·L-1,C48h> 0.1 μmol·L-1),则加大CF解救剂量至血药浓度 <1×10-7mol· L-1。
1.3 MTX血药浓度的检测方法 采用高效液相色谱法,分别测定 MTX 滴注结束后0、12、18、24、48 h的血药浓度。色谱柱:BECKMAN C18预柱及分析柱(5 μm,4.6 mm ×15 mm);流动相:乙腈 -40 mol·L-1醋酸缓冲液(pH4.6)=11.1 ∶88.9(v/v);流速:l mL·min-1;检测波长:294 nm;柱温:室温。按方法项下的样品处理方法和色谱柱条件操作,测得MTX峰面积(Y)与MTX的浓度(X)的回归方程为:Y=3.275 8X -0.005 7(r=0.999 9),线性范围为0.04 ~1.6 mg·L-1,最低检测限为 0.04 mg·L-1,加样回收率为1.01%,RSD为2.29%。
1.4 MTX毒副反应评价标准 采用美国国立癌症研究所的常规毒性判定标准NCI-CTC3.0对每个疗程的毒副反应进行分级。本研究纳入主要毒性指标包括(1)骨髓抑制毒性:白细胞(WBC)、粒细胞(NE)、血红蛋白(HB)、血小板(PLT);(2)肝脏毒性:谷丙转氨酶(ALT)、谷草转氨酶(AST);(3)肾脏毒性:肌酐(Cr)。因本研究为回顾性分析,如粘膜毒性,胃肠道反应等观察性指标暂不列入统计分析。
1.5 统计学方法 MTX浓度描述采用平均数±标准差表示;6 h给药组、24 h给药组间MTX浓度比较采用t检验,毒副反应发生率的比较采用Pearson Chi-Square检验。所有数据均采用SPSS17.0软件分析,P<0.05为差异有统计学意义。
2 结果
2.1 病例资料 共筛选得到44例HD-MTX单药化疗患者,共124例次,化疗前患者血常规、肝肾功能正常,具体见表1。

表1 44例NHL患者的一般资料
2.2 MTX血药浓度比较 研究结果显示,6 h给药组MTX滴注结束后0 h、12 h的平均血药浓度明显高于24 h给药组 (P<0.05)。对于滴注结束后18 h、24 h的平均血药浓度,6 h给药组仍高于24 h给药组,但是差别无统计学意义。具体见表2。

表2 6、24 h给药组MTX血药浓度比较/μmol·L-1
2.3 毒副反应比较 研究结果表明,6 h给药组发生白细胞、中性粒细胞下降,谷丙转氨酶、谷草转氨酶升高的例次数均少于24 h组(P<0.05),见表3。
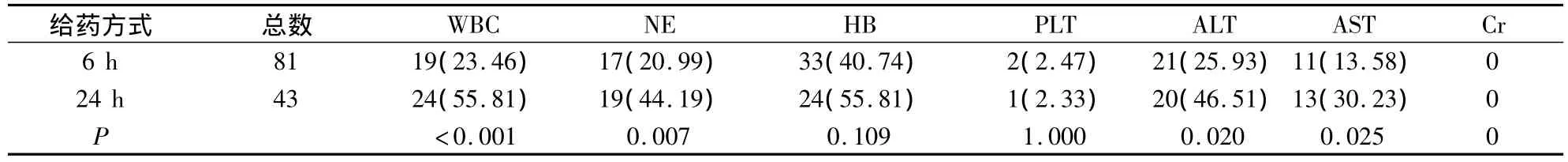
表3 6 h、24 h给药组毒副反应比较/例次(%)
2.4 延迟排泄与毒副反应关系
2.4.1 滴注结束24 h发生延迟排泄与毒副反应关系 6 h给药组滴注结束24 h血药浓度数据共55例次(缺失26例次),其中延迟排泄32例次,延迟排泄发生率58.18%,延迟排泄与非延迟排泄比较,发生谷丙转氨酶升高的例次数增加(P<0.05);24 h给药组滴注结束24 h血药浓度数据共39例次(缺失4例次),其中延迟排泄13例次,延迟排泄发生率33.33%,延迟排泄与非延迟排泄比较,毒性无统计学差异。见表4。
2.4.2 滴注结束48 h发生延迟排泄与毒副反应关系 6 h给药组滴注结束48 h的血药浓度数据共81例次,其中延迟排泄18例次,延迟排泄发生率22.22%,延迟排泄与非延迟排泄比较,发生血红蛋白下降例次数增加(P<0.05);24 h给药组滴注结束24 h的血药浓度数据共43例次,其中延迟排泄8例次,延迟排泄发生率18.60%,延迟排泄与非延迟排泄比较,发生白细胞、中性粒细胞下降,谷丙转氨酶、谷草转氨酶升高例次数增加(P<0.05)。见表5。
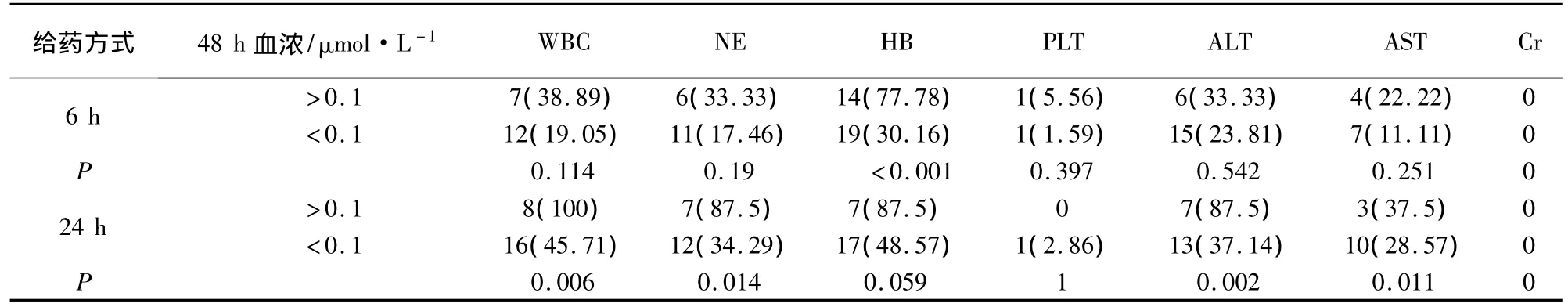
表5 滴注结束48 h发生延迟排泄与毒副反应关系/例次(%)
3 讨论
HD-MTX单药或者多药联合是治疗NHL的重要组成部分,比如SMILE方案(HD-MTX联合异环磷酰胺,依托泊苷,培门冬酶,地塞米松)治疗NK/T细胞淋巴瘤;ALL-BFM-95方案(HD-MTX联合巯嘌呤,地塞米松)治疗T淋巴母细胞淋巴瘤;Hyper-MA方案(HD-MTX联合阿糖胞苷)治疗非霍奇金淋巴瘤等。很多化疗药物会引起血液学毒性、肝肾毒性,而有些患者在化疗前就有骨髓抑制,肝肾功能受损的表现,为避免以上因素干扰,本研究以化疗前血常规、肝肾功能正常的HD-MTX单药化疗患者为研究对象。
HD-MTX一般是指应用比常规剂量大100倍(20 mg·kg-1或1 g)以上的剂量静脉滴注,一般当MTX细胞外浓度达到10-7mol·L-1以上的有效浓度时,就能使MTX穿透各种生理屏障(血脑屏障、血眼屏障、血睾屏障),进入常规剂量难以到达的庇护所。已有研究显示脑脊液MTX浓度与血清MTX浓度成正比[8],且脑脊液MTX浓度需大于10-6mol·L-1,即血药峰浓度(Cmax)需高于 6.0 ×10-5mol·L-1,才能达到中枢预防的目的[2-4]。本研究结果显示24 h给药组有25例次(58.14%)MTX静滴结束后0 h 血药浓度高于 6.0 ×10-5mol·L-1,而 6 h给药组MTX静滴结束后0h血药浓度全部高于6.0×10-5mol·L-1,对于 MTX 滴注结束后0 h、12 h 的平均血药浓度,6 h给药组显着高于24 h给药组(P<0.01),提示6 h给药较24 h给药能获得更高的脑脊液MTX浓度。
李亚军等[9]将可能影响Ⅲ~Ⅳ度血药学毒性和Ⅱ~Ⅳ度非血液学毒性发生的危险因素进行Logistic多重回归分析,结果表明HD-MTX联合其它化疗药物、24h给药是Ⅲ~Ⅳ度骨髓抑制发生的危险因素;24 h给药是Ⅱ~Ⅳ度非血液学毒性发生的危险因素,提示24 h持续静脉给药较6h持续静脉给药增加血液学及非血液学毒性。HD-MTX发生毒性反应的主要危险因素为组织对MTX的暴露时间而不是 MTX 的峰浓度[10]。Mikkelsen 等[11]研究证明,缩短MTX输注时间可缩短组织暴露于治疗浓度的时间。本研究结果也显示6 h给药组发生白细胞、中性粒细胞下降,谷丙转氨酶、谷草转氨酶升高毒性均小于24 h组(P<0.05),可能由于6 h给药组HD-MTX给药结束后48 h血药浓度降低至毒性域浓度之下速度较24 h给药组快,机体正常组织对MTX的暴露时间短于24 h给药组,使毒性明显降低。
90%MTX由肾脏排泄,大剂量时可代谢为对肾脏有毒性的7-羟基代谢物,肾损伤亦可见。但由于提前碱化、水化尿液等措施,肾毒性已罕见,少有表现为间质性肾损害、肾功能不全等。本研究两组肌酐升高毒性发生率均为0,进一步证实了上述观点。
甲氨蝶呤排泄延迟会明显增加不良反应的发生机率,加剧不良反应的严重程度,对于其毒性机理国外有研究表明甲氨蝶呤所致不良反应与其代谢产物7-OH-MTX有关[12]。本研究结果表明MTX发生延迟排泄,6 h和24 h给药组毒副反应均有不同程度升高。特别是滴注结束48 h,延迟排泄与毒副反应相关性更大。滴注结束24 h延迟排泄率较48 h高,但是毒副反应差异却比48 h低,提示目前所制定的48h延迟排泄阈值可能较低,有待进一步研究。
4 结论
6 h给药组较24 h给药组能获得更高的脑脊液MTX浓度,且白细胞、中性粒细胞下降,谷丙转氨酶、谷草转氨酶升高毒性均小于24 h组,提示6 h给药方式用于预防和治疗淋巴瘤中枢转移更有优势,由于本研究样本量较小,6 h给药组的优势还有待更多大样本的前瞻性临床试验证实。
MTX延迟排泄会加重毒副反应,使用过程中需密切监测血药浓度,根据血药浓度进行CF解救。不同患儿对MTX的消除情况表现出很大的个体差异,近年来通过血肌酐清除率[13]和药物基因组学[14]寻找MTX排泄延迟差异性的原因成为国内外学者研究的热点,希望能在化疗前预测个体的药动学特征,真正做到个体化给药。本课题组已开展MTX相关代谢酶单核苷酸基因多态性(如MDR1多药耐药基因)的研究,研究结果近期将在国内外期刊发表,为MTX在临床应用中表现出的显着个体差异提供基因组学的依据。
[1] 魏盈盈,焦溦溦,程 思,等.大剂量甲氨喋呤治疗儿童急性淋巴细胞白血病的血药浓度与不良反应的相关性[J].中国医院药学杂志,2014,34(22):1915 -1918.
[2] 周际昌.实用肿瘤内科学[M].2版.北京:人民卫生出版社,2002:99-103.
[3] Treon SP,Chabner BA.Concepts in use of high - dose methotrexate therapy[J].Clin Chem,1996,42(8):1322.
[4] Woessmann W,Seidemann K,Mann G,et al.The impact of the methotrexate administration schedule and dose in the treatment of children and adolescents with B-cell neoplasms:a report of the BFM Group Study NHL—BFM95[J].Blood,2005,105(3):948.
[5] 张华年.儿童急性淋巴细胞白血病大剂量甲氨蝶呤化疗中药物监测应注意的几个问题[J].儿科药学杂志,2010,16(2):61-63.
[6] 杨 雪,朱易萍.大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病[J].儿科药学杂志,2009,15(2):6 -9.
[7] 聂松柳,沈炳香,段自皞,等.甲氨蝶呤血药浓度与患者肝肾功能指标的相关性分析[J].安徽医药,2015,19(3):559 -562.
[8] Millot F,Rubie H,Mazingue F,et al.Cerebrospinal fluid drug levels of leukemic children receiving intravenous 5 g/m2methotrexate[J].Leuk Lymphoma,1994,14(1/2):141.
[9] 李亚军,姜文奇,李 苏,等.大剂量MTX不同给药方式治疗淋巴瘤的药效学及药代动力学研究[J].实用癌症杂志,2010,25(2):153-157.
[10] Rask C,Albertioni F,Bentzen SM,et a1.Clinical and pharmacokinetic risk factors for high-dose methotrexate-induced toxicity in children with acute lymphoblastic leukemia-a logistic regression analysis[J].Acta Oncol,1998,37(3):277 -284.
[11] Mikkelsen TS,Sparreboom A,Cheng C,et al.Shortening infusion time for high-dose methotrexate alters antileukemic effects:a randomized prospective clinical trial[J].J Clin Oncol,2011,29(13):1771-1778.
[12] Holmboe L,Andersen AM,Morkrid L,et al.High-dose methotrexate chemotherapy:pharmacokinetics,folate and toxicity in osteosarcoma patients[J].Br J Clin Pharmacol,2012,73(1):106 -114.
[13] Mao J,Zhang L,Shen H,et al.Creatinine clearance rate and serum creatinine concentration are related to delayed methotrexate elimination in children with Lymphoblastic malignancies[J].Neoplasma,2013,61(1):77 -82.
[14] Yang L,Hu X,Xu L.Impact of methylenetetrahydrofolate reductase(MTHFR)polymorphisms on methotrexate-induced toxicities in acute lymphoblastic leukemia:a meta-analysis[J].Tumor Biol,2012,33(5):1445 -1454.



