李萨萨,陶千山,蒲莲芳,李迎伟,翟志敏
(安徽医科大学第二附属医院血液内科,安徽 合肥 230601)
超小剂量地西他滨治疗骨髓增生异常综合征的近期疗效和不良反应观察
李萨萨,陶千山,蒲莲芳,李迎伟,翟志敏
(安徽医科大学第二附属医院血液内科,安徽 合肥230601)
摘要:目的分析超小剂量地西他滨方案在治疗骨髓增生异常综合征(MDS)患者中的近期临床疗效和不良反应。方法接受地西他滨治疗的中危-1组MDS患者19例,其中9例接受地西他滨15mg·m-2,每周1次,共3周为一疗程的治疗方案;10例接受地西他滨7mg·m-2,每周1次,共3周为一疗程的治疗方案(简称15mg和7mg组)。比较两组之间的总反应率和不良反应发生率。结果19例中危-1组MDS患者经过地西他滨治疗后,1例获完全缓解(CR),7例获血液学改善(HI),11例病情稳定(SD),总反应率42%。其中,地西他滨15mg组、7mg组患者的总反应率分别为44%、40%,两组疗效比较差异无统计学意义(P>0.05)。本研究中地西他滨治疗的主要不良反应为骨髓抑制所致的感染和出血,两组患者感染发生率分别为11%和0%,Ⅲ′~Ⅳ′级血液学不良反应发生率分别为44%、10%,同时15mg组治疗期间分别平均输注红细胞2.2U和血小板1.3U;7mg组治疗期间分别平均输注红细胞0.2U和血小板0.2U,比较两组患者血液学不良反应、平均血小板输注量差异均有统计学意义(P<0.05);两组患者在应用地西他滨治疗后三系均有所提高,其中血红蛋白改善明显(P<0.05)。结论超小剂量地西他滨治疗方案在中危-1组MDS患者中安全有效,而且其感染及血液学不良反应发生率低,耐受性好,提示可在临床进一步推广。
关键词:骨髓增生异常综合征;地西他滨;治疗结果
骨髓增生异常综合征[1](MDS)是一组起源于造血干细胞,以血细胞病态造血为特征的异质性疾病。其基本临床特征是骨髓中造血细胞有发育异常的形态学表现和外周血三系血细胞减少,以及高风险向急性髓系白血病(AML)转变。MDS患者自然病程和预后的差异性很大。随着肿瘤表观遗传学深入研究,DNA的异常甲基化被认为在MDS的发生和发展中起着重要作用,因此去甲基化药物地西他滨成为MDS患者的治疗新选择,但其治疗方案及用药剂量仍未有统一标准,其最佳剂量仍在研究探讨中。本研究即针对该问题,期望通过改变地西他滨剂量、给药间隔,探讨能否在保证疗效的基础上,最大限度减少不良反应,提高患者的耐受性和依从性。
1资料与方法
1.1临床资料收集2014年7月至2015年9月期间,安徽医科大学第二附属医院血液内科收治的19例接受地西他滨治疗的MDS患者,所有患者根据细胞形态学、免疫学、遗传学、分子生物学等检查确诊,诊断标准和分型标准符合文献[2]。其中15例为难治性血细胞减少伴多系病态造血(MDS-RCMD),1例难治性贫血伴单系病态造血(MDS-RA),3例难治性贫血伴原始细胞增-1(MDS-RAEBI-1),依据国际预后积分系统(IPSS)进行危险度分层,19例患者均为中危-1组(13例初治,6例复治),其中6例复治患者在接受地西他滨治疗前,4例接受1个疗程的CAG方案治疗(阿克拉霉素+阿糖胞苷+粒细胞刺激因子),2例接受1个疗程的HAG方案治疗(高三尖酯碱+阿糖胞苷+粒细胞刺激因子),同时辅以复方皂矾丸、十一酸睾酮、利可君等刺激造血以及输注红细胞改善贫血症状等的药物,评估疗效均为疾病稳定。具体临床资料见表1。本研究经安徽医科大学第二附属医院医学伦理委员会批准,患者均签署知情同意书。
1.2治疗方法19例患者均知情同意后应用地西他滨,一组患者地西他滨每周用药1次,剂量为15mg·m-2,连续静脉输注3h,连续用药3周为1个疗程,每位患者至少连续用药2个疗程,每个疗程期间间隔3周。若患者在应用地西他滨期间出现自发口腔、鼻腔出血以及皮肤瘀点瘀斑,体温超过38.5 ℃等,则延迟后续用药时间,待患者的血象有所恢复,同时出血、发热等症状得到稳定控制再开始用药。9例患者中,有4例患者均在第1疗程第二次地西他滨治疗后骨髓抑制推迟6~10d给药。另一组患者地西他滨治疗方法同第一组,但地西他滨剂量减为7mg·m-2,连续3周为1个疗程。10例患者中,有1例患者在第2疗程第一次地西他滨治疗后,血小板下降明显,推迟5d给药。治疗期间根据患者血象情况酌情输注单采血小板及红细胞悬液,若中性粒细胞小于0.5×109L-1,给予重组人粒细胞集落刺激因子(G-CSF)应用。
1.3疗效和不良反应评价标准MDS疗效评估参考IWG疗效标准[2],将完全缓解、部分缓解和血液学改善作为有效病例。总有效率为=(完全缓解+部分缓解+血液学改善)/总例数×100%。由于本研究中19例中危-1 组MDS患者在接受地西他滨治疗前已存在血液学异常,故评判血液学毒性标准无法参照CTCAE(常见不良反应事件评价标准),故在本研究中评判血液学不良反应标准为:Ⅰ′级:三系有所提高,其中血红蛋白改善明显(P<0.05)。
1.4统计学方法采用SPSS17.0进行统计分析,分类变量采用χ2检验,数值变量采用t检验,P<0.05为差异有统计学意义。
2结果
2.1临床疗效19例中危-1组MDS患者,完全缓解(CR)1例,血液学改善(HI)7例,疾病稳定(SD)11例,总反应率(ORR,即CR+PR+HI)为42%。 15mg组9例患者,4例HI,5例SD,总反应率为44%;7mg组10例患者,1例CR,3例HI,6例SD,总反应率为40%,两组比较疗效差异无统计学意义(P>0.05),见表2。两组患者经过地西他滨治疗后三系有所提高,其中血红蛋白改善明显(P<0.05),见表3。

表1 19例MDS患者的临床基本资料
注:两组性别、年龄、分型差异均无统计学意义(P>0.05)。
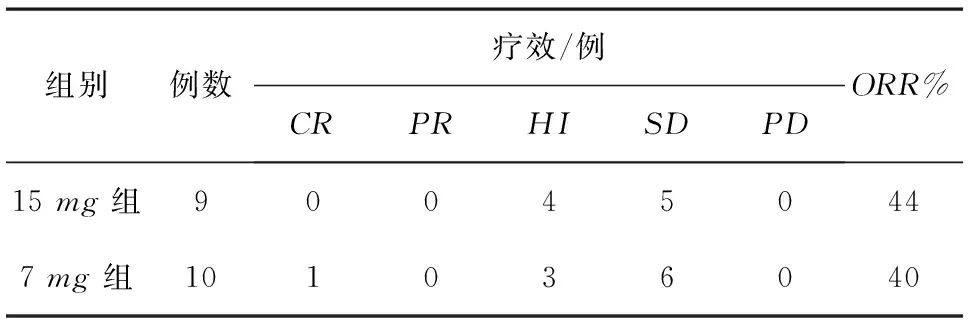
表2 19例MDS患者的疗效观察
注:CR:完全缓注:PR:部分缓解;HI:血液学改善;SD:无进展;PD:疾病进展;ORR:总反应率。两组疗效比较,P>0.05。
2.2不良反应
2.2.1血液学毒性19例中危-1组MDS患者在治疗过程中均出现不同程度的血液学毒性(主要表现为中性粒细胞及血小板减少)。其中15mg组,1例Ⅰ′级血液不良反应,4例Ⅱ′级血液学不良反应,4例Ⅲ′级血液学不良反应;7mg组,6例Ⅰ′级血液学不良反应,3例Ⅱ′级血液学不良反应,1例Ⅲ′级血液学不良反应。19例患者中,14例按期完成治疗,4例因第1疗程第二次地西他滨之后骨髓抑制推迟8(6~10)d用药,1例因第2疗程第一次地西他滨治疗后血小板下降推迟5d用药。
2.2.2感染15mg组,1例患者在第1疗程第二次地西他滨用药后出现肺部感染,经过抗感染、皮下注射粒细胞集落刺激因子(G-CSF)、输注红细胞及新鲜血小板等治疗后好转;7mg组,无1例患者在地西他滨治疗过程中出现发热等感染情况。
2.2.3其他不良反应本研究所有患者均未出现药物过敏反应,1例患者出现轻度胃肠道反应,给予对症处理后好转,无治疗相关死亡患者,两组患者不良反应发生情况及支持治疗见表4。
3讨论
MDS主张分层治疗,相对高危组MDS患者,易转化为AML,需要高强度治疗,包括化疗和造血干细胞移植,罗贤生等[3]采用CAG方案(即阿克拉霉素+阿糖胞苷+粒细胞刺激因子)诱导治疗相关性急性髓系白血病13例,2个疗程后,9例患者获得CR。然而MDS患者多以中老年人居多,可能存在高龄、免疫力低下、脏器功能不全等相关因素,难以耐受标准剂量地西他滨、大剂量化疗及骨髓造血干细胞移植[4-5]。因此对于中危-1组MDS患者的治疗,虽然其治疗方案尚不统一,但是其治疗目标是改善造血、提高生活质量,故本研究入组中危-1的MDS患者,均采用超小剂量地西他滨治疗方案。
通常,DNA甲基化异常被认为是细胞恶性转化的早期特征,表现为特殊基因的高甲基化和总体基因组的低甲基化,这种异常修饰往往引起抑癌基因的失活和其他关键基因的突变,从而促进肿瘤的发生发展[6]。近年研究发现,DNA甲基化是MDS患者中普遍存在的一种现象,尤其是P15基因、P16基因、降钙素(CT)基因以及紧密连接蛋白-1(ZO-1)基因等高度甲基化与MDS的发生发展具有重要关系[7]。去甲基化药物地西他滨是特异性的DNA甲基化转移酶抑制剂(DNMTIs),其可通过抑制DNA甲基化转移酶使抑癌基因恢复正常的去甲基化状态,并诱导肿瘤细胞向正常细胞分化或诱导肿瘤细胞凋亡[8]。地西他滨于2006年经美国FDA批准用于MDS患者,并于2008年9月28日批准在我国开展临床应用,目前主要用于IPSS评分中的中危、高危MDS,复发、难治MDS以及MDS转化的AML患者。地西他滨自上市以来,促进了MDS治疗的进展,其可延长MDS患者向白血病转化及死亡中位时间,改善预后[9],是中高危MDS患者选择化疗的较理想选择。
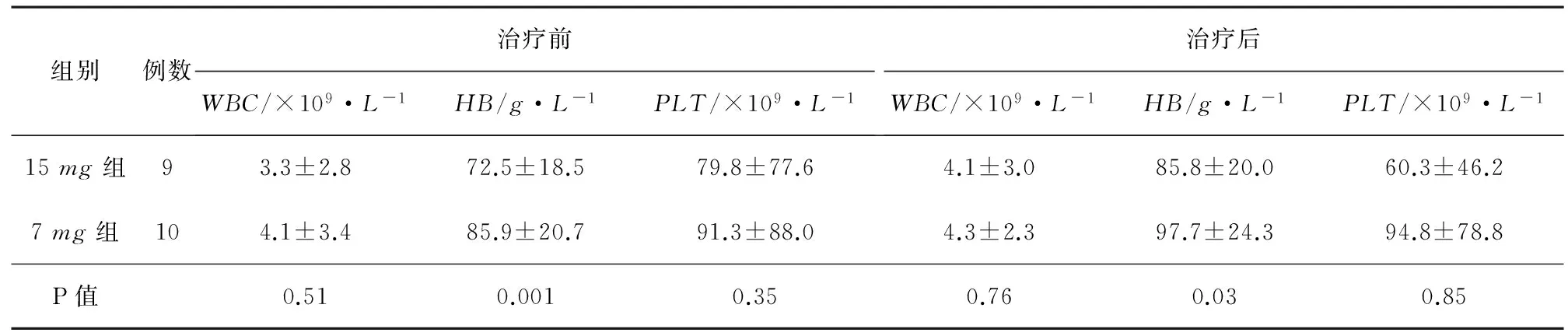
表3 19例MDS患者治疗前后的三系情况
注:两组患者经过地西他滨治疗后血红蛋白分别较治疗前明显提升。
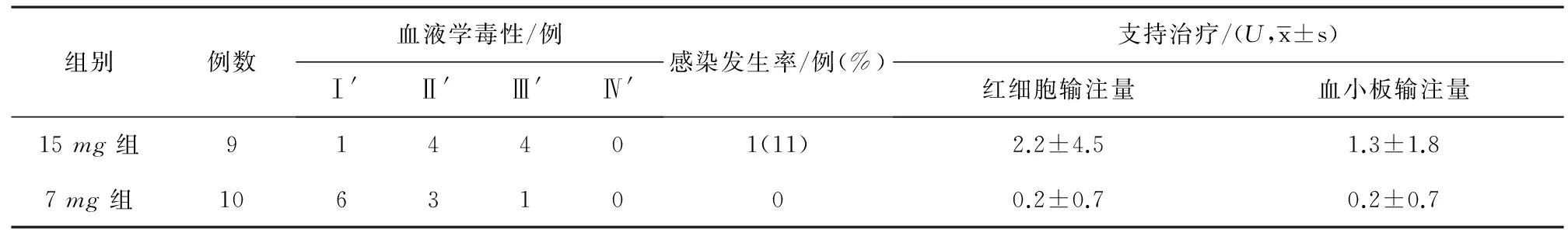
表4 19例MDS患者的不良反应及支持治疗情况
注 :两组比较:感染发生率、红细胞输注量,P>0.05;血液学不良反应、血小板输注量,P<0.05。
然而由于地西他滨的去甲基化具有独特的双重作用机制[10],低浓度引起DNA甲基化,恢复沉默基因的表达引起促进细胞分化,高浓度则具有细胞毒作用。对地西他滨而言,2006年,美国一项有关地西他滨的Ⅲ期临床试验中纳入89例MDS患者应用15mg·m-2地西他滨治疗(静滴q8h,连续3d,每6周重复),结果显示,89例患者获得了17%的总反应率(ORR),并且与支持治疗组(7.8个月)相比显着延长了MDS患者向白血病转化的时间(12.1个月)。然而,该研究中四个疗程后3~4级粒细胞减少、血小板减少以及贫血等严重不良反应总发生率高达69%,致使35%的患者曾延迟给药[9]。后来,2006年美国FDA批准地西他滨用于治疗MDS推荐方案为地西他滨20mg·m-2,连续5d为一疗程,每4周重复。其后有研究分析了122例使用该地西他滨方案治疗MDS患者的数据,结果发现由于地西他滨严重的血液学毒性,使得实际临床应用过程中有53%的患者需要减低剂量,有至少25%的患者需要延迟给药。这其中,35例患者(29%)在获得良好的客观反应后进行了减量或延迟给药,30例患者(25%)在获得良好的客观反应前进行了减量或延迟给药,57例患者(54%)没有进行减量或延迟给药[11]。故由此可见,标准剂量地西他滨方案治疗MDS虽有一定成效,但其血液学毒性大,治疗过程中存在极大出血、感染等相关风险。为进一步降低药物不良反应,2014年,国内一项多中心临床试验回顾性分析了79例(包括53例为中危-2或高危)MDS患者接受减少剂量地西他滨方案(15mg·m-2静滴qd,连续5d,每4周重复)的疗效性和安全性。结果发现,该方案ORR为67.1%,但3~4级中性粒细胞减少发生率为70.9%,血小板减少发生率为67.1%,40.5%的患者因发生4级血液学毒性而推迟用药[12]。
由此可见减低剂量地西他滨仍存在一定的程度的血液学毒性,对于一些MDS患者来说,尤其是本可以通过定期输血等保守治疗维持良好生活质量的患者,可能有些得不偿失。因此,本研究首先采用地西他滨15mg·m-2,每周1次,共3次的治疗方案治疗9例中危-1MDS患者,结果提示9例患者,有效率44%,Ⅲ′~Ⅳ′级血液学不良发生率为44%,感染发生率仅为11%,治疗期间平均输注红细胞2.2U,平均输注血小板1.3U,其不良反应轻微,经对症支持治疗后患者均可耐受。进而,我们在地西他滨15mg的治疗基础上再次减低剂量为7mg,结果显示10例患者,有效率40%,Ⅲ′~Ⅳ′级血液学不良反应发生率10%,同时无一例患者在治疗过程中发生感染等情况,治疗期间平均输注红细胞0.2U,平均输注血小板0.2U,也进一步降低了患者的输血依赖。从本研究发现两组超小剂量地西他滨治疗方案极大地降低了地西他滨的血液学不良反应,以及感染的发生风险和对输血的依赖程度,显着改善了患者的生存质量。
初步研究表明,超小剂量地西他滨治疗中危-1组MDS患者,血液学不良反应及感染发生率低,值得在中危-1组MDS患者中进一步临床推广,而对于中危-2及高危组MDS患者来说,由于其高风险向AML转化,预后不佳,需积极在去甲基化药物的基础上联合化疗。
参考文献
[1]黄晓军.血液病学 [M].2版.北京:人民卫生出版社,2011:882-889.
[2]张之南,沈悌.血液病诊断及疗效标准[M].北京:科学出版社,2007:232-235.
[3]罗贤生,王智明,黄海妹,等.CAG方案用于治疗相关性急性髓系白血病诱导化疗的的临床观察 [J].安徽医药,2015,19(2):345-347.
[4]骨髓增生异常综合症诊断与治疗中国专家共识(2014年版) [J].中华血液学杂志,2014,35(11):1042-1048.
[5]邵宗鸿.中高危骨髓增生异常综合症的治疗选择[J].中华血液学杂志,2012,33(7):508-509.
[6]MummaneniP,ShordSS.Epigeneticsandoncology[J].Pharmacotherapy,2014,34(5):495-505.
[7]AdesL,SantiniV.HypomethylatingagentsandchemotherapyinMDS[J].Bestpractice&researchClinicalhaematology,2013,26(4):411-419.
[8]HackansonB,DaskalakisM.RecentresultsincancerresearchFortschrittederKrebsforschungProgresdanslesrecherchessurlecancer[J].Decitabine,2014,201:269-297.
[9]KantarjianH,IssaJP,RosenfeldCS,etal.Decitabineimprovespatientoutcomesinmyelodysplasticsyndromes:resultsofaphaseⅢrandomizedstudy[J].Cancer,2006,106(8):1794-1803.
[10]BorthakurG,AhdabSE,RavandiF,etal.Activityofdecitabineinpatientswithmyelodysplasticsyndromepreviouslytreatedwithazacitidine[J].Leukemia&Lymphoma,2008,49(4):690-695.
[11]GhanemH,CornelisonAM,Garcia-ManeroG,etal.Decitabinecanbesafelyreducedafterachievementofbestobjectiveresponseinpatientswithmyelodysplasticsyndrome[J].Clinicallymphoma,myeloma&leukemia,2013,13(Suppl2):S289-S294.
[12]LiX,SongQ,ChenY,etal.DecitabineofreduceddosageinChinesepatientswithmyelodysplasticsyndrome:aretrospectiveanalysis[J].PloSone,2014,9(4):e95473.
Ashort-termclinicalefficacyofultrasmalldoseofdecitabineinthetreatmentofpatientswithmyelodysplasticsyndrome
LISa-sa,TAOQian-shan,PULian-fang,etal
(Department of Hematology,The Second Affiliated Hospital of Anhui Medical University,Hefei,Anhui230601,China)
Abstract:ObjectiveThepurposeofthisstudyistoobservetheclinicalsafetyandefficacyofultrasmalldoseofdecitabineinthetreatmentofpatientswithmyelodysplasticsyndrome(MDS).Methods19patientswithintermediate-risk-1MDSwereinvolvedinthisstudy,with9casestreatedwithdecitabine,15mg·m-2,intravenousdrip3hours,onceaweek,threeweeksacourseand10casestreatedwithdecitabine,7mg·m-2,intravenousdrip3hours,onceaweek,threeweeksacourse.Theoverallresponserate(ORR)andtheadverseeffectrateofthetwogroupswererecorded.ResultsAfterthetreatmentofdecitabine,1caseachievedcompleteremission(CR),7casesachievedhematologicimprovement(HI),11casesachievedstabledisease(SD),andORRinallintermediate-risk-1MDSpatientswere42%.TheORRinthegrouptreatedwithdecitabineatadoseof15mg·m-2was44%whiletheothergroupwas40%.Therewerenostatisticallysignificantdifferencesbetweenthem(P>0.05).Adverseeventsofinfectionandbleedingweremainlycausedbydecitabineinthisstudy.GradeⅢ′toⅣ′hematologicaltoxicitieswereobservedin19cases,infectionratesoftwogroupswere11%and0%respectively,GradeⅢ′toⅣ′hematologicaltoxicitieswere44%and10%respectively,andtheaverageamountoftransfusedredbloodcellsandplateletwere2.2Uand1.3Urespectively,whileintheothergroup,theaverageamountoftransfusedredbloodcellsandplateletwere0.2uand0.2Urespectively.Therewerestatisticallysignificantdifferences(P<0.05)intermsofhematologicaltoxicitiesandplatelettransfusion.Thehemogramindexeswereallimprovedafterthetreatmentofdecitabine,andthehemoglobinwereimprovedsignificantly(P<0.05).ConclusionsThisstudyfoundthattreatingintermediate-risk-1MDSwithultrasmalldoseofdecitabinewassafeandeffective,anditmeritsfurtherpromotionincliniconaccountofthelowrateofinfectionandhematologicaltoxicities.
Keywords:Myelodysplasticsyndromes;Decitabin;Treatmentoutcome
基金项目:国家自然科学基金(81402193)
作者简介:李萨萨,女,硕士研究生 通信作者:翟志敏,女,教授,博士生导师,研究方向:血液肿瘤的诊断与治疗,E-mail:zzzm889@163.com
doi:10.3969/j.issn.1009-6469.2016.06.045
(收稿日期:2016-03-01,修回日期:2016-03-29)



