高其宏
(芜湖市第二人民医院胃肠外科,安徽 芜湖 241000)
大肠癌在临床上是一种常见的肠道恶性肿瘤,且近年来发病率有着逐渐增高的趋势。手术切除和术后的放、化疗及综合免疫治疗等,是大肠癌当前最主流的也是最有效的治疗方法。对于早期大肠癌手术切除后,治疗效果明显,生存期明显延长,但对于中晚期大肠癌术后出现转移及复发的概率明显增加。肿瘤转移的途径主要有淋巴结转移,血运转移及局部侵袭、浸润转移等[1]。Eph受体酪氨酸激酶A2(erythropoietin-produceing hepatocellular A2,EphA2)是促进新生血管形成最主要的因子,在肿瘤发生发展中起着重要的促进作用[2]。而金属蛋白酶-2(MMP-2)作为金属蛋白酶(MMPs)家族重要成员之一,本身是一种明胶酶,它的主要作用就是破肿瘤细胞周围的基质和基膜,从而使肿瘤细胞能够更容易的进行侵袭和转移[3]。关于EphA2和MMP-2在大肠癌的发生发展中到底扮演何种角色,研究的不甚清楚。本文通过免疫组织化学法联合检测EphA2蛋白和MMP-2蛋白在大肠癌及癌旁组织中的表达,探讨其在大肠癌发生、发展中的作用。
1 资料与方法
1.1 标本及分组
(1)大肠癌组织:选取芜湖市第二人民医院2011年1月—2016年12月大肠癌手术切除后石蜡包埋标本76例,其中男性患者44例,女性患者32例,年龄区间为34~82岁,中位年龄57.6岁。且要求所有患者术前均未接受对于肿瘤的针对性治疗。其中高分化(包括高级别上皮类瘤变)癌3例,中分化癌45例,低分化(包括黏液腺癌、印戒细胞癌)癌28例。有无淋巴结转移51/25例。
(2)癌旁组织:在相应的76例大肠癌标本中,取距肿瘤3 cm以上病理检查未受到肿瘤侵犯的大肠组织。
1.2 试剂
MMP-2为鼠抗人单克隆抗体,EphA2为兔抗人多克隆抗体,两者均购自北京中杉金桥生物工程有限公司;枸橼酸缓冲液及DAB显色剂均购自福州迈新生物制剂有限公司;双氧水、微波炉等均来自本院病理科。
1.3 试验方法
将选中蜡块按4 mm间距连续切片,切片常规进行HE染色和免疫组化染色,光镜下观察。免疫组织化学法主要分为几步:(1)双氧水行内源酶灭活,(2)抗原修复液修复抗原,(3)滴加一抗,(4)滴加二抗,(5)滴加链霉素抗生物素过氧化物酶,(6) DAB显色,(7)苏木素复染,(8)脱水/透明/封片,显微镜观察。
1.4 结果判断
EphA2和MMP-2蛋白免疫组化阳性表达均是在细胞质内出现棕黄色染色。用半定积分法(即染色强度得分与阳性细胞百分率得分之和)判断两者表达强度。染色强度的评分标准:胞质未着色为0分,着淡黄色为1分,中等黄色为2分,深黄及褐色为3分。阳性细胞百分率的评判标准:随机选取5个不重复高倍镜视野,通过计算每个视野100个细胞中阳性细胞所占比例,得出此切片的平均阳性细胞百分率。平均阳性细胞百分率≤5%为0分,6%~25%为1分,26%~49%为2分,>49%为3分。两项得分之和,0~1分为(-),2分为(+),3~4分为(++),5~6分为(+++),2~6分均表示为阳性。
1.5 统计学方法
应用SPSS21.0统计软件分析包近代数据分析。观测数据主要为计数资料,其中部分为等级数据,其它均为两分类数据,故组间比较统一采用秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 EphA2和MMP-2在大肠癌、癌旁组织中的表达情况
大肠癌组织中EphA2蛋白表达阳性率为92.10%(70/76),显着高于癌旁组织26.31%(20/76)、(P<0.05)。其中,EphA2中度阳性表达率和强阳性表达率分别为27.63%(21/76)及25%(19/76),均显着高于癌旁组织的表达率(7.89%)、(5.26%),见图1、图2。MMP-2在大肠癌组织中阳性表达率为80.20%(61/76),同样显着高于癌旁组织15.90%(12/76),(P<0.05);其中大肠癌组织中中度阳性表达率和强阳性表达率分别为13.16%(10/76)、25%(19/76),均显着高于癌旁组织的中度阳性及强阳性表达率(2.6%,2.6%),见图3、图4。
2.2 EphA2与MMP-2的表达与临床病理特征的关系
大肠癌组织中的EphA2蛋白的表达强度较高,且EphA2蛋白表达水平与大肠癌组织分化程度、Dukes分期、淋巴结转移、年龄多有密切关联(部分比较为P<0.05);MMP-2蛋白在大肠癌组织中同样呈高表达,其表达情况与大肠癌组织学分化程度、Dukes分期、淋巴结转移、年龄也有较密切的关联(部分比较为P<0.05),见表1、表2。
3 讨论
肿瘤组织发生、发展有赖于新生血管的形成为其提供营养,EphA2是Eph家族中EphA亚家族的一个成员,是促进新生血管形成最主要的因子之一。有研究显示EphA2通过血管生成拟态(vasculogenic mimicry,VM)模式,促进肿瘤毛细血管网不断壮大,从而参与肿瘤的生长过程[4]。有研究显示组织中EphA2表达程度与毛细血管的形成呈正相关,而肿瘤组织只要大于1 mm就会有毛细血管形成,因此EphA2在很多实体肿瘤中呈高表达状态。

表1 两种组织中EphA2和MMP-2的表达情况及比较/例
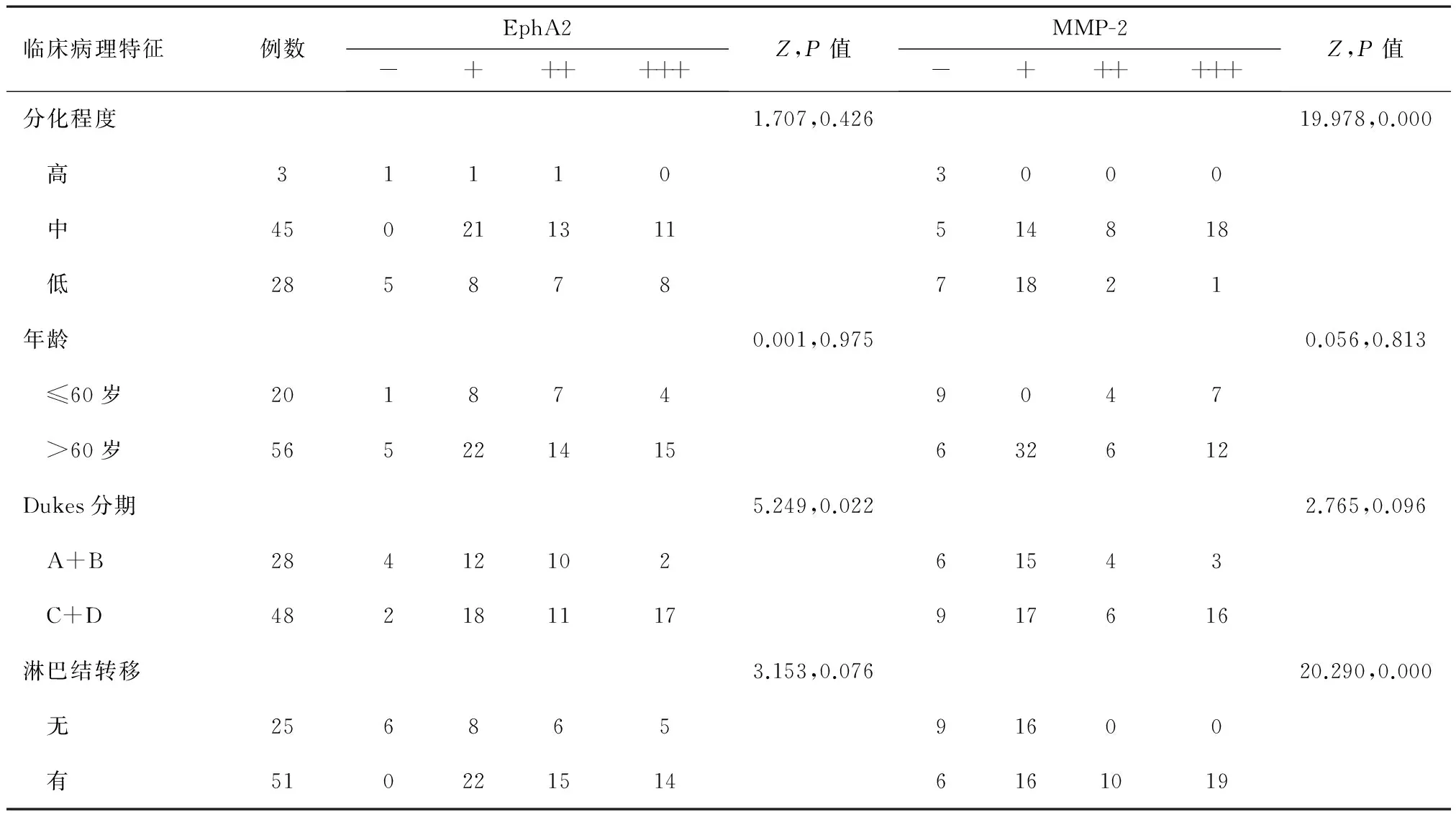
表2 大肠癌中EphA2和MMP-2的表达与各临床病理特征之间的关系/例
有观点认为EphA2调节血管生成的机制主要是通过与其配体EphrinA1的结合影响肿瘤血管内皮细胞的迁移,并通过影响细胞骨架,基质黏附和细胞黏附。从而促进组织和内皮细胞形成毛细血管样结构的形成、调控血管生成[5]。由此可见EphA2主要是通过促进肿瘤新生血管形成来参与恶性肿瘤的发生发展。局部浸润及淋巴转移、血性转移是恶性肿瘤复发及远处转移的主要方式,它们直接影响着患者的预后,而肿瘤新生血管的形成直接参与了上述三大过程,因此必然是肿瘤发生、发展的重要一环[6]。本研究表明,EphA2蛋白在大肠癌组织中表达水平显着高于癌旁组织 (P<0.001),且与大肠癌的Dukes分期明显相关(P<0.05),依此结果推断EphA2可能在Dukes分期较晚的肠癌患者中促进了大肠癌新生血管的形成,进而导致了大肠癌的发展,并且影响大肠癌出现淋巴结转移。
MMPs是一个含有9种酶蛋白分子的家族,它们主要通过破坏肿瘤组织周围细胞基质和基底膜,从而使肿瘤细胞进行更加容易的在局部进行浸润转移[7]。细胞基质和基底膜的主要构成蛋白则是Ⅳ型胶原和层黏连蛋白,而MMP-2本身是一种明胶酶,它是降解Ⅳ型胶原三螺旋结构的主要蛋白酶,因此它可能就肿瘤局部浸润的始动因素[8]。近年来不断有研究显示MMP-2在一些肿瘤的局部浸润转移中发挥着相当重要的作用[9]。本研究表明,大肠癌中MMP-2的表达水平明显高于癌旁组织(P<0.001)。且与大肠癌组织学分化程度、淋巴结转移明显相关(P<0.05)。依此结果推断MMP-2可能在组织分化程度不佳的病人中参与了大肠癌的侵袭、浸润,并较早较快的出现淋巴结转移,最终导致了大肠癌Dukes分期变晚,预后变差。
EphA2及MMP-2在大肠癌的发生发展中均可能起到了积极地促进作用,因此在临床上我们可以考虑通过联合检测EphA2、 MMP-2表达水平来判断大肠癌的恶性程度,以及预判患者的预后情况。另外我们也可以通过研究EphA2和MMP-2的作用机制,使它们成为靶向治疗的新方向。另外两者之间是否存在相互促进的因素,从而加快了大肠癌的进程,它们是否还有其它的作用机制未被我们发现,值得我们去进一步研究。
(本文图1~4见插图5-2)
[1] 所剑.日本《大肠癌治疗指南(2014年版)》解读[J].中国实用外科杂志,2016,36(1):84-92.
[2] OBAYEMI JD,HU J,UZONWANNE VO,et al.Adhesion of ligand-conjugated biosynthesized magnetite nanoparticles to triple negative breast cancer cells[J].J Mech Behav Biomed Mater,2017,68:276-286.
[3] LEE H,LEE J,SOHN I,et al.To Excavate Biomarkers Predictive of the Response for Capecitabine plus RAD001 through Nanostring-Based Multigene Assay in Advanced Gastric Cancer Patients[J].Journal of Cancer,2016,7(15):2173-2178.
[4] CHITRAMUTHU B,BATEMAN A.Progranulin and the receptor tyrosine kinase EphA2,partners in crime[J].J Cell Biol,2016,215(5):603-605.
[5] SU J,JI XB,XIE JH,et al.Expressions of angiogenesis-related factors:CD105,EphA2 and EphrinA1 in laryngeal squamous cell carcinoma and clinical implication[J].Chinese Journal of Otorhinolaryngology Head and Neck Surgery,2016,51(12):929-936.
[6] SCHINNER E,WETZL V,SCHRAMM A,et al.Inhibition of the TGFβ signalling pathway by cGMP and cGMP-dependent kinase I in renal fibrosis[J].FEBS Open Bio,2017,7(4):550-561.
[7] TANG J,QIN Z,HAN P,et al.High Annexin A5 expression promotes tumor progression and poor prognosis in renal cell carcinoma[J].Int J Oncol,2017,50(5):1839-1847.
[8] BACHTIAR E W,AMIR L R,SUHARDI P,et al.Scaffold degradation during bone tissue reconstruction inMacaca nemestrinamandible[J].Interventional Medicine and Applied Science,2016,8(2):77-81.
[9] Yuan Z,Wang L,Zi Y,et al.Oridonin effectively reverses the drug resistance of cisplatin involving induction of cell apoptosis and inhibition of MMPs expression in human acute myeloid leukemia cells[J].Saudi Journal of Biological Sciences,2017,24(3):678.



