曹娟,黄书才,戴媛媛,蔡昌群,宋传福,夏仲
阿立哌唑属第二代抗精神病药物,是目前临床上治疗精神分裂症的一线药物之一。与其它抗精神病药物的作用机制不同,阿立哌唑可以部分激动多巴胺(DA)D2受体和5-羟色胺(5-HT)1A受体,又被称作DA系统稳定剂[1-2]。临床研究表明阿立哌唑不但对精神病性症状具有较好的疗效,而且很少引起锥体外系症状(EPS)[3-6]。美国FDA批准的阿立哌唑的药物说明书中指出短期安慰剂对照试验中,阿立哌唑治疗者报道的EPS发生率为6%,而安慰剂为6%,没有显示出阿立哌唑和安慰剂之间存在差异[3]。但是在临床实践当中,我们发现阿立哌唑所致的EPS并不少见。因此本研究采用回顾性研究的方法,对精神分裂症病人临床治疗中阿立哌唑所致EPS的发生率及影响因素作如下探讨。
1 资料与方法
1.1一般资料以2014年3月至2018年12月于芜湖市第四人民医院住院治疗的精神分裂症病人作为研究对象。共纳入309例(男性125例,女性184例)病人的资料进行研究分析。病人接受治疗前已签署知情同意书,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2纳入标准(1)病人符合《美国精神障碍诊断与统计手册》第5版(DSM-5)中精神分裂症的诊断标准;(2)18~65岁;(3)住院期间单独服用阿立哌唑治疗;(4)病人资料中病史及病程记录详细且有副反应量表(TESS)评估。
1.3排除标准(1)在服用阿立哌唑前就已经存在EPS;(2)病人在EPS出现前合并使用其他抗精神病药物、抗抑郁、心境稳定剂、苯二氮 类药物及抗胆碱能药物;(3)病人存在明确的心血管、内分泌及神经系统躯体疾病史。
1.4包含症状本研究中EPS的包含症状有(1)急性肌张力障碍;(2)静坐不能;(3)类帕金森综合征;(4)迟发型运动障碍。本研究中发生EPS的评判标准:(1)病程记录中具有明确的EPS症状和体征记录;(2)TESS量表神经系统及第33项评分在轻度以上。
1.5方法首先筛查单独服用阿立哌唑治疗的精神分裂症病人的病历资料,查阅病人入院记录中一般人口学资料、现病史、既往史、体格检查、首日TESS评估情况及三级查房诊断。根据入排标准,评估纳入病人病历资料中的一般人口学特征、临床特征及用药情况等,如性别、年龄、体质量、精神分裂症总病程及是否首发、用药时间、药物剂量、药物厂家及住院时长等。
1.6统计学方法采用SPSS 20.0进行统计学分析。部分定量资料不符合正态分布,故进行Mann-Whiteny U非参数检验,其它正态资料采用两独立样本的t检验。定性资料进行χ2检验,二分类logistic回归分析比较EPS与其影响因素之间的关系。均采用双侧检验,检验水准为α=0.05。
2 结果
2.1EPS发生率309例单独服用阿立哌唑的精神分裂症病人的最短住院时间为23 d,最长住院时间为68月,其中有55例出现EPS,EPS的发生率为17.80%,女性病人发生率为15.76%(29/184),男性病人发生率为20.8%(26/125)。其中,38例病人出现类帕金森综合征,16例病人出现静坐不能,1例病人出现急性肌张力障碍,并未发现住院期间出现迟发型运动障碍的病人。
2.2出现EPS病人的临床特征分析精神分裂症病人单独服用阿立哌唑后EPS发生率性别差异无统计学意义(P>0.05),但男性病人出现EPS时的服药剂量(22.77±5.04)mg显着高于女性病人出现EPS时的服药剂量(17.17±3.79)mg(Z=3.12,P<0.01)。
出现EPS的病人的年龄及病程要显着低于未出现EPS的病人(P<0.05);出现EPS病人的最大服药剂量及每公斤体质量最大服药剂量要显着高于未出现EPS的病人(P<0.05);在初始服药剂量方面,出现EPS病人组与未出现EPS病人组之间差异无统计学意义(P>0.05)。见表1。
2.3出现EPS的季节性差异分析将病人的服药时间根据月份及当时的气温记录划分为春、夏、秋、冬四季,结果发现夏季服药病人EPS的发生率显着高于其它3个季节。见表2。
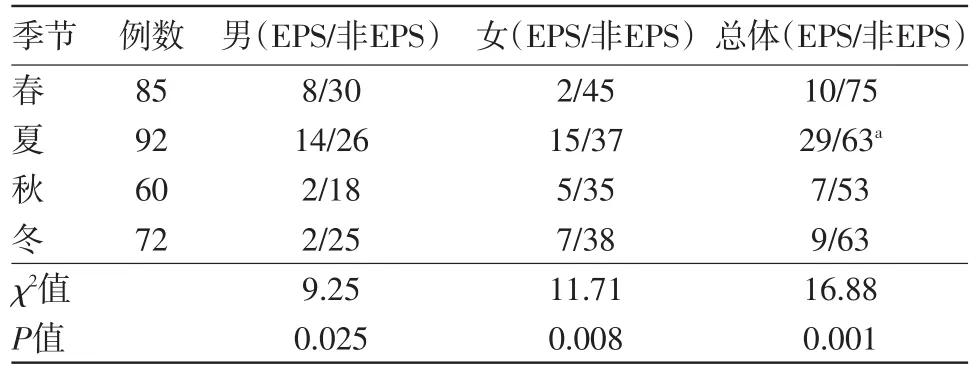
表2 单独服用阿立哌唑治疗的精神分裂症病人309例不同季节锥体外系症状(EPS)发生率比较/例
2.4EPS相关影响因素的logistic回归分析对EPS相关影响因素进行logistic回归分析,采用向前条件法,因变量为年龄、既往是否服用抗精神病药物、最大服药剂量、每公斤体质量服药剂量、开始服用阿立哌唑时的病程。α入=0.05,α出=0.10。logistic回归分析发现,年龄及既往服用抗精神病药物与EPS的发生呈显着的负相关性(OR=0.953,P<0.01;OR=0.279,P<0.01)。而最大服药剂量与每公斤体质量服药剂量与EPS的发生呈显着的正相关性,即最大服药剂量越大、每公斤体质量服药剂量越大,出现EPS的风险越大(分别为:OR=1.114,P<0.05;OR=3.875,P<0.05);同时与其它3个季节相比,夏季服药出现EPS的风险性也显着增高(P<0.05)。见表3。
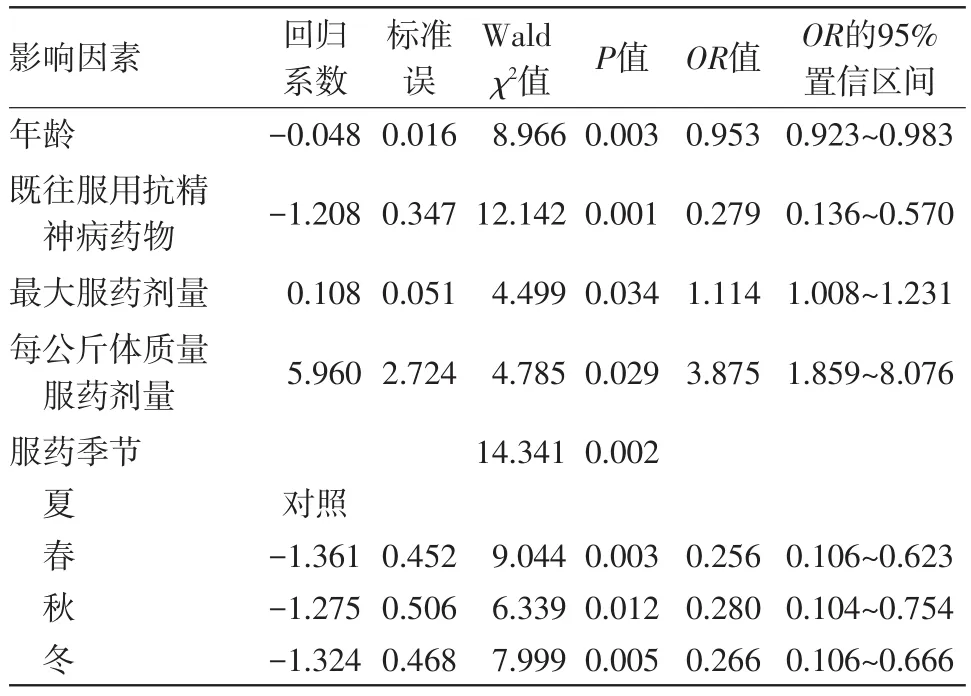
表3 单独服用阿立哌唑的精神分裂症病人309例中发生锥体外系症状(EPS)55例的相关影响因素logistic回归分析结果
3 讨论
临床上,阿立哌唑因可以较好改善病人精神症状和认知功能,且较少引起EPS而被视为治疗精神分裂症较为理想的药物之一[7]。有研究指出阿立哌唑较少产生EPS,在短期安慰剂对照试验中,阿立哌唑治疗报道的EPS发生率仅为6%,远低于利培酮等其他多巴胺受体拮抗剂,与安慰剂相当[3]。其原因可能在于黑质-纹状体通路中,阿立哌唑阻断突触前膜5-HT2A受体所介导的多巴胺脱抑制释放现象并不明显[8],同时也有文献指出只有当95%以上的纹状体D2受体被阿立哌唑占据时才可能会发生EPS,而其它抗精神病药与80%左右的纹状体D2受体结合时便可能会诱发EPS[9]。但是本课题组发现阿立哌唑所致EPS在临床上并不少见,并且国内外相关研究数据表明阿立哌唑所致EPS的发生率为15.8%~36.7%[10-13]。但是上述研究的样本量较小(小于100例),得到的EPS发生率差别较大,并且少有研究对出现EPS的影响因素进行分析。因此本研究采用回顾性研究的方法,对较大样本(309例)进行了分析研究,发现EPS的发生率为17.80%,与国内两项相关研究得出的结果较为接近[10-11]。
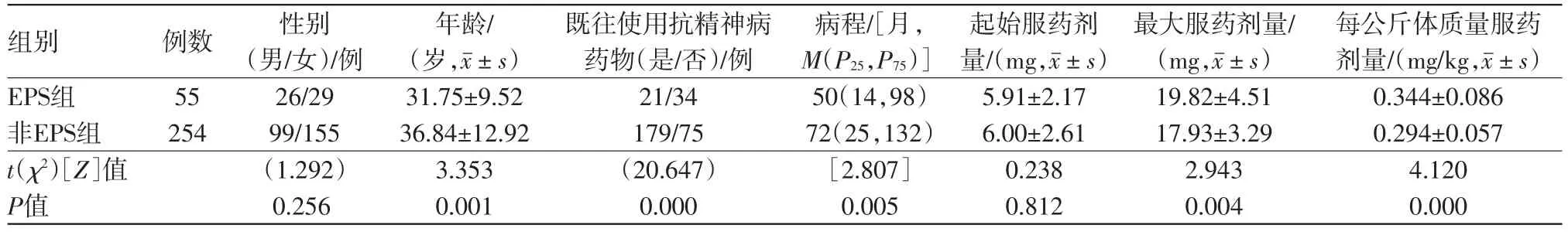
表1 单独服用阿立哌唑治疗的精神分裂症病人发生锥体外系症状(EPS)组与非EPS组一般临床特征分析
与相关研究的结果相吻合[10],本研究分析发现单独服用阿立哌唑的精神分裂症病人EPS发生率在性别上差异无统计学意义(男性20.8%比女性15.76%),但是需要注意的是男性病人出现EPS时的服药剂量显着高于女性病人,因此,尚不能明确同等剂量下EPS发生率的性别差异。本研究还发现年龄及既往服用其它抗精神病药物可能是阿立哌唑所致EPS发生的一种保护性因素,这可以理解为病人年龄越大,则病程越长,既往服用其它抗精神病药物的可能性越大,因此包括黒质-纹状体在内的脑区DA受体的敏感性下降,产生耐受现象[14-15],因此更不容易出现EPS。但是应该注意,病人年龄大并不能完全代表其病程长,同时存在病人首发年龄较大的可能性,该类病人往往服药预后较好,服药剂量也相对较小,因此产生副作用的风险相对减小。在本研究中,我们发现阿立哌唑所致EPS与药物剂量有关:EPS病人组的最大服药剂量及每公斤体质量服药剂量均显着高于未出现EPS病人组,但是logistic回归分析发现每公斤体质量服药剂量可能与EPS的发生更具相关性。这也提示在临床用药时,我们应该严格遵循个体化原则,通过体质量、年龄、性别等因素综合考虑给药剂量可能会更加有效地规避药物不良反应。
此外,本研究的另外一项有意义的发现为夏季服用阿立哌唑的病人EPS的发生率显着高于其它三个季节,出现这种现象可能有两方面的原因,首先由于夏季气温较高,病人水分消耗增多,且多数精神分裂症病人受症状或药物的影响而水分摄入较少,从而导致血容量减少,体内血药浓度相对升高;其次,阿立哌唑主要经细胞色素P450酶的N-脱烷基化、羟基化及脱氢作用在肝脏内代谢,而有研究则表明细胞色素P450酶参与了体温调节的过程,依赖于细胞色素P450酶的单氧化酶参与了内源性解热过程来维持体温的内环境稳态系统[16-17]。因此夏季可能由于体温调节而使参与药物代谢的细胞色素P450酶相对减少,进而减慢药物代谢速度,最后导致血药浓度相对升高。血药浓度的相对升高则会增加EPS等不良反应的发生风险。因此,本研究提示阿立哌唑的夏季给药,需谨慎加量,缓慢滴定,定期监测阿立哌唑血药浓度,密切注意观察病人相关表现,以降低EPS发生的可能性。
当然本研究也存在局限之处,首先本研究为回顾性研究,尽管选择病例客观描述或数据作为研究资料,但是病程时长等数据仍可能存在一定回忆偏差;同时所有病例资料均取自同一精神病专科医院,样本的采集可能存在一定的地域性偏倚。



