王丹,刘晓娟,康天
内质网(Endoplasmic Reticulum,ER)参与调控多种细胞功能,包括蛋白质折叠、翻译后修饰(PTMs)、脂肪酸生物合成、解毒,细胞内钙离子储存等[1]。细胞内的分泌蛋白和跨膜蛋白主要在内质网中合成[2]。内质网通过折叠、二硫键的形成、N-糖基化和许多其他PTMs1对新合成的蛋白质进行加工和修饰,而且它还与葡萄糖、脂类和胆固醇代谢等过程有关[3-5]。在ER中,蛋白质在伴侣蛋白和蛋白二硫键异构酶的帮助下,精确地折叠成天然构象。然而,当细胞受到各种内外因素的刺激,如病毒感染、炎症以及其他细胞水平的异常等,使ER蛋白质的折叠功能异常,导致ER内未折叠蛋白的积累,称为内质网应激(Endoplasmic ReticulumStress,ERS)[6-8]。然而,细胞已经发展出一种机制来感知这些变化,并通过特异性信号转导通路的激活来重建内质网稳态,称为未折叠蛋白反应(Unfolded Protein Response,UPR)[9-10]。
UPR 信号通路可通过诱导折叠酶、伴侣蛋白、氧化还原酶的转录,减少蛋白质翻译,通过ER相关蛋白降解途径(ERAD)降解未折叠蛋白来恢复内质网稳态[11]。然而,当ERS 持续进行时,UPR 从存活转化为死亡诱导通路,将受影响的细胞清除出系统,而无限制的凋亡会导致器官细胞的丢失[12-13]。促凋亡信号通路使活性氧和促凋亡蛋白增加,激活炎症分子,导致许多疾病的发生[14]。ER 环境的紊乱还会导致许多蛋白的PTM异常,PTM可以通过生成新抗原激活自身免疫反应[15]。一些ER蛋白,如胰岛素,葡萄糖调节蛋白78,谷氨酸脱羧酶65 等因PTM异常而转化为新抗原[14,16],这些新抗原激活自身反应性T细胞,产生病理状态[17]。此外,在大鼠胰岛素瘤细胞和非肥胖糖尿病小鼠中,细胞因子诱导ER应激产生翻译后修饰的免疫球蛋白结合蛋白(BIP)[18-19],BIP导致自身反应性T细胞产生并分泌较高水平的白细胞介素17(IL-17)、肿瘤坏死因子α(TNF-α)和γ干扰素(IFN-γ)[20]。此外,ER应激介导的UPR使重要的促炎细胞因子上调,使组织进一步损伤[21],在自身免疫性疾病的发病机制中起重要作用[22-23]。有趣的是,细胞因子在反馈回路机制中可以通过UPR 诱导内质网应激和凋亡[24]。综上所述,ERS对自身免疫性疾病的发展有一定的作用。
儿童自身免疫性脑炎是由自身免疫功能异常而引发的免疫性疾病,其形式是自身抗体和T细胞攻击宿主的身体[25-26]。大多数自身免疫性疾病通常以自身抗体、促炎细胞因子和自身反应性T细胞的表达为特征[27-28]。许多环境因素,包括微生物感染、化学物质暴露、自由基和炎症等,都是已知的触发自身炎症的因素[29-32],所有这些因素均可诱导内质网应激,提示ERS可能与自身免疫性疾病的发病有关。淋巴细胞凋亡的失调使免疫功能发生障碍,如免疫缺陷和自身免疫。有研究表明,UPR信号通路中的转录因子CCAAT/增强子结合蛋白(C/EBP-)同源蛋白(CHOP)在细胞凋亡中起重要作用[33-34]。因此,本研究旨在探讨ERS 对AE 病人T 淋巴细胞存活和凋亡的影响以及UPR信号通路在AE淋巴细胞存活和死亡中的作用。
1 材料与方法
1.1 一般材料试剂:RPMI 1640 培养基;胎牛血清(美国Gibco-BRL 公司);青霉素(美国Sigma 公司);链霉素(美国Sigma 公司);RIPA 细胞裂解液(上海碧云天生物公司);蛋白酶抑制剂cocktail(美国Roche 公司);BCA 蛋白定量试剂盒(上海碧云天生物公司);ECL化学发光试剂盒(美国Thermo Fisher Scientific 公司);Annexin-V-PE Kit(美国 BD 公司);PI(美国BD 公司);TG(美国Sigma 公司);Cell Counting Kit-8(日本同仁化学研究所);Ficoll-Paque Plus(通用电气医疗集团)。抗体:BIP(CST,3177);CHOP(CST,2895);B 淋巴细胞瘤-2(Bcl-2),B 淋巴细胞瘤-XL(Bcl-XL),bcl-2 相关X 蛋白(Bax)(Santa Cruz);甘油醛-3-磷酸脱氢酶(GAPDH)(proteintech,10494-I-AP);辣根过氧化物酶(HRP)标记鼠二抗(武汉三鹰生物技术有限公司);HRP羊抗兔IgG(康为世纪,cw0103)。所有研究对象或其近亲属签署知情同意书,本项研究所用方法符合《世界医学协会赫尔辛基宣言》,且经本院伦理委员会审核、批准后实施(伦理批号20170218),研究时间为2017 年2月至2019年2月。
1.2 方法
1.2.1外周血单核细胞分离和T淋巴细胞分选 在提供知情同意后,从石家庄市第一医院儿科AE病人和年龄、性别匹配的健康供者处获得30~40 mL的外周血样本。外周血样本用磷酸缓冲盐溶液(PBS)(pH 7.4)1∶2 稀释后置于淋巴细胞分离液(Ficoll-Paque Plus)上,20 ℃离心30 min;从Ficoll-Paque与血清层间收集PBMCs,PBS洗涤2次。根据试剂盒说明书对T淋巴细胞进行分选。采用链霉亲和素结合的CD11b/巨噬细胞抗原、人源化抗人(CD16)、B淋巴细胞抗原(CD19)、血小板反应蛋白受体(CD36)、巨核细胞糖蛋白IIb/IIIa(CD41a)、神经细胞黏附分子(CD56)和血红糖蛋白A(CD235a)生物素化抗体复合物对外周血单核细胞进行负性分选,分离T细胞。即PBMCs 与加入蛋白酶抑制剂的抗体在室温下孵育15 min,磁珠与单抗在室温下孵育30 min。采用磁板纯化T 细胞,纯度大于99%,采用流式细胞仪计数T淋巴细胞。
1.2.2细胞培养 分选出的T淋巴细胞用含10%胎牛血清,100 U/mL青霉素和100µg/mL链霉素的RPMI 1640培养液,置于37 ℃、5%二氧化碳的细胞培养箱中培养。
1.2.3细胞生存能力分析 将AE 病人和健康供者的T 淋巴细胞接种于96孔板中,每孔接种1×104个T淋巴细胞,每个样本接种6个复孔,用不同浓度的TG(0、0.5、1、5、10 nM)处理AE 病人和健康供者的T 细胞,48 h后分别在每孔加入CCK8溶液(每孔10µL),将96孔板置于细胞培养箱,37 ℃培养60 min。利用酶标仪在450 nm处通过吸光度值测量计数活细胞。
1.2.4Annexin V 和PI 染色进行凋亡分析 采用Annexin V/PI染色定量检测细胞膜胞外侧磷脂酰丝氨酸的含量。AE 病人和健康供者的T 淋巴细胞种于6 cm皿,待细胞密度约为70%时,TG(5 nM)处理48 h。收集细胞:用胰酶消化细胞,800 r/min 离心5 min,弃上清,由预冷的PBS 洗涤后,收集细胞。对照细胞(TG 未处理的AE 病人和健康供者的T 淋巴细胞)和TG 处理细胞在室温下按照试剂说明书用Annexin V-FITC(5 µL)和 PI(10 µg/mL)染色 10 min,用流式细胞分析仪进行分析。
1.2.5细胞样品蛋白质提取 将分选的AE 病人和健康供者的T淋巴细胞接种于6 cm皿,待细胞密度约为70%时,TG(5 nM)处理细胞,48 h后用PBS洗涤细胞并收集细胞。将加有蛋白酶抑制剂的RIPA 裂解液加入收集的细胞,在冰上裂解15 min后,将细胞裂解液转入1.5 mL离心管,4 ℃,12 000 r/min离心15 min。离心后吸取上清液,并用蛋白质定量试剂盒进行定量。定量后每组样品中加入1/4体积的5×Loading Buffer缓冲液,沸水煮沸5 min后-20 ℃保存。
1.2.6蛋白质印迹法(Western blot) 根据BCA 配胶试剂盒说明书,配制10%的平板凝胶。每组蛋白样品取30 µg 进行凝胶电泳(恒压120 V,2 h),甲醇激活PVDF 膜后转膜(恒压100 V,2 h),转膜结束后在封闭缓冲液(5%脱脂牛奶)中室温孵育60 min,TBST洗涤后一抗室温孵育1 h后4 ℃过夜孵育。一抗孵育后取出PVDF膜,TBST洗3次,每次7 min,洗涤后二抗室温孵育60 min,TBST洗3次,每次7 min,用ECL法检测反应蛋白。
1.3 统计学方法采用SPSS 17.0进行本研究数据统计分析。观测资料主要是计量数据,以±s表示,以单因素方差分析(One-way ANOVA)和Tukey多重比较试验对多组进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 内质网应激对T淋巴细胞存活的影响用不同浓度的TG(0、0.5、1、5、10 nM)处理AE病人和健康供者外周血T淋巴细胞48 h,使用CCK-8试剂盒检测AE病人和健康供者外周血T淋巴细胞的生存能力。实验结果(图1)显示,不同浓度TG(0、0.5、1、5、10 nM)处理48 h后AE病人T细胞存活率分别为(9.92±0.42)%、(9.11±0.41)%、(7.06±0.39)%、(6.07±0.31)%、(5.02±0.30)%;健康供者T 细胞存活率分别为(10.46±0.47)%、(10.05 ± 0.49)% 、(9.91 ± 0.41)% 、(9.85 ±0.42)%、(9.77±0.41)%、两组均呈剂量依赖性下降。与健康供体相比,AE病人T淋巴细胞在TG处理后T细胞存活率下降更为显着,AE病人和健康供者外周血T淋巴细胞,差异有统计学意义。这些结果表明TG可明显抑制AE病人T淋巴细胞的生存能力。
2.2 内质网应激对T 淋巴细胞凋亡的影响用ERS诱导剂TG(5 nM)分别处理AE病人和健康供者外周血T淋巴细胞,48 h后收集细胞,并进行AnnexinV和PI双染,流式细胞术检测淋巴细胞凋亡情况。检测结果显示(图1),与健康供者相比,AE病人T细胞(15.65±1.11)%在体外比对照组(6.11±0.65)%更容易凋亡。此外,我们发现TG诱导AE病人和健康供者外周血T 淋巴细胞后,AE 病人的T 淋巴细胞(19.65±1.55)%凋亡水平明显高于健康供者(10.89±1.03)% 和 未 进 行 TG 诱 导 的 AE 病 人(15.65±1.11)%,并且差异有统计学意义。这表明TG 刺激可促进AE病人的T淋巴细胞凋亡。

图1 TG诱导可促进自身免疫性脑炎(AE)病人的T淋巴细胞凋亡
2.3 TG 诱导后T 淋巴细胞UPR 相关蛋白的表达将AE 病人外周血淋巴细胞(PBMCs)和健康供体中分离的T淋巴细胞,分别用TG(5 nM)处理这两种细胞,48h 后收集细胞并提取蛋白。蛋白质印迹法检测UPR 标志分子BIP(UPR 的中心调节因子)和CHOP(抑制Bcl-2基因启动子)的蛋白表达水平,实验结果(图2)显示:与健康供体UPR 标志分子BIP 和CHOP 的蛋白表达水平(0.50±0.05、0.53±0.06)%相比,AE病人外周血T淋巴细胞BIP(0.23±0.04)%的表达降低,而CHOP(0.81±0.07)%的表达显着升高,差异有统计学意义(t=10.329、7.439,P<0.01)。以上结果提示,BIP和CHOP可能介导内质网应激诱导的外周血T淋巴细胞凋亡。

图2 毒胡萝卜素(TG)诱导T淋巴细胞未折叠蛋白反应(UPR)相关蛋白表达
2.4 TG 诱导后T 淋巴细胞凋亡相关蛋白的表达内质网应激诱导的细胞凋亡受抗凋亡和促凋亡信号调控,包括Bcl-2、Bcl-XL、Bax。分别用TG(5nM)处理从AE 病人外周血淋巴细胞(PBMCs)和健康供体中分离T 淋巴细胞,48 h 后收集细胞并提取蛋白。蛋白质印迹法检测凋亡相关蛋白Bcl-2、Bcl-XL 和Bax 的表达水平,实验结果(图3)显示:与健康供体凋亡相关蛋白Bcl-2、Bcl-XL 和Bax 的表达水平[(1.41±0.04)%、(1.23±0.06)%、(0.51±0.01)%]相比,AE 病人的 T 细胞中抗凋亡蛋白 Bcl-2(0.73±0.07)%和Bcl-XL(0.51±0.05)%表达水平降低,而促凋亡蛋白Bax(1.25±0.05)%表达增加,差异有统计学意义(t=35.548、20.660、22.581,P<0.01)。以上结果表明BIP和CHOP可能通过抗凋亡信号和促凋亡信号介导内质网应激诱导的外周血T淋巴细胞凋亡。
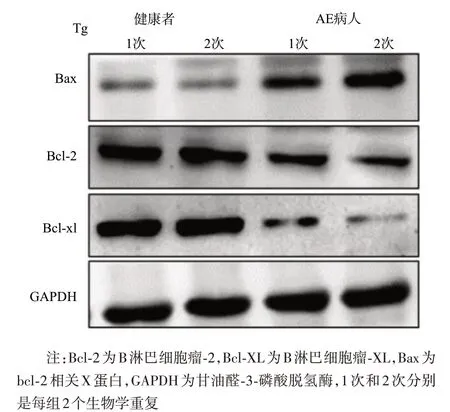
图3 毒胡萝卜素(TG)诱导T淋巴细胞凋亡相关蛋白表达
3 讨论
AE的T细胞在其发病机制中具有重要的作用,而T淋巴细胞内环境平衡失调是AE最重要的发病机制之一。我们的研究证明内质网应激可明显抑制AE病人T淋巴细胞的生存能力,促进AE病人T淋巴细胞凋亡。因此,调节内质网应激可能成为AE治疗的一个有价值的药理靶点。UPR在许多类型的免疫细胞中发挥着重要作用[35]。由于免疫细胞的分泌功能,其具有较多的内质网并且具有较高的蛋白质折叠活性,因此它们更容易受到毒素、疾病和病原体等诱发内质网应激因素的影响[36]。UPR在免疫功能中的作用可能是多种复杂免疫性疾病的发病机制之一[37]。我们的研究发现,AE病人外周血T淋巴细胞CHOP的表达显着升高,抗凋亡蛋白Bcl-2和Bcl-XL表达水平降低,而促凋亡蛋白Bax表达增加。这一结果证实UPR通路与AE的发生有关,同时可能通过调控抗凋亡信号和促凋亡信号介导内质网应激诱导的外周血T淋巴细胞凋亡。
BIP是ER应激反应的中心调控因子,各种应激因素可以诱导BIP的表达,它通过调控细胞凋亡和增殖来维持T细胞的存活[38]。内质网应激时T细胞存活的调控与CHOP蛋白的诱导表达有关,CHOP蛋白表达参与内质网应激诱导的细胞凋亡[33,39]。在本研究中,我们检测了TG刺激后AE病人T细胞BIP和CHOP蛋白的表达水平,与健康供者相比,AE病人外周血T淋巴细胞BIP的表达水平降低,CHOP的表达水平显着升高。此外,与健康供体相比,TG诱导后AE病人的T细胞中抗凋亡蛋白Bcl-2和Bcl-XL表达水平降低,而促凋亡蛋白Bax表达增加。AE病人BIP反应可能导致ER应激时T细胞凋亡反应水平升高,导致T淋巴细胞减少。然而,BIP在T细胞活化、分化、增殖和存活中的确切作用尚不清楚。因此,确定细胞内BIP在T细胞病理生理和T细胞依赖性自身免疫性疾病(如AE)发展中的作用,可能有助于开发诊断标记物或治疗靶点。



