芦君
作者单位:新汶矿业集团有限责任公司中心医院神经内一科,山东 泰安 271200
脑梗死又称缺血性卒中,常常会伴随大脑动脉闭塞综合征,是目前导致人类死亡和致残的主要疾病之一[1-2],主要通过溶栓治疗、抗凝药物治疗等。当然还可以选用中药治疗[3]。使用中药治疗具有副作用小、对病人其他器官损伤较小的特点。三七总皂苷是三七有效成分之一,三七味苦,微甘,可活血、祛瘀,还参与血小板聚集、心脑血流量调节过程[4]。丁岩等[5]研究表明:三七总皂苷可以减轻炎症反应,清除氧自由基,减轻线粒体损伤的作用。三七总皂苷可以作为缓解脑梗死损伤的有效中药,但目前关于三七总皂苷通过Wnt/β-连环素(β-catenin)信号通路影响脑梗死的研究尚没有报道。本研究于2018年1月至2019年3月观察三七总皂苷对脑梗死大鼠模型影响,以期了解三七总皂苷对脑梗死大鼠模型神经细胞Wnt/β-catenin信号通路的影响作用机理。
1 材料与方法
1.1 动物60只SPF级3周龄雄性SD大鼠由广东医学院实验动物中心提供[粤监证字2004A029号,SCXK(粤)2018-0008],体质量(60±5)g,所有大鼠均在新汶矿业集团有限公司中心医院动物中心实验室SPF级环境饲养(20~25℃,人工光照12 h/d,黑暗12 h/d,50%~65%空气湿度,自由饮食),本研究符合一般动物实验伦理学原则。
1.2 药物与试剂三七总皂苷购自湖北省中医院;自噬蛋白P62抗体(货号sc-48389;批号20190602)购自美国Santa Cruz公司;Wnt信号通路配体蛋白Wnt3a抗体(货号ab81484;批号20190201)购自英国Abcam公司;辣根过氧化物酶羊标记抗兔免疫球蛋白G(IgG)等二抗购自美国Thermo公司。
1.3 仪器台式高速冷冻离心机TGL-16M购自湖南湘仪实验室仪器开发有限公司;电泳仪、转膜仪购自美国Bio-Rad公司;凝胶成像系统购自美国Thermo Fish⁃er公司。
1.4 方法
1.4.1 分组及建立模型 各组大鼠适应性喂养1周,以随机数字表法将60只大鼠均分为空白对照组、模型组、低剂量三七总皂苷组和高剂量三七总皂苷组,每组各15只,将模型组、低剂量三七总皂苷组和高剂量三七总皂苷组大鼠制成脑梗死模型[6]。空白对照组仅仅暴露大鼠颈动脉,不适用尼龙绳阻断大鼠供血。
1.4.2 药物干预 低剂量三七总皂苷组造模成功后2 h腹腔注射三七总皂苷,注射剂量按照75 mg/kg注射,将其稀释呈0.5 mL,每日注射1次,连续注射3 d;高剂量三七总皂苷组造模成功后2 h腹腔注射三七总皂苷,注射剂量按照150 mg/kg注射,将其稀释呈0.5 mL,每日注射1次,连续注射3 d;空白对照组和模型组造模成功后2 h腹腔注射等量的生理盐水,每日注射1次,连续注射3 d,三七总皂苷注射剂量参考林辉[7]研究结论。
1.4.3 大鼠神经功能缺损评分 各组大鼠完成最后一次给药24 h后,用改良神经功能缺损评分(mNSS)[8]评定大鼠神经功能,神经功能轻度损害受损分数为1~6分,神经中度受损评分为7~12分,神经重型受损评分为13~18分。
1.4.4 大鼠姿势反射评分 完成大鼠mNSS评分2 h后,使用Z-Longa评分[9]评定大鼠姿势反射情况。
1.4.5 大鼠脑梗死率及脑含水率检测 完成神经评分后处死大鼠,取脑于-20℃环境20 min后行冠状切成(厚度2 mm),脑片置于2%2,3,5-三苯基氯化四氮唑(TTC)溶液避光反应30 min后拍照,Image-ProPlus软件对脑梗死区域(白色区域)、正常区域(红色区域)的总面积进行分析计算,脑梗死率(%)=(梗死区总面积/全脑总面积)×100%。各组大鼠左右脑半球分离,快速称质量(湿质量),随后放入90℃恒干燥箱干燥,时间为24 h,取出后称质量(干质量),脑含水率(%)=[(湿质量-干质量)/湿质量]×100%。
1.4.6 蛋白质印迹法检测蛋白表达水平 提取脑部组总蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳将蛋白分离,再转至聚偏二氟乙烯膜,5%脱脂奶粉室温封闭1h,添加Wnt3a、β-catenin、LC3-Ⅱ、P62、β-肌动蛋白(β-actin)一抗4℃孵育过夜,加入辣根过氧化物酶标记的二抗室温孵育2 h,化学显影曝光并收集图像。
1.5 统计学方法运用SPSS 22.0,计量资料以±s表示,多组间采用单因素方差分析,多组间的两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 神经功能缺损及姿势反射评分结果与空白对照组相比,模型组大鼠mNSS评分、大鼠姿势反射评分升高(P<0.05);各组大鼠mNSS评分、大鼠姿势反射评分比较见表1。
表1 各组大鼠mNSS及姿势反射评分结果比较/(分,±s)
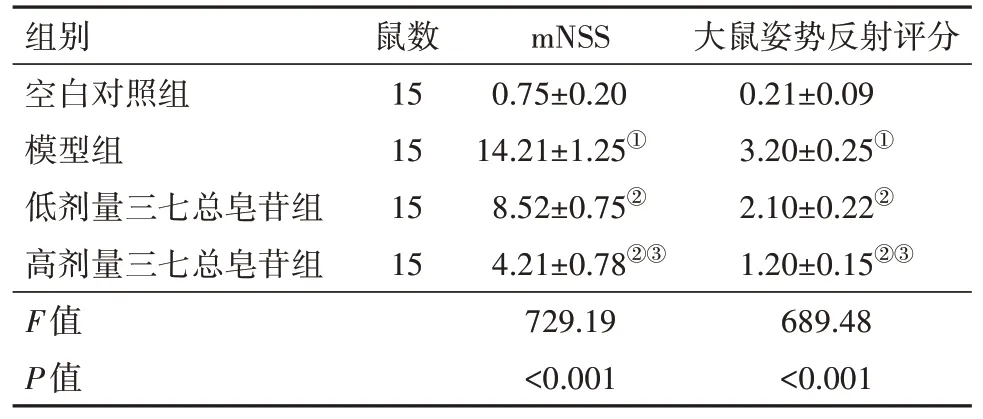
表1 各组大鼠mNSS及姿势反射评分结果比较/(分,±s)
注:mNSS为改良神经功能缺损评分。①与空白对照组相比,P<0.05。②与模型组相比,P<0.05。③与低剂量三七总皂苷组相比,P<0.05。
组别空白对照组模型组低剂量三七总皂苷组高剂量三七总皂苷组F值P值鼠数15 15 15 15 mNSS 0.75±0.20 14.21±1.25①8.52±0.75②4.21±0.78②③729.19<0.001大鼠姿势反射评分0.21±0.09 3.20±0.25①2.10±0.22②1.20±0.15②③689.48<0.001
2.2 脑梗死率及脑含水率检测结果与空白对照组相比,模型组脑梗死率、脑含水率升高(P<0.05);与模型组相比,低、高剂量三七总皂苷组大鼠脑梗死率、脑含水率降低(P<0.05);且高剂量组降低更明显(P<0.05)。见表2,图1。
表2 各组大鼠脑梗死率及脑含水率结果比较/(%,±s)
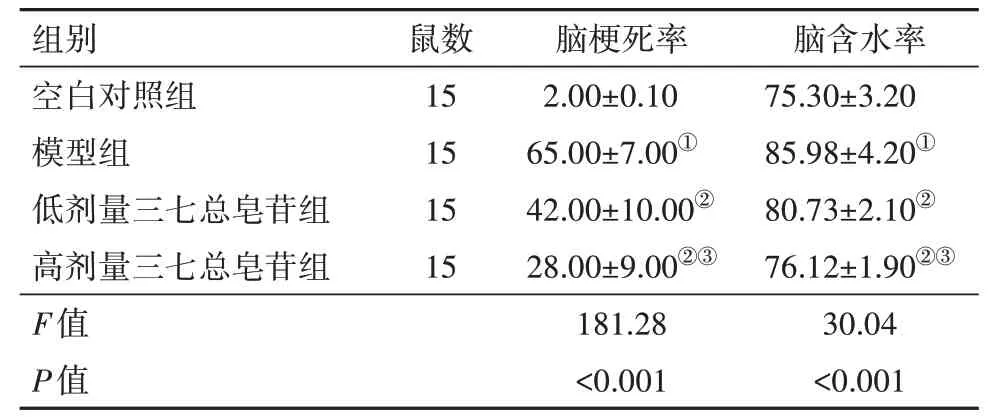
表2 各组大鼠脑梗死率及脑含水率结果比较/(%,±s)
注:①与空白对照组相比,P<0.05。②与模型组相比,P<0.05。③与低剂量三七总皂苷组相比,P<0.05。
组别空白对照组模型组低剂量三七总皂苷组高剂量三七总皂苷组F值P值鼠数15 15 15 15脑梗死率2.00±0.10 65.00±7.00①42.00±10.00②28.00±9.00②③181.28<0.001脑含水率75.30±3.20 85.98±4.20①80.73±2.10②76.12±1.90②③30.04<0.001
2.3 自噬相关蛋白表达检测结果与空白对照组相比,模型组大鼠脑组织P62蛋白表达水平降低,LC3-Ⅱ蛋白表达水平升高(P<0.05);与模型组相比,低、高剂量三七总皂苷组大鼠脑组织P62蛋白表达水平升高,LC3-Ⅱ蛋白表达水平降低(P<0.05);与低剂量三七总皂苷组相比,高剂量三七总皂苷组大鼠脑组织P62蛋白表达水平升高,LC3-Ⅱ蛋白表达水平降低(P<0.05)。见表3,图2。
表3 各组大鼠自噬相关蛋白表达比较/±s
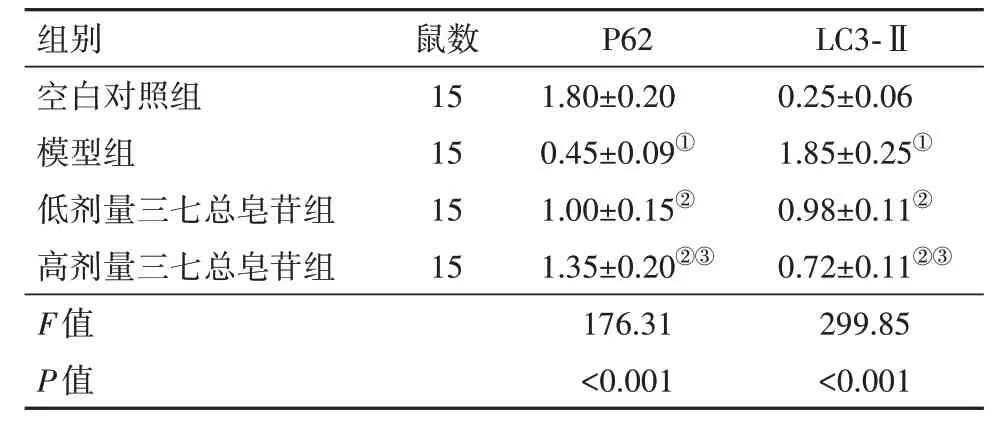
表3 各组大鼠自噬相关蛋白表达比较/±s
注:P62为自噬蛋白,LC3-Ⅱ为微管相关蛋白轻链3-Ⅱ。①与空白对照组相比,P<0.05。②与模型组相比,P<0.05。③与低剂量三七总皂苷组相比,P<0.05。
组别空白对照组模型组低剂量三七总皂苷组高剂量三七总皂苷组F值P值鼠数15 15 15 15 P62 1.80±0.20 0.45±0.09①1.00±0.15②1.35±0.20②③176.31<0.001 LC3-Ⅱ0.25±0.06 1.85±0.25①0.98±0.11②0.72±0.11②③299.85<0.001
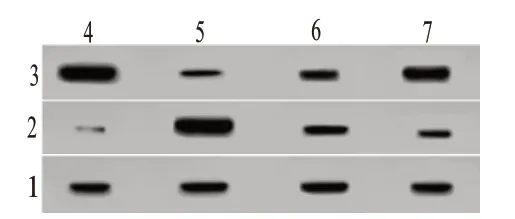
图2 各组大鼠自噬相关蛋白表达的蛋白质印迹法检测结果
2.4 Wnt/β-catenin信号通路蛋白检测结果与空白对照组相比,模型组大鼠脑组织Wnt 3a、β-catenin蛋白表达水平降低(P<0.05);与模型组相比,低、高剂量三七总皂苷组大鼠脑组织Wnt3a、β-catenin蛋白表达水平升高(P<0.05),且高剂量三七总皂苷组更高(P<0.05)。见表4,图3。
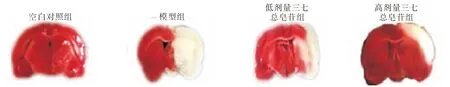
图3 各组大鼠冠状位大脑切片2,3,5-三苯基氯化四氮唑(TTC)染色
表4 各组大鼠Wnt3a、β-catenin蛋白表达比较/±s
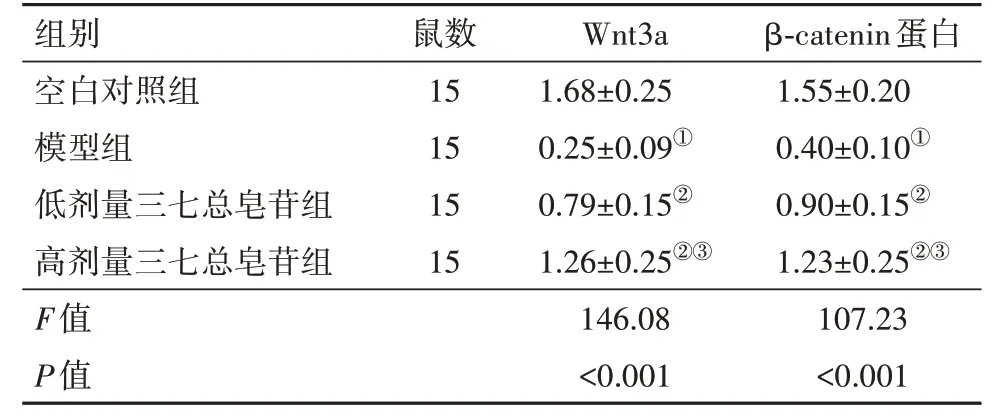
表4 各组大鼠Wnt3a、β-catenin蛋白表达比较/±s
注:Wnt3a为Wnt信号通路配体蛋白,β-catenin为β-连环素。①与空白对照组相比,P<0.05。②与模型组相比,P<0.05。③与低剂量三七总皂苷组相比,P<0.05。
组别空白对照组模型组低剂量三七总皂苷组高剂量三七总皂苷组F值P值鼠数15 15 15 15 Wnt3a 1.68±0.25 0.25±0.09①0.79±0.15②1.26±0.25②③146.08<0.001 β-catenin蛋白1.55±0.20 0.40±0.10①0.90±0.15②1.23±0.25②③107.23<0.001

图3 各组大鼠Wnt/β-catenin信号通路蛋白的蛋白质印迹法检测结果
3 讨论
脑梗死往往会出现脑组织水肿和炎症反应,是因为大脑缺血后活化的中性粒细胞可释放大量的毒性氧自由基和蛋白水解酶,导致局部脑血管损伤,使得通透性增大。引起脑组织水肿[10]。同时中性粒细胞释放的毒性物质还可进一步破坏幸存的神经细胞,加重脑组织损伤形成恶性循环。本研究发现,使用三七总皂苷治疗后大鼠mNSS评分、大鼠姿势反射评分降低。有研究表明三七总皂对局灶性脑缺血再灌注损伤大鼠脑水肿、脑梗死有改善作用[11]。本研究也呈相似趋势,说明大鼠的神经功能得到改善,这可能是因为三七总皂苷可通过减轻脑梗死区炎症反应并抑制脑梗死区中性粒细胞浸润,减少中性粒细胞释放的毒性物质破坏神经细胞,实现缓解大鼠脑组织水肿情况达到治疗大鼠脑梗死。
P62不仅参与泛素化过程,还在细胞自噬调控[12],其表达水平越高提示自噬水平越弱[13]。微管相关蛋白1轻链3是哺乳动物的自噬基因[14],当自噬活动增强时自噬体的数目就会增加,微管相关蛋白轻链3-I会和更多的自噬细胞膜结合形成LC3-Ⅱ,随着自噬过程的进展,自噬体外膜会与溶酶体膜融为一体,溶酶体内的酶就会降解LC3-Ⅱ蛋白[15]。Wnt信号通路是细胞自噬重要信号转导通路。Wnt信号可以磷酸化糖原合成酶激酶3β,促进结节性硬化复合物蛋白1/结节性硬化复合物蛋白2复合物形成,以减少哺乳动物雷帕霉素靶蛋白的降解,从而抑制自噬的发生[16]。本研究发现,使用三七总皂苷后可以降低脑梗死大鼠LC3-Ⅱ蛋白表达,增加P62蛋白表达,可能是三七总皂苷通过某些途径使得P62表达降低,影响自噬小体形成,使得大鼠脑组织中的自噬体降低,减轻大鼠的自噬。
耿武军等[17]研究表明Wnt/β-catenin信号通路通过调控自噬改善脑梗死大鼠的神经损伤,Wnt信号通路在调控成年动物大脑中的神经再生中起关键性作用,Wnt信号通路包括经典wnt信号通路和非经典Wnt信号通路[18]。人参皂苷含有Rg1、Rb1、Re、Rd等多种皂苷成分,现代医学研究表明三七总皂苷具有抗氧化、抑制炎症的效果[19]。人参皂苷通过抑制相关炎性介质核因子κB的激活抑制脑梗死大鼠脑部的炎症反应,同时通过抗氧化作用促进Wnt/βcatenin信号通路的活化使血清糖皮质激素诱导蛋白激酶表达增多,从而使细胞核内的转录因子FoxO相关分子移位于细胞质,减少转录因子FoxO信号通路下游相关促细胞凋亡基因的产生,从而影响大鼠脑细胞凋亡。三七总皂苷促进的Wnt/β-catenin信号通路的活化,并促进了β-catenin的表达,高浓度的β-catenin能进入细胞核与巴增强因子/T-细胞因子(Lef/Tcf)家族的转录因子结合,激活下游靶基因的表达促进神经肝细胞向不可再生的神经元细胞转化,补充凋亡的神经细胞[20]。本研究发现使用三七总皂苷后大鼠脑组织Wnt3a蛋白和β-catenin蛋白表达水平升高。王飞等[21]研究表明通过影响Wnt基因表达可以促进神经干细胞向神经元细胞分化,达到改善神经功能的作用,本研究结果中大鼠的神经功能得到恢复推测与此有关。
综上所述,三七总皂可缓解脑梗死大鼠神经功能损伤,其作用机制可能与激活wnt/β-catenin信号通路、抑制神经元细胞自噬有关,在后期的实验中将深入探讨三七总皂的剂量使用对脑梗死大鼠神经功能的作用效果。



