涂 浩,赵星灿,杨占娜,李梦辉,徐立新,严若峰,宋小凯,李祥瑞*
(1.南京农业大学动物医学院,南京 210095;2.洛阳市动物疫病控制中心,洛阳 471002)
猪重组IL-2、IL-4和IFN-γ对口蹄疫合成肽疫苗的免疫增强作用研究
涂 浩1,赵星灿2,杨占娜1,李梦辉1,徐立新1,严若峰1,宋小凯1,李祥瑞1*
(1.南京农业大学动物医学院,南京 210095;2.洛阳市动物疫病控制中心,洛阳 471002)
为了研究猪IL-2、IL-4和IFN-γ对口蹄疫合成肽疫苗的免疫佐剂效应,将经测定具有生物学活性的猪重组IL-2、IL-4和IFN-γ与口蹄疫合成肽疫苗配伍免疫仔猪,检测仔猪抗口蹄疫抗体水平和血清细胞因子IL-4、IL-10、IL-17和IFN-γ含量的变化,观察其免疫佐剂效应。结果表明:制备的IL-2、IL-4和IFN-γ重组蛋白质均有较好的生物学活性,其中IL-2和IFN-γ重组蛋白质均能极显着提高仔猪抗口蹄疫抗体水平(P<0.01),而IL-4重组蛋白质抑制口蹄疫抗体的产生(P<0.01)。血清细胞因子检测结果发现口蹄疫疫苗+IL-4组的IL-4和IL-10含量均较空白疫苗免疫猪显着升高(P<0.05),口蹄疫疫苗+IL-2组及口蹄疫疫苗+IFN-γ组的IFN-γ含量较空白疫苗免疫猪极显着升高(P<0.01)。结果提示,重组细胞因子IL-2和IFN-γ分别作为免疫佐剂与口蹄疫疫苗联用,能显着增强机体的体液和细胞免疫应答。
重组蛋白质;IL-2;IL-4;IFN-γ;佐剂效应;口蹄疫
免疫接种常是控制传染病的重要手段,然而传统的疫苗接种存在多种安全问题,新型的亚单位疫苗、合成肽疫苗、核酸疫苗等存在反应性弱、免疫原性小,在体内易降解等缺点,使得机体难以产生有效的免疫保护力。因此免疫佐剂就成为当今研究热点之一。细胞因子是机体内免疫细胞或免疫相关细胞产生的一类具有广泛生物学活性的蛋白质类物质,在机体的体液免疫和细胞免疫产生和调节过程中都发挥重要作用,是机体执行免疫学功能不可缺少的成分[1],相比传统佐剂,作为免疫增强剂具有更多优势。
白细胞介素2(interleukin-2,IL-2)、白细胞介素4(interleukin-4,IL-4)和干扰素-γ(interferon-γ,IFN-γ)都是机体免疫调节不可缺少的细胞因子,具有很高的研究价值[2]。IL-2能同时增强细胞免疫和体液免疫,是一种天然的免疫增强剂和治疗剂[3-5];IFN-γ可增加抗原递呈细胞的主要组织相容性复合物(MHC)分子的表达,对产生CTL应答和提高IgG抗体水平有很大帮助[6-7];IL-2和IFN-γ均属于TH1型细胞因子,可显着地协同促进CD8+T细胞的增殖[8];IL-4主要增强TH2反应,有研究表明猪IL-4不同于鼠和人的IL-4,其不能诱导和刺激B细胞的分泌和生长,且抑制抗体的产生,同时抑制抗原刺激的B细胞增殖[9]。目前关于猪的重组细胞因子对猪口蹄疫疫苗的免疫增强作用研究较少,为了明确IL-2、IL-4和IFN-γ的免疫增强作用,进而开发新型、安全、高效的疫苗佐剂,本试验通过表达IL-2、IL-4和IFN-γ基因的重组蛋白质作为疫苗的免疫佐剂,在实验动物上开展了这三种重组蛋白质对猪口蹄疫合成肽疫苗免疫增强作用的研究。
1 材料与方法
1.1 实验动物
21日龄健康仔猪30头(口蹄疫抗体检测阴性),体重6.0 kg±0.5 kg,来自河南洛阳某猪场,品种包括长白、大白、杜洛克等。
1.2 试剂
口蹄疫O型液相阻断ELISA抗体检测试剂盒购自中国农业科学院兰州兽医研究所(批号:2014031901);口蹄疫合成肽疫苗(批号:20131109),由河南洛阳市畜牧工作站提供;细胞因子IL-4(货号:CSB-E06785p)、IL-10(货号:CSB-E06779p)、IL-17(货号:CSB-E08057p)、IFN-γ(货号:CSB-E06794p)检测试剂盒购自武汉华美生物技术有限公司;RMPI1640(货号:C11875500BT)、DMEM(货号:C11320500BT)细胞培养液购自Life公司;外周血淋巴细胞分离液(货号:LTS1077)购自天津市灏洋生物制品科技有限责任公司;刀豆蛋白ConA(货号:SLBD7276V)购自Sigma公司;Cell Counting Kit-8(编号:C0038)购自碧云天生物技术研究所;Easy Protein Quantitative Kit(货号:DQ101-01H10403G008)购自北京全式金生物技术有限公司;猪IL-2、IL-4和IFN-γ基因的重组表达质粒pET28a-IL-2、pET32a-IL-4和pET28a-IFN-γ由本实验室构建;水疱性口炎病毒(VSV)由本实验室保存。
1.3 细胞因子重组蛋白质的诱导表达
将构建的重组原核表达菌pET28a-IL-2、pET32a-IL-4和pET28a-IFN-γ分别接种至含有相应抗生素的LB培养液中,37 ℃培养过夜,然后各按1∶100接种量转接于500 mL LB培养液中,37 ℃振荡摇菌至OD600 nm值达0.4~0.6时,加入终浓度为0.1 mmol·L-1的IPTG,37 ℃诱导培养5 h,离心收集菌体,用STE缓冲液洗涤2次,再收集菌体,经超声波裂解,离心分离上清和包涵体。上述重组蛋白质主要以包涵体形式存在,收集沉淀,用8 mol·L-1尿素溶解。
1.4 细胞因子重组蛋白质的纯化和复性
将8 mol·L-1尿素溶解的包涵体离心收集上清,用0.22 μm滤膜过滤除菌。按照如下步骤纯化重组蛋白质:先用10 mL双蒸水清洗1 mL His-Trap纯化柱,接着用10 mL的包涵体Binding Buffer(0.02 mol·L-1Na2HPO4、0.02 mol·L-1NaH2PO4、0.5 mol·L-1NaCl、0.02 mol·L-1咪唑、8 mol·L-1尿素)平衡纯化柱,再将蛋白质样品过His-Trap纯化柱,用10 mL包涵体Binding Buffer洗去杂蛋白质,最后用5 mL的Elution Buffer(0.02 mol·L-1Na2HPO4、0.02 mol·L-1NaH2PO4、0.5 mol·L-1NaCl、0.5 mol·L-1咪唑、8 mol·L-1尿素)洗脱蛋白质样品。将收集的蛋白质样品进行SDS-PAGE电泳观察纯化情况。
采用透析复性法,将纯化后的重组蛋白质转移到透析袋中,依次在含有6、4、3、2、0 mol·L-1尿素复性缓冲液(0.02 mol·L-1Tris-Cl、0.5 mol·L-1NaCl、1 mmol·L-1GSH、0.1 mmol·L-1GSSG)中4 ℃条件下各透析12 h,后用无K+PBS中透析2次。最后经聚乙二醇(PEG20000)包埋浓缩至适当体积,过滤除菌后置-70 ℃冻存备用。
1.5 细胞因子重组蛋白质浓度测定及生物活性分析
1.5.1 重组IL-2、IL-4、IFN-γ蛋白质浓度测定 复性后的重组蛋白质浓度使用Easy Protein Quantitative Kit试剂盒,采用Bradford法[10]严格按照说明书进行测定。
1.5.2 重组IL-2、IL-4蛋白质生物活性测定 无菌采取猪外周静脉血,3.8%柠檬酸钠抗凝,用淋巴细胞分离液分离PBMC[11]。用RMPI1640培养基(含10%胎牛血清、青霉素100 U·mL-1和链霉素100 μg·mL-1)调节细胞浓度为1×106个·mL-1,两块96孔板每孔加细胞悬浮液100 μL,依次分别加入猪IL-2和IL-4蛋白质,使其终质量浓度为5、10、20、40 μg·mL-1,每个梯度做5个重复,同时设细胞对照组、调零孔、空载体对照组和ConA对照组, 37 ℃、5% CO2培养箱培养24 h后,每孔加入10 μL CCK-8溶液,继续孵育2 h。用酶标仪测定450 nm的OD值,计算细胞增殖指数。增殖指数(SI)=试验组OD450 nm值/细胞对照组OD450 nm值。
1.5.3 重组IFN-γ蛋白质生物活性测定 在96 孔细胞培养板上用DMEM+10%FBS+1%双抗培养液培养PK15细胞长成单层,吸弃培养液,分别接种100 μL用DMEM 培养液10倍梯度递次稀释的猪水疱性口炎病毒(VSV),每个稀释梯度重复8孔,同时作阴性对照,置于37 ℃、5%的CO2培养箱中培养,逐日观察细胞病变(CPE),连续3 d,然后按Reed-Muench法[12]计算VSV的TCID50。
测定浓度的可溶性重组IFN-γ蛋白质用DMEM+2%FBS培养液作10倍稀释,再进行2倍递次稀释,按每孔0.1 mL的量加入PK15细胞长成单层的96孔培养板上,每个稀释度重复8孔,37 ℃、5%的CO2条件诱导培养24 h后吸弃培养液,用100 TCID50的VSV攻毒,同时设细胞对照和病毒对照,继续培养并观察CPE,连续3 d。参照病毒毒价测定法,用病变抑制孔代替毒价的病变孔,按Reed-Muench法计算IFN-γ蛋白质抗病毒活性单位。
1.6 重组细胞因子对口蹄疫疫苗免疫增强作用研究
试验选取3周龄健康仔猪30头,随机分成6组,每组5头。设空白对照组(PBS)、口蹄疫疫苗组(Vaccine)、口蹄疫疫苗+IL-2组(Vaccine+IL-2)、口蹄疫疫苗+IL-4组(Vaccine+IL-4)、口蹄疫疫苗+IFN-γ组(Vaccine+IFN-γ)和口蹄疫疫苗+空载体组(Vaccine+pET28a/32a空载体蛋白质)。试验组在仔猪耳根后肌肉注射O型口蹄疫合成肽疫苗的同时,按照15 μg·kg-1剂量注射重组蛋白质。于免疫后第0、14 、30 、60 、90 天猪颈部前腔静脉采血分离血清,进行O型口蹄疫抗体ELISA检测和细胞因子IL-4、IL-10、IL-17、IFN-γ的检测。
1.7 统计处理
应用SPSS20.0统计软件进行统计学处理,以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞因子重组蛋白质的表达、分布纯化及复性
SDS-PAGE 电泳结果(图1)显示,携带pET28a-IL-2、pET32a-IL-4和pET28a-IFN-γ重组质粒的阳性克隆菌经IPTG诱导后,分别表达了相对分子质量约为21.4、30.3和20.7 ku的目的蛋白质,与预期的蛋白质相对分子质量大小一致。蛋白质的可溶性分析表明,三种重组蛋白质均呈不可溶表达,在菌体内主要以不溶性的包涵体形式存在,用镍离子亲和层析法对其进行纯化后电泳,出现较清晰单一的特异性条带。
2.2 细胞因子重组蛋白质质量浓度测定和生物活性分析
2.2.1 重组蛋白质质量浓度测定 采用Bradford法测定复性浓缩后的可溶性重组蛋白质,根据试剂盒中BSA标准品绘制标准曲线,计算得到重组IL-2蛋白质质量浓度为0.675 mg·mL-1,IL-4蛋白质质量浓度为0.751 mg·mL-1,IFN-γ蛋白质质量浓度为0.205 mg·mL-1。
2.2.2 重组IL-2、IL-4蛋白质生物活性测定 由表1可知,重组蛋白质IL-2在体外能刺激猪外周血淋巴细胞的增殖,并且增殖效果与蛋白质剂量有一定关系,在适宜蛋白质质量浓度条件下,随蛋白质质量浓度增大,增殖效应逐渐增强,在蛋白质质量浓度为10 μg·mL-1时,增殖效果最明显。
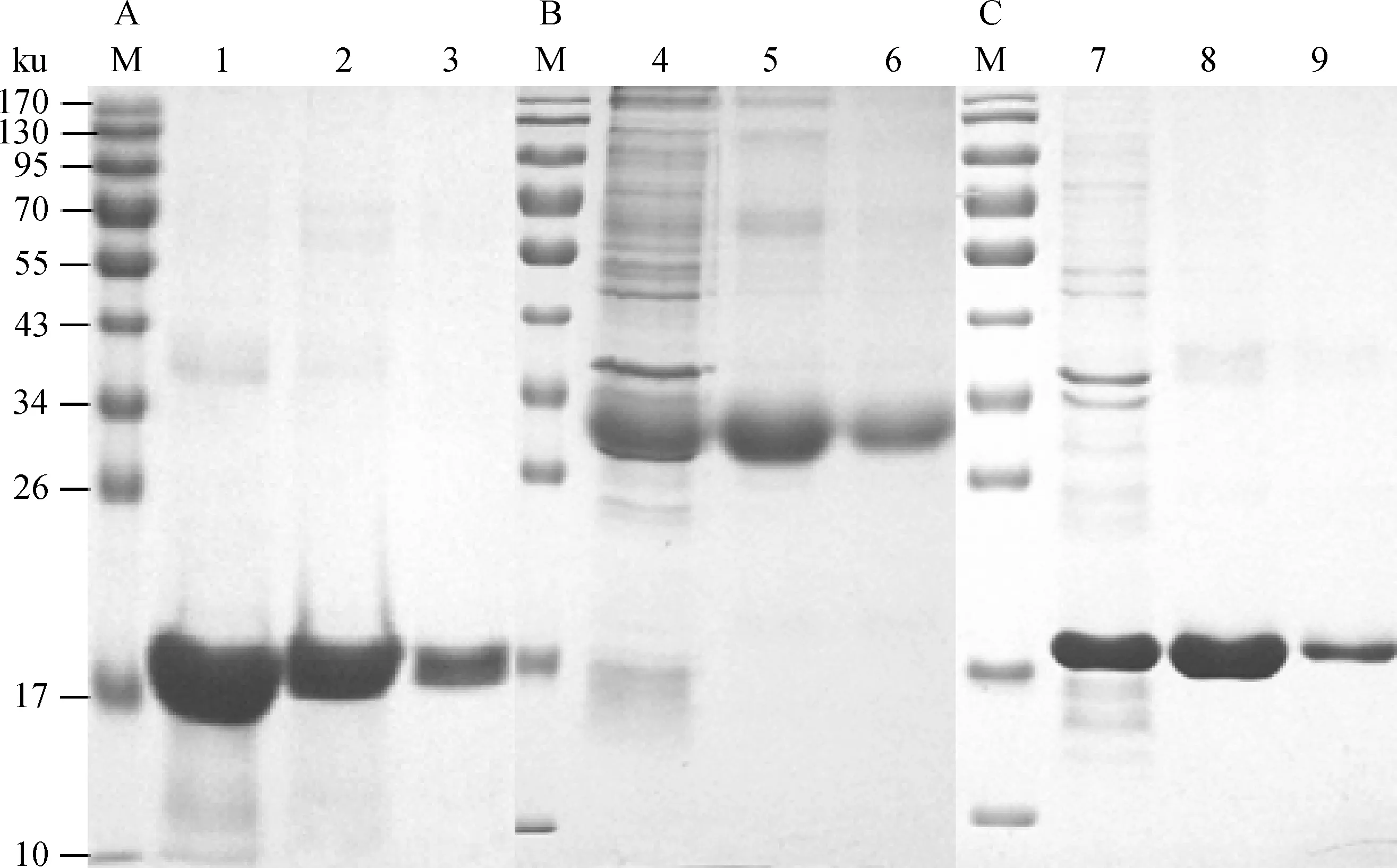
M.蛋白质相对分子质量标准;1.表达的IL-2包涵体蛋白;2.纯化的IL-2包涵体蛋白;3.复性后IL-2包涵体蛋白;4.表达的IL-4包涵体蛋白;5.纯化的IL-4包涵体蛋白;6.复性后IL-4包涵体蛋白;7.表达的IFN-γ包涵体蛋白;8.纯化的IFN-γ包涵体蛋白;9.复性后IFN-γ包涵体蛋白M.Protein marker;1.The sediment of IL-2;2.Purified IL-2 protein;3.Renatured IL-2 protein;4.The sediment of IL-4;5.Purified IL-4 protein;6.Renatured IL-4 protein;7.The sediment of IFN-γ;8.Purified IFN-γ protein;9.Renatured IFN-γ protein图1 IL-2、IL-4和IFN-γ表达产物沉淀纯化复性SDS-PAGE电泳分析Fig.1 Expressed IL-2,IL-4 and IFN-γ products sediment purification and renaturation analysis by SDS-PAGE
表1 重组蛋白质IL-2对猪外周血淋巴细胞增殖效应
Table1 Effect of recombinant protein IL-2 on proliferation of lymphocyte

组别GroupOD450nmOD450nmvalue增殖指数(SI)Proliferationindex(SI)细胞对照0.2977±0.0064—5μg·mL-1IL⁃20.3437±0.0022∗∗1.154510μg·mL-1IL⁃20.4288±0.0130∗∗1.440420μg·mL-1IL⁃20.4008±0.0088∗∗1.346340μg·mL-1IL⁃20.3462±0.0050∗∗1.1629pET28a空载体蛋白质0.3020±0.00931.0144ConA单独刺激0.5650±0.0033∗∗1.89791640培养液0.0000±0.0000—
*表示与细胞对照组比较差异显着(P<0.05);**表示与细胞对照组比较差异极显着(P<0.01)。下表同
* indicateP<0.05 between the experimental group and cell control group,respectively;** indicateP<0.01 between the experimental group and cell control group,respectively.The same as below
由表2可知,虽然重组蛋白质IL-4刺激猪外周血淋巴细胞增殖试验中,当IL-4终质量浓度为10和20 μg·mL-1时差异显着,但增殖指数变化很小。
2.2.3 重组IFN-γ蛋白质生物活性测定 逐日观察10倍梯度稀释的VSV在96孔细胞培养板上致细胞病变结果,如表3所示,可知病毒株的TCID50在10-6(70%)和10-7(18.2%)之间,根据Reed-Muench公式计算得VSV在PK15细胞中的TCID50为10-6.38·0.1 mL-1。而10倍稀释后再2倍递次稀释的重组猪IFN-γ蛋白质在PK15细胞上抑制水疱性口炎病毒复制的结果见表4,参照病毒毒价计算法计算IFN-γ活性为(64.71-50)/(64.71-37.5)=54.06%,其在PK15细胞上抗VSV活性为(10×24.540 6/0.1 mL)/0.205 mg·mL-1=1.135×104U·mg-1。
表2 重组蛋白质IL-4对猪外周血淋巴细胞增殖效应
Table2 Effect of recombinant protein IL-4 on proliferation of lymphocyte

组别GroupOD450nmOD450nmvalue增殖指数(SI)Proliferationindex(SI)细胞对照0.2522±0.0072—5μg·mL-1IL⁃40.2562±0.00301.015910μg·mL-1IL⁃40.2678±0.0049∗∗1.061920μg·mL-1IL⁃40.2598±0.0050∗1.030140μg·mL-1IL⁃40.2491±0.00290.9877pET32a空载体蛋白质0.2550±0.00821.0111ConA单独刺激0.5235±0.0078∗∗2.07571640培养液0.0000±0.0000—
表3 VSV致细胞病变结果
Table 3 Cytopathic effect caused by VSV
表4 重组蛋白质IFN-γ抗VSV活性测定
Table 4 Recombinant protein IFN-γ inhibited cytopathogenic effect in VSV

IFN⁃γ稀释度DilutionofIFN⁃γ(10×)接种细胞孔数Numberofinoculation出现CPE孔WellswithCPE不出现CPE孔WellswithoutCPE累计总数Total有CPE孔WellswithCPE无CPE孔WellswithoutCPE细胞孔总数Totalwells细胞病变保护率/%CPErestrainrate2180803232100228171242596238263172085248356111764.71258441061637.50268621621811.112788024024028880320320攻毒对照8808080阴性对照808088100
2.3 重组细胞因子对口蹄疫抗体水平的增强效果
采用口蹄疫O型液相阻断ELISA抗体检测试剂盒检测重组蛋白质IL-2、IL-4、IFN-γ的免疫增强作用。结果如图2所示,可知免疫后第0—30天,各疫苗免疫组O型口蹄疫抗体水平有明显的上升,其中第14—30天,IL-2组、IFN-γ组与疫苗对照组、空载体蛋白质组相比,差异极显着(P<0.01),且IL-2组抗体上升水平略高于IFN-γ组;而IL-4组在免疫后第30天的检测结果显示其不仅不能促进抗体的产生,反而抑制其产生(P<0.01);空载体蛋白质组与疫苗对照组相比,抗体水平差异不显着(P>0.05)。在免疫后第30天,各免疫组的口蹄疫抗体水平开始下降,但IL-2组的抗体下降水平低于空载体蛋白质组与疫苗对照组。

试验组与同一时间疫苗对照组之间,*.P<0.05;**.P<0.01。下图同Between the experimental group and the vaccine control group at the same time,*.P<0.05;**.P<0.01.The same as below图2 不同免疫组抗O型FMD抗体滴度变化Fig.2 Changes of antibody titers against serotype O in different groups after immunization
2.4 细胞因子重组蛋白质对仔猪血清细胞因子含量变化的影响
2.4.1 细胞因子重组蛋白质对仔猪血清细胞因子IL-4含量变化的影响 免疫仔猪血清IL-4的检测结果如图3A所示,仔猪免疫后第14、30天,各免疫组与免疫前相比,均检测到IL-4水平的上升,且差异极显着(P<0.01),免疫前各组IL-4含量差异不显着(P>0.05)。免疫后第14天检测结果表明,IL-4组的IL-4水平显着高于疫苗对照组(P<0.05),而其余各免疫组与疫苗对照组相比,差异不显着(P>0.05)。免疫后第30天,IL-2组与疫苗对照组相比,IL-4浓度降低,差异显着(P<0.05);IFN-γ组与疫苗对照组相比,IL-4水平也降低,且差异极显着(P<0.01)。
2.4.2 细胞因子重组蛋白质对仔猪血清细胞因子IL-10含量变化的影响 免疫仔猪血清IL-10的检测结果如图3B所示,仔猪免疫后第14天,各免疫组与免疫前相比,均检测到IL-10水平的上升,在第14天时浓度达到最高值,随后浓度开始降低,且差异显着(P<0.05),免疫后第30天,疫苗组、IL-4组与免疫前相比差异显着,而IL-2组、IFN-γ组、空载体蛋白质组与免疫前相比差异不显着(P>0.05),且免疫第0天各组IL-10水平差异不显着。免疫后第14天检测结果表明,各免疫组间IL-10含量差异不显着(P>0.05)。免疫后第30天,仅IL-4组的IL-10含量显着高于疫苗对照组(P<0.05)。
2.4.3 细胞因子重组蛋白质对仔猪血清细胞因子IL-17含量变化的影响 免疫仔猪血清IL-17的检测结果如图3C所示,仔猪免疫后第14、30天,各免疫组与免疫前相比,IL-17含量差异不显着(P>0.05),各免疫组IL-2、IL-4及空载体蛋白质组与疫苗对照组相比差异不显着(P>0.05),仅IFN-γ组在第30天检测结果与疫苗对照组相比,差异显着(P<0.05)。由图可看到IL-4组及IFN-γ组在第30天检测到IL-17浓度的降低。
2.4.4 细胞因子重组蛋白质对仔猪血清细胞因子IFN-γ含量变化的影响 免疫仔猪血清IFN-γ的检测结果如图3D所示,仔猪免疫后第14、30天,各免疫组与免疫前相比,均检测到血清IFN-γ水平的上升,且差异极显着(P<0.01),免疫第0天,各组之间IFN-γ含量差异不显着(P>0.05)。免疫后第14天的检测结果表明,各免疫组IL-2、IL-4、IFN-γ与疫苗对照组相比,IFN-γ含量差异不显着(P>0.05)。免疫后第30天,IL-2组及IFN-γ组的IFN-γ水平均极显着高于疫苗对照组(P<0.01),而IL-4组及空载体蛋白质组与疫苗对照组相比,IFN-γ含量差异不显着(P>0.05)。
3 讨 论
细胞因子是动物体内特异高效调控免疫细胞和协调免疫应答最重要的信号分子,具有较强的免疫佐剂效应,既可增强抗原的免疫原性,又可作用于体内免疫细胞,促进其增殖、分化,加强其活性与功能,影响细胞内生物活性分子的表达与分泌。在本试验中,将经鉴定具有良好生物学活性的猪重组IL-2、IL-4和IFN-γ与口蹄疫疫苗联合免疫仔猪,结果表明重组细胞因子IL-2和IFN-γ能显着促进机体的免疫应答,增强口蹄疫抗体的产生,而IL-4不仅不能促进口蹄疫抗体产生,反而抑制机体的体液免疫应答。

图3 试验仔猪免疫后血清细胞因子含量变化Fig.3 Change of the content of cytokines in the sera of experimental pigs after vaccination
IL-2是重要的免疫调节因子,具有多种免疫调节作用,可以活化NK细胞、巨噬细胞,促进T细胞增殖分化和分泌细胞因子,促进B细胞增殖和分泌抗体[13-14],增强机体的细胞免疫和体液免疫功能。T细胞可分成两大亚群:即CD4+T细胞和CD8+T细胞。TH细胞是CD4+T细胞的一个重要亚群,在IL-2、IFN-γ等微环境中向TH1细胞分化,TH1细胞分泌的细胞因子如IL-2等可提供进行性信号,引起B细胞增殖、分化,形成浆细胞和记忆性B细胞,发生类转换,并分泌抗体[2]。H.T.Wong等[15]发现IL-2可增强机体对FMDV感染的免疫应答;Y.Lin等[16]发现猪IL-2重组蛋白质与伪狂犬病毒疫苗联用可以显着增强抗体的产生和CTL细胞活性;G.Rompato等[17]用IL-2质粒与PRRSV疫苗共同免疫猪时发现其可明显增强机体对PRRSV感染的细胞免疫和体液免疫的功能。CCK-8试剂盒检测结果证明本实验室制备的猪重组IL-2蛋白质具有良好的生物学活性,能显着刺激猪外周血淋巴细胞增殖。而重组蛋白质对FMDV抗体水平增强效果的结果也表明IL-2蛋白质能促进机体B细胞增殖和抗体生成,提高对疫苗的应答能力,与上述研究结果一致。在进行细胞因子检测时发现,IL-2组的IFN-γ含量相对高于疫苗对照组,而IL-4、IL-10含量相对降低,可能是因为IL-2可诱导TH细胞发生TH1型极化反应,促使TH1细胞分泌IL-2和IFN-γ,IL-2和IFN-γ可通过上调MHC-Ⅰ、MHC-Ⅱ类分子及黏膜分子的表达,促进CTL活化可产生大量IFN-γ,后者也可通过APC分泌IL-2。
IL-4是1982年发现的具有多种生物学活性的细胞因子,主要由活化的T细胞、单核细胞分泌,肥大细胞和嗜碱性粒细胞也可合成分泌。IL-4在调节T、B淋巴细胞的分化、活化,促进以TH2细胞为特征的免疫应答过程中发挥重要作用。现有研究表明,猪IL-4不同于鼠和人的IL-4,不但不能诱导和刺激B细胞的增殖,而且抑制抗体的产生和IL-6的分泌[9,18];G.Rompato等[17]也发现用IL-4质粒与PRRSV DNA疫苗联用时发现猪IL-4不能促进机体对PRRSV感染的应答,反而抑制机体抗体的产生。IL-4、TNF、lipopolysaccharide(LPS)等均能诱导猪IL-4的合成[19]。本试验中用CCK-8试剂盒检测IL-4促猪淋巴细胞增殖差异显着可能是由于猪IL-4不能刺激T细胞增殖,但能诱导细胞的生长且呈现剂量依赖性关系,而对于B细胞可能是猪IL-4不能传递增殖信号却递呈了生存信号,能够短暂刺激细胞的分裂[9]。本试验的疫苗佐剂效应结果与上述报道一致,发现猪IL-4重组蛋白质与口蹄疫疫苗共同免疫猪后不能促进机体免疫应答和抗体产生。目前,对于IL-4抑制免疫应答的机制仍不明确,有报道阐释是IL-4作用于树突状细胞(DC)的基部而减弱溶细胞性T细胞的应答,IL-4阻止抗原刺激白细胞毒性前体物质促树突细胞分化的过程,从而影响DC对CD8+T细胞的活化。该调节的分子基础DC表面的B7-1/B7-2,研究发现B7-2能诱使CD8+T细胞扩增,B7-1控制其溶细胞活性的获得[20];也有猜想认为猪IL-13有与其他种属动物IL-4相似的功能[21],这两基因位于同一染色体上,而且鼠IL-4基因的转录因子结合部位与猪IL-13基因转录因子结合部位相似,鼠IL-13基因的转录因子结合部位与猪IL-4基因转录因子结合部位相似[9]。
IFN-γ是一种具有抗病毒、抗肿瘤和免疫调节作用的细胞因子,主要由活化的T细胞和NK细胞产生,在机体免疫系统中发挥重要作用,其生物学效应具有高度的种属特异性。IFN-γ是体内重要的免疫调节因子,以上调MHC分子的表达,促进抗原递呈为最主要的免疫调节活性,增强APC与T细胞相互作用;还可通过增强巨噬细胞表面表达Fc受体,有利于对抗原的吞噬,K、NK细胞对靶细胞的杀伤以及T、B淋巴细胞的激活,增强机体免疫应答能力;IFN-γ不仅是TH1分泌的效应因子,而且对TH1/ TH2分化具有重要调节作用,可以促使CD4+TH细胞向TH1细胞的极化,并刺激IL-2、IL-12、TNF-α等细胞因子的上调,起到免疫系统活化的效果[22]。因此,IFN-γ成为新型免疫佐剂中的研究热点。G.M.Liu等[6]研究发现用构建的重组质粒PCV2-ORF2-IFN-γ免疫小鼠后可促进机体PCV2-ORF2特异性抗体的产生;Y.P.Wang等[23]也发现IFN-γ质粒与PCV2-Cap 蛋白质共免疫可增强机体的抗体水平和淋巴细胞的增殖;A.Summerfield等[24]研究发现,FMDV对干扰素很敏感,IFN-α对动物机体和细胞的FMDV有明显的抑制效应,IFN-γ能活化NK细胞和巨噬细胞,阻止病毒复制;M.P.Moraes等[25]和S.M.Kim等[26]也先后证实Ⅰ型和Ⅱ型干扰素的协同使用能抑制FMDV的复制,增强机体对FMDV感染的免疫应答。本试验中IFN-γ重组蛋白质抗VSV活性结果表明制备的IFN-γ蛋白质具有较强的抗病毒作用,其主要是通过诱导一些目的基因的表达来实现的,这些目的基因表达产物主要是一些参与病毒RNA降解和剪切的酶或蛋白质。IFN-γ对口蹄疫疫苗免疫增强效果的结果也与上述报道一致,说明IFN-γ可特异性地增强机体免疫应答,使机体获得有效的保护。细胞因子检测结果发现IFN-γ组IL-17含量的下降可能是由于IFN-γ可以干扰TGF-β1诱导的TH17细胞分化过程[27],同时检测到IL-4含量的下降可能是由于干扰素通过抑制STAT6活性来减少IL-4基因表达[28]。
细胞因子是重要的免疫调节分子,各种细胞借助于自己分泌的细胞因子实现各自的功能,细胞因子水平的高低,可以直接或间接反映免疫细胞或免疫应答状态[29]。然而,静息期细胞通常不表达细胞因子,细胞因子的产生,有赖于抗原的刺激,刺激消失,细胞因子的分泌也逐渐停止,其作用也逐步减弱[30]。本研究中,分别于免疫后第14、30天检测细胞因子水平,目的是为了观察免疫应答状态。结果发现,免疫后第14天和30天细胞因子水平依然较高,说明疫苗抗原在动物体内存在时间较长,能够在较长时间内诱导免疫应答。
4 结 论
猪重组细胞因子IL-2和IFN-γ作为免疫佐剂与口蹄疫疫苗联合免疫后能够显着加强机体的体液免疫和细胞免疫应答,这为研究新型高效安全的免疫增强剂提供了依据,而对IL-4抑制机体抗体产生的机制还需进一步研究。
[1] KULLBERG B J.Trends in immunotherapy of fungal infections[J].EurJClinMicrobiolInfectDis,1997,16(1):51-55.
[2] 杨汉春.动物免疫学[M].2版.北京:中国农业大学出版社,2003:95-107. YANG H C.Animal immunology[M].2nd edition.Beijing:China Agricultural University Press,2003:95-107.(in Chinese)
[3] DU Y J,LU Y,WANG X L,et al.Highly efficient expression of interleukin-2 under the control of rabbit β-globin intron II gene enhances protective immune responses of porcine reproductive and respiratory syndrome (PRRS) DNA vaccine in pigs[J].PLoSOne,2014,9(3):e90326.
[4] SHAH M A,XU L X,YAN R F,et al.Cross immunity of DNA vaccine pVAX1-cSZ2-IL-2 toEimeriatenella,E.necatrixandE.maxima[J].ExpParasitol,2010,124(3):330-333.
[5] CHEN G H,ZENG S,JIA H J,et al.Adjuvant effect enhancement of porcine interleukin-2 packaged into solid lipid nanoparticles[J].ResVetSci,2014,96(1):62-68.
[6] LIU G M,LUO M L,CHEN R A,et al.Construction and immunogenicity of recombinant adenovirus expressing ORF2 of PCV2 and porcine IFN gamma[J].Vaccine,2011,29(47):8677-8682.
[7] GRAHAM S P,HAINES F J,JOHNS H L,et al.Characterisation of vaccine-induced,broadly cross-reactive IFN-γ secreting T cell responses that correlate with rapid protection against classical swine fever virus[J].Vaccine,2012,30(17):2742-2748.
[8] KOCHENDERFER J N,CHIEN C D,SIMPSON J L,et al.Maximizing CD8+T cell responses elicited by peptide vaccines containing CpG oligodeoxynucleotides[J].ClinImmunol,2007,124(2):119-130.
[9] MURTAUGH M P,JOHNSON C R,ZHENG G X,et al.Species specialization in cytokine biology:Is interleukin-4 central to the TH1-TH2 paradigm in swine?[J].DevCompImmunol,2009,33(3):344-352.
[10] SILVÉRIO S C,MOREIRA S,MILAGRES A M,et al.Interference of some aqueous two-phase system phase-forming components in protein determination by the Bradford method[J].AnalBiochem,2012,421(2):719-724.
[11] 朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2000:151-169. ZHU L P,CHEN X Q.Immunology experimental methods[M].Beijing:People Military Medical Press,2000:151-169.(in Chinese)
[12] 殷 震,刘景华.动物病毒学[M].北京:科学出版社,1997:323-437. YIN Z,LIU J H.Animal virology[M].Beijing:Science Press,1997:323-437.(in Chinese)
[13] MALEK T R.The biology of interleukin-2[J].AnnuRevImmunol,2008,26:453-479.
[14] BOYMAN O,SPRENT J.The role of interleukin-2 during homeostasis and activation of the immune system[J].NatRevImmunol,2012,12(3):180-190.
[15] WONG H T,CHENG S C,SIN F W,et al.A DNA vaccine against foot-and-mouth disease elicits an immune response in swine which is enhanced by co-administration with interleukin-2[J].Vaccine,2002,20 (21-22):2641-2647.
[16] LIN Y,HE Q G,YU X L,et al.The co-administrating of recombinant porcine IL-2 could enhance protective immune responses to PRV inactivated vaccine in pigs[J].Vaccine,2005,23(35):4436-4441.
[17] ROMPATO G,LING E,CHEN Z,et al.Positive inductive effect of IL-2 on virus-specific cellular responses elicited by a PRRSV-ORF7 DNA vaccine in swine[J].VetImmunolImmunopathol,2006,109(1-2):151-160.
[18] NUNTAPRASERT A,MORI Y,MUNETA Y,et al.The effect of recombinant swine interleukin-4 on swine immune cells and on pro-inflammatory cytokine productions in pigs[J].CompImmunolMicrobiolInfectDis,2005,28(2):83-101.
[19] NUNTAPRASERT A,MORI Y,FUJITA K,et al.Characterization of specific antibodies and the establishment of sandwich ELISA and ELISPOT systems for swine IL-4[J].CompImmunolMicrobiolInfectDis,2004,27(6):457-470.
[20] KING C,MUELLER HOENGER R,MALO CLEARY M,et al.Interleukin-4 acts at the locus of the antigen-presenting dentritic cell to counter-regulate cytotocxic CD8+T-cell responses[J].NatMed,2001,7(2):206-214.
[21] BAUTISTA E M,NFON C,FERMAN G S,et al.IL-13 replaces IL-4 in development of monocyte derived dentritic cells (MoDC) of swine[J].VetImmunolImmunopathol,2007,115(1-2):56-67.
[22] 窦永喜.猪IFN-γ及其受体的生物学功能研究[D].北京:中国农业科学院,2008. DOU Y X.The study of porcine interferon-gamma and its receptor biological functions[D].Beijing:The Chinese Academy of Agricultural Sciences,2008.(in Chinese)
[23] WANG Y P,LIU D,GUO L J,et al.Enhanced protective immune response to PCV2 subunit vaccine by co-administration of recombinant porcine IFN-γ in mice[J].Vaccine,2013,31(5):833-838.
[24] SUMMERFIELD A,GUZYLACK-PIRIOU L,HARWOOD L,et al.Innate immune responses against foot-and-mouth disease virus:current understanding and future directions[J].VetImmunolImmunopathol,2009,128(1-3):205-210.
[25] MORAES M P,DE LOS SANTOS T,KOSTER M,et al.Enhanced antiviral activity against foot-and-mouth disease virus by a combination of type I and II porcine interferons[J].JVirol,2007,81(13):7124-7135.
[26] KIM S M,KIM S K,PARK J H,et al.A recombinant adenovirus bicistronically expressing porcine interferon-α and interferon-γ enhances antiviral effects against foot-and-mouth disease virus[J].AntiviralRes,2014,104:52-58.
[27] WAHL S M,WEN J,MOUTSOPOULOS N,et al.TGF-β:a mobile purveyor of immune privilege[J].ImmunolRev,2006,213:213-227.
[28] DICKENSHEETS H L,DONNELLY R P.Inhibition of IL-4-inducible gene expression in human monocytes by type I and type II interferons[J].JLeukocBiol,1999,65(3):307-312.
[29] STENKEN J A,POSCHENRIEDER A J.Bioanalytical chemistry of cytokines-a review[J].AnalChimActa,2015,853:95-115.
[30] OCHOLA L A,AYIEKO C,KISIA L.Changes in antigen-specific cytokine and chemokine responses to Plasmodium falciparum antigens in a highland area of Kenya after a prolonged absence of malaria exposure[J].InfectImmun,2014,82(9):3775-3782.
(编辑 白永平)
Immunological Enhancement of Recombinant Porcine IL-2,IL-4 and IFN-γ on Foot-and-mouth Disease Synthetic Peptide Vaccine
TU Hao1,ZHAO Xing-can2,YANG Zhan-na1,LI Meng-hui1,XU Li-xin1, YAN Ruo-feng1,SONG Xiao-kai1,LI Xiang-rui1*
(1.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China; 2.CenterforAnimalDiseaseControlandPreventionofLuoyangCity,Luoyang471002,China)
The current study was undertaken to certify the immunological adjuvant effect of recombinant IL-2,IL-4 and IFN-γ of porcine on the foot-and-mouth disease synthetic peptide vaccine.The changes of antibody and IL-4,IL-10,IL-17 and IFN-γ levels of porcines injected with synthetic peptide vaccine against foot-and-mouth disease and recombinant IL-2,IL-4 and IFN-γ of porcine,respectively.The results showed that the recombinant protein we made all had good biological activity.IL-2 and IFN-γ protein significantly increased the level of antibody against foot-and-mouth disease (P<0.01),while IL-4 appeared to have a suppressive effect (P<0.01).Recombinant IL-4 significantly enhanced IL-4 and IL-10 secretions compared with that of the vaccine control group (P<0.05).The IL-2 and IFN-γ could significantly stimulate the production of IFN-γ (P<0.01).These results indicated that IL-2 and IFN-γ of porcine could significantly enhance the immune response against FMDV respectively.
recombinant protein;IL-2;IL-4;IFN-γ;adjuvant effect;foot-and-mouth disease
10.11843/j.issn.0366-6964.2015.08.015
2014-11-17
十二五“863”计划(2011AA10A211)家畜口蹄疫新型疫苗研制与生产工艺创新子课题偶蹄动物用新型免疫佐剂创新与产业化和江苏省优势学科项目(PAPD)资助
涂 浩(1990-),男,安徽舒城人,硕士,主要从事动物细胞因子克隆与应用研究,E-mail:2012107053@njau.edu.cn
*通信作者:李祥瑞,教授,博士生导师,主要从事寄生虫分子与免疫、动物细胞因子的基因克隆与应用和兽医公共卫生研究,Tel:025-84399000,E-mail:lixiangrui@njau.edu.cn
S858.285.3
A
0366-6964(2015)08-1390-10



