胡庭溪,刘 霞,孙尉峻,郝海生,赵学明,王宗礼,杜卫华*,朱化彬
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.甘肃农业大学动物科学技术学院,兰州730070)
精子动力学分析与其体内、体外受精能力的相关性
胡庭溪1,2,刘霞1,孙尉峻1,郝海生1,赵学明1,王宗礼2,杜卫华1*,朱化彬1
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.甘肃农业大学动物科学技术学院,兰州730070)
旨在通过对精子动力学参数的分析,预测其在体外受精和人工授精中的受精能力。本研究采用计算机辅助精子分析系统(CASA)对3头荷斯坦公牛的性控分离精子进行动力学检测;同时进行体外受精和人工授精试验,统计体外受精的受精率、卵裂率、囊胚率、囊胚细胞数(TCN)、内细胞团细胞数/囊胚细胞数比例(ICM/TCN)和人工授精妊娠率。结果发现,精子的路径速度(102.82、91.55、80.67)、曲线速度(201.75、180.23、168.58)、侧摆幅度(9.33、8.31、7.42)在公牛A、B、C间呈显着差异(P<0.05),并与其体外受精过程中的受精率、胚胎卵裂率呈显着正相关。公牛A精子的鞭打频率(20.36)、直线性(46.06)显着高于公牛B(18.05、42.00)、C(16.23、40.81),且与体外受精的囊胚率呈显着正相关(P<0.05)。公牛A、B精子的活力(38.00、36.50)、直线速度(80.62、79.00)显着高于公牛C(29.00、68.20),该参数与ICM/TCN呈正相关(P<0.05)。然而精子动力学的所有参数均与人工授精的妊娠率之间无相关性。综上表明,精子的动力学参数可以预测体外受精中公牛的受精能力,但对其人工授精结果的预测还需要进一步研究。
性控精子;动力学分析;体外受精;人工授精
应用性控冻精进行人工授精,是快速扩繁奶牛和肉牛的有效途径之一。然而在实际生产中,性控精液存在精子数较少,精子质量以及其受精能力普遍偏低等缺点。据报道在分离和冷冻过程中受到染色孵育、高倍稀释、分离中的机械力、紫外线照射、高压、离心以及冷冻解冻等多种外在因素的作用下产生活性氧(Reactive oxygen species,ROS)[1],从而对精子线粒体膜电位,DNA完整性以及质膜结构造成一定程度的损伤[2],导致精子的运动性能和受精能力降低,形态和顶体状态发生改变[3]。因此,在人工授精前预测性控精子的受精能力有着至关重要的意义。
传统方法通过测定活力、密度、pH、受精率、未返情率以及受胎率来进行种公牛受精能力的预测[4],但是上述某些方法中存在检测周期较长,过程繁琐,检测人员的主观判断对结果的影响较大。对于未返情率、受精率以及受胎率来说,母畜所处环境、饲养条件和激素分泌水平等都会对结果造成严重影响。
计算机辅助分析(Computer-assisted sperm analysis,CASA)是结合计算机技术与图像处理技术应用于精子动力学参数分析,通过对精子头部运动图像的捕捉,采集精子运动轨迹并进行快速、动态处理分析,从而检测精子质量。CASA分析仪测定的精子动力学参数的量化数据包括直线速度侧摆幅度(ALH)、直线速度(VSL)、鞭打频率(BCF)、曲线速度(VCL)、前向性(STR)、路径速度(VAP)、直线性(LIN)、摆动性(WOB)等。研究表明,CASA一致性与可重复性均优于传统精子检测方法,能快速准确地测定精子的活率、活力、密度等参数同时还可以提供描述精子运动状态的多种参数[5]。本研究将3头种公牛性控精子的CASA分析、体外受精以及人工授精的结果相结合,以期寻找一种简单、高效的方法进行种公牛受精能力评估,为今后奶牛人工授精过程中种公牛的选择提供试验依据。
1 材料与方法
1.1试验材料
选择年龄基本相同、体重相近、健康状况良好的3头荷斯坦种公牛,编号:607H08398(A)、614H005042(B)、614H004670(C)。参配母牛则选择14~17月龄育成牛,体况较好,膘情中等,正常发情,生殖系统正常,无繁殖疾病的荷斯坦奶牛。3头种公牛的精液均是采精当天进行性别分离,并分装后冷冻保存于液氮中。然后,于一周内运至实验室,解冻后进行动力学参数测定;2个月内完成体外受精和人工授精试验。
1.2试剂和仪器
除特殊说明外,本研究所有试剂均购于西格玛奥德里奇贸易有限公司(上海)。流式细胞仪(EPICS®ALTRATM,美国);计算机辅助精子分析系统(CASA,Hamilton Thorne,美国);精子计数板(LEJA,荷兰);荧光倒置显微镜(尼康,日本);CO2培养箱(Forma,美国)。
1.3精液的分离和冷冻
对于3头公牛,分别吸取一定量精液原液待分离,用Hepes缓冲液稀释将原液稀释至2×108个·mL-1,向精子稀释液中加入0.1 mmol·L-1H33342,将稀释液置于34 ℃水浴中染色45 min,用含有5%食品红和4%卵黄的Hepes缓冲液将浓度稀释至1×108个·mL-1,用流式细胞仪进行精子分离与回收,将分离出的X-精子用Hepes缓冲液将精子密度调整为1×107个·mL-1。装入0.25 mL冻精管中,采用常规精液的冷冻方法冷冻后,置于液氮中保存。
1.4精子动力学参数分析
应用CASA系统对3头公牛个体的性控分离精子进行动力学参数检测。将性控冻精细管从液氮中取出后投入38 ℃水浴锅中解冻。吹打混匀后取100 μL进行检测。参数包括活力、VAP(μm·s-1)、ALH(μm·s-1)、VSL(μm·s-1)、VCL(μm·s-1)、STR(%)、LIN(%)、BCF(次数·s-1)。每支精液重复检测3次以上。
1.5牛卵母细胞体外成熟培养
将屠宰场采集的牛卵巢置于37 ℃生理盐水中保存,2~3 h内送达实验室。使用真空泵收集牛卵丘-卵母细胞复合体(Cumulus-oocyte complexes,COCs)。卵巢用37 ℃添加适量链霉素和青霉素的无菌生理盐水洗涤3次。用真空蠕动泵抽取卵巢表面直径为2~8 mm卵泡中的卵泡液。将3层以上卵丘细胞的COCs洗涤2次后,用38.5 ℃预热的成熟液洗涤2次,放入平衡2 h成熟液中(750 μL成熟液培养50枚COCs)。在5% CO2、38.5 ℃和饱和湿度的条件下成熟培养22~24 h。
1.6性控精液的体外受精和胚胎的体外培养
取3头公牛性控精液,在38 ℃水浴解冻后,将精液于适量洗精液中洗涤2次,800 g离心5 min,弃上清液;加入受精液将精子密度调整为1×106个·mL-1,将95 μL已混匀精子加入至5 μL受精液中,形成100 μL受精滴。将体外成熟22~24 h的COCs用0.25%透明质酸酶消化1 min,加入终止液终止消化反应。终止液洗涤2次后移入受精液洗涤1次,吸取含有2~3层颗粒细胞的COCs,放入受精滴中(100 μL受精液培养30枚COCs)。精卵共孵育8 h。COCs在适量mCRlaa液中充分洗涤,去除卵母细胞周围的卵丘细胞及精子,于100 μL mCRlaa微滴中培养。48 h后,更换为mCRlaa + 10%FBS培养液,之后每隔1天半量换液。体外培养48 h,统计各组卵裂胚胎个数,计算卵裂率;培养7~8 d后,统计各组囊胚数,计算囊胚率。
1.7受精率的检测
将体外成熟8 h的卵母细胞用0.25%透明质酸酶消化2 min,去除卵母细胞周围的卵丘细胞及精子。在5% BSA-PBS中洗2遍,于0.1 mmol·L-1H33342中室温孵育15 min,移至5% BSA-PBS中洗2遍,置于荧光倒置显微镜下观察,拍照。卵母细胞中有1个原核的为未受精,有2个原核的为正常受精,2个以上原核的为多精受精。最后统计受精率(两个原核的卵母细胞数/检测的卵母细胞总数),每头公牛取60枚卵母细胞进行检测,分为3组,每组20枚。
1.8囊胚差异染色
培养7 d后获得的囊胚用37 ℃、0.5% BSA-
PBS洗涤3次。置于2%多聚甲醛中固定20 min,于20 μL通透液(0.5% Triton X-100和0.05% Tween-20溶于PBS溶液)中室温孵育30 min。经通透处理的囊胚于0.5%BSA-PBS中洗涤3次,取出囊胚,在1 mol·L-1HCL中室温处理30 min,然后迅速转移至100 mmol·L-1TrisHCL中,室温处理20 min。置于0.5% BSA-PBS中洗涤3次,将囊胚移至封闭液(10%山羊血清和0.05%Tween-20溶于PBS溶液)中,4 ℃封闭过夜。将囊胚置于1∶500用封闭液稀释的一抗(鼠抗人CDX2抗体)中,37 ℃培养箱中孵育2 h;于0.5% BSA-PBS中洗涤3次,放入1∶500用封闭液稀释的二抗(羊抗鼠Alexa Fluor 488抗体)中,室温避光孵育2 h。移入0.5% BSA-PBS清洗囊胚3次,于20 μmol·L-1H33342中避光室温孵育10 min,囊胚于0.5% BSA-PBS中洗涤后压片,在荧光倒置显微镜下观察,拍照。在荧光显微镜下,蓝色为所有的囊胚细胞,红色为滋养层细胞。内细胞团细胞数(ICM)=囊胚细胞数(TCN)-滋养层细胞数(TE)。
1.9性控精液的人工授精
在10个牛场中共选择950头青年荷斯坦母牛。按照性控精液的输精方法,将3头公牛的性控精液进行人工授精。输精60 d后做直肠妊检,统计妊娠率。
1.10数据分析
统计囊胚细胞使用Photoshop CS 5(Adobe,美国)计数功能进行计数。数据统计使用SAS 9.2软件分析数据,百分数比较经反正弦转化后进行方差分析,试验结果为“平均数±标准差(SD)”,P<0.05为差异显着。
2 结 果
2.1性控精子的动力学参数分析
如表1所示,3头公牛精子的活力、VSL的差异显着性成相同的趋势,即公牛A精子的活力、VSL与公牛B差异不显着(P>0.05),但二者均显着高于公牛C(P<0.05);对于VCL、VAP、ALH参数,公牛A精子显着高于公牛B、C(P<0.05),而公牛B又显着高于公牛C(P<0.05)。公牛B、C精子间的BCF、LIN无显着差异(P>0.05),均显着低于公牛A(P<0.05)。3头公牛精子间的STR无显着差异(P>0.05)。
表1不同公牛精子的动力学参数
Table 1Kinetics parameters of sperm from different bulls
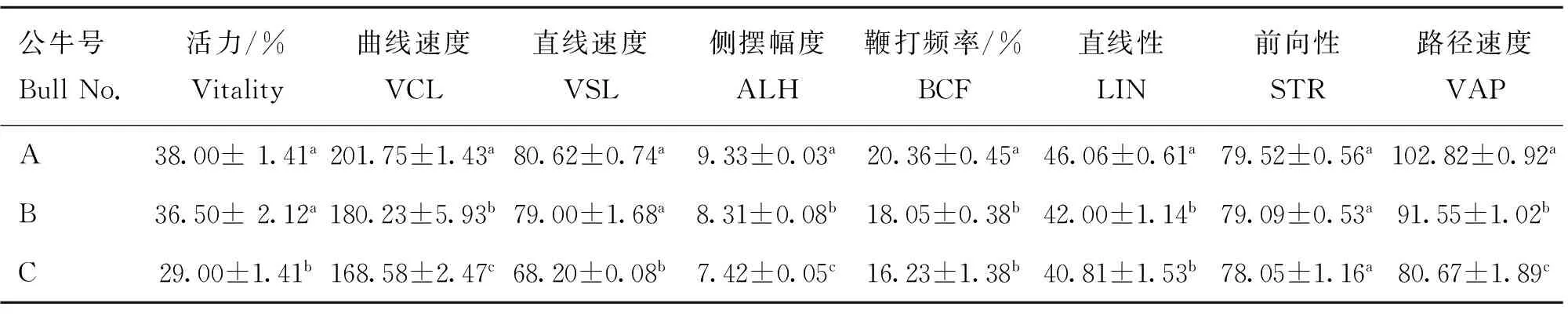
公牛号BullNo.活力/%Vitality曲线速度VCL直线速度VSL侧摆幅度ALH鞭打频率/%BCF直线性LIN前向性STR路径速度VAPA38.00±1.41a201.75±1.43a80.62±0.74a9.33±0.03a20.36±0.45a46.06±0.61a79.52±0.56a102.82±0.92aB36.50±2.12a180.23±5.93b79.00±1.68a8.31±0.08b18.05±0.38b42.00±1.14b79.09±0.53a91.55±1.02bC29.00±1.41b168.58±2.47c68.20±0.08b7.42±0.05c16.23±1.38b40.81±1.53b78.05±1.16a80.67±1.89c
肩标字母不同表示差异显着(P<0.05)。下同
Values with different superscripts within the same column differ significantly (P<0.05).The same as below
2.2性控精子受精率比较
如表2所示,对于性控分离精子体外受精的受精率,3头公牛间均呈现显着差异(P<0.05)。其中,公牛A精子的受精率最高(72.63%),公牛C的最低(43.57%)。
表2不同公牛精子的受精率
Table 2Fertilization rate of sorted sperm from different bulls during IVF
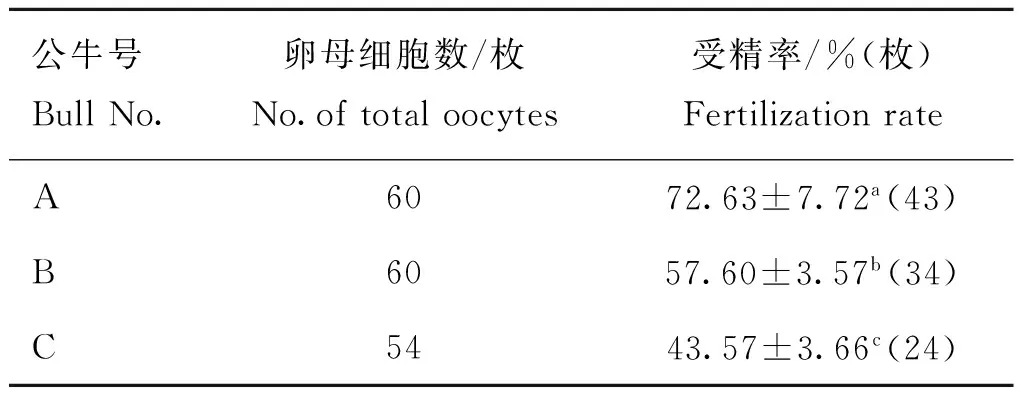
公牛号BullNo.卵母细胞数/枚No.oftotaloocytes受精率/%(枚)FertilizationrateA6072.63±7.72a(43)B6057.60±3.57b(34)C5443.57±3.66c(24)
2.3性控分离精子体外受精胚胎的体外发育
如表3所示,对于体外受精胚胎的卵裂率,3头公牛间均呈现显着差异(P<0.05)。其中公牛A最高(58.90%),公牛C的最低(40.00%)。对于囊胚率,公牛A精子的囊胚率(32.00%)显着高于公牛B、C(27.63%、25.77%)(P<0.05),而后两者间则无显着差异(P>0.05)。
表3不同公牛的性控精子对IVF胚胎体外发育的影响
Table 3Effect of sorted sperm from different bulls on development of bovine IVF
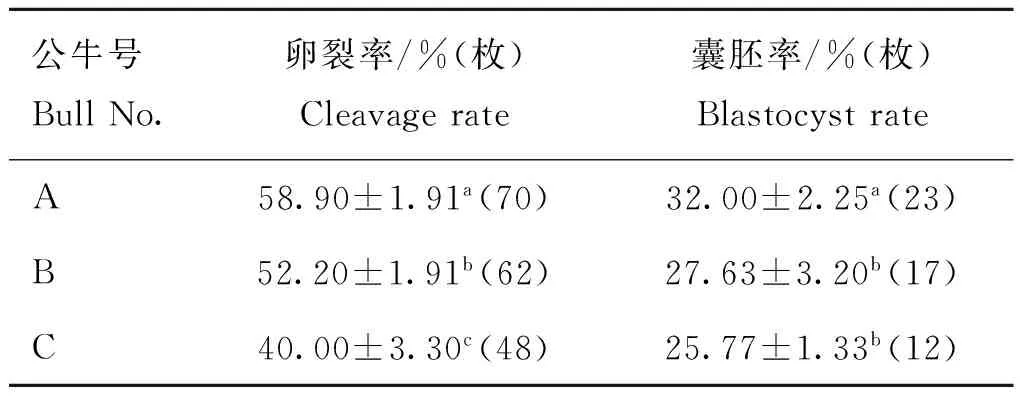
公牛号BullNo.卵裂率/%(枚)Cleavagerate囊胚率/%(枚)BlastocystrateA58.90±1.91a(70)32.00±2.25a(23)B52.20±1.91b(62)27.63±3.20b(17)C40.00±3.30c(48)25.77±1.33b(12)
卵母细胞数为120
No.of total oocytes is 120
2.4性控精子体外受精囊胚差异染色结果
如表4所示,公牛A精子获得的囊胚细胞数(115.33)显着高于公牛B、C(109.00、106.00)(P<0.05),后两者间差异不显着(P>0.05)。公牛A、B精子获得的囊胚内细胞团细胞数(30.00、26.00)差异不显着(P>0.05),均显着高于公牛C(19.00),(P<0.05)。而ICM/TCN在3头公牛间的差异显着性与内细胞团细胞数相同。
表4不同公牛的性控囊胚中ICM细胞数、囊胚细胞数及其比例
Table 4The ICM,TCN and ICM/TCN ratio of bovine blastocyst obtained from sorted sperm
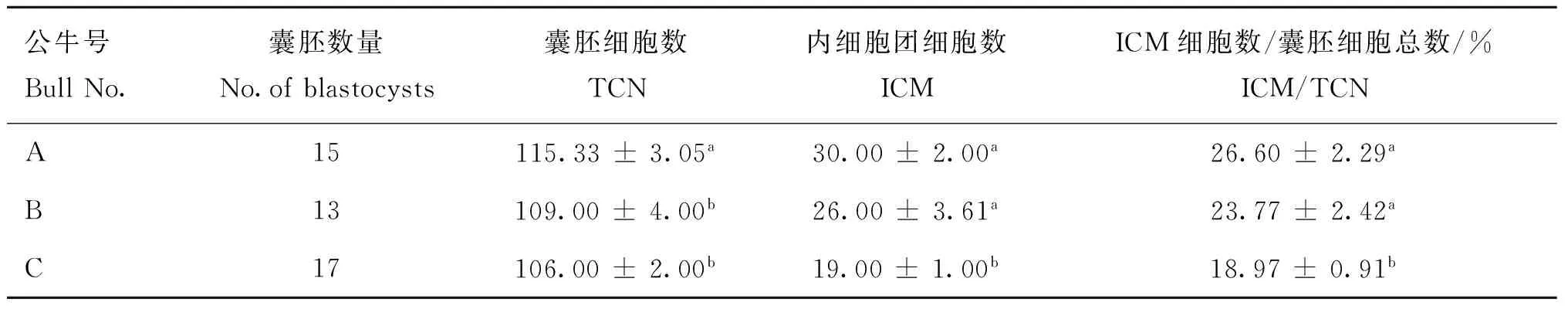
公牛号BullNo.囊胚数量No.ofblastocysts囊胚细胞数TCN内细胞团细胞数ICMICM细胞数/囊胚细胞总数/%ICM/TCNA15115.33±3.05a30.00±2.00a26.60±2.29aB13109.00±4.00b26.00±3.61a23.77±2.42aC17106.00±2.00b19.00±1.00b18.97±0.91b
2.5性控精液人工授精的结果
如表5所示,3头公牛的性控精液在人工受精后,受胎率间无显着差异。其中,公牛B精液的受胎率最高,公牛C最低。
表5不同公牛性控精液人工授精的结果
Table 5Pregnancy rate of sorted semen from different bulls in AI

公牛号BullNo.配种母牛头数No.ofinseminatedcows情期妊娠头数No.ofpregnantcows妊娠率/%PregnancyrateA1505939.3aB37717546.4aC42316037.8a
3 讨 论
本研究对3头公牛的精子活力、动力学参数进行检测,并与其在体内、体外环境下的受精能力及胚胎发育水平进行相关性分析。结果表明,精子的动力学参数与IVF胚胎发育具有相关性,而与AI受胎率没有相关性。精子的运动特性是反映其质量的有效指标之一[6],本研究中精子的动力学各参数均高于其它组的公牛A,其IVF受精率、胚胎卵裂率、囊胚率和囊胚细胞数均显着高于其它两组,可见精子运动能力强可保证其准确到达受精部位以穿透卵丘细胞和透明带[7]。3头公牛精子的VAP、VCL、ALH分别与其IVF受精率、胚胎的卵裂率具有显着的相关性,即VCL和VAP对卵裂率、受精率有显着影响[8];A.H.Ben也认为该参数与精子受精能力相关,可促进精卵结合[9]。另外,本研究3头公牛精子的LIN、BCF参数与其IVF胚胎的囊胚率呈正相关;动力学参数与AI受胎率间无相关性,A.Januskauskas等[10]和J.Ehlers等[11]也得到类似的结论;也有研究认为VLP、ALH、LIN与AI结果有显着的正相关性[12-15],其原因可能与测定的精子数、精液样本量、及AI操作人员的差异有关。
ICM/TCN是衡量囊胚质量的一个重要标志,与活力、VSL成正相关,即精子质量与其受精之后所获得的囊胚质量有密切关系,但相关报道较少,还需要进一步的深入研究。
目前,精子IVF受精率、胚胎卵裂率、囊胚率与AI受胎率的关系尚不明确,本研究认为二者无显着相关性。有关猪、牛的研究也认为,IVF结果与精液品质、AI结果均不一致[16-18]。也有研究认为IVF结果对预测AI结果有重要作用[19-20]。两种不同结果可能与各自体内、体外试验中的体系、环境、操作流程等因素有关,如精子在体外受精过程中极易与ROS反应发生脂质过氧化[21];而精液的洗涤去除精浆中所含的谷胱甘肽等抗氧化剂[22],使质膜及内部细胞器更易受到ROS攻击[23],因此对于不同的体系、操作流程和时间,ROS的损伤程度不同。此外,母牛自身状态对AI结果也有较大影响,所以这些因素都会导致AI结果无法预测。
4 结 论
随着国内养牛业的发展和对优质公牛需求的日益增加,利用现代化繁育技术快速扩繁良种公牛,加快种公牛精液性控分离和冷冻保存的研究是目前牛育种和繁殖工作的重点[24]。因而通过CASA分析性控分离精子的动力学参数来预测公牛的受精能力显得更为重要。人工授精过程中的影响因素较多,精子的动力学参数与人工授精妊娠率之间的相关性还需要进一步地研究。
[1]BATHGATE R.Functional integrity of sex-sorted,frozen-thawed boar sperm and its potential for artificial insemination[J].Theriogenology,2008,70 (8):1234-1241.
[2]KIM S H,YU D H,KIM Y J.Effects of cryopreservation on phosphatidylserine translocation,intracellular hydrogen peroxide,and DNA integrity in canine sperm[J].Theriogenology,2010,73 (3):282-292.
[3]GUTHRIE H D,WELCH G R.Effects of reactive oxygen species on sperm function[J].Theriogenology,2012,78 (8):1700-1708.
[4]UTT M D.Prediction of bull fertility[J].AnimReprodSci,2016,169:37-44.
[5]SILICH R C,MCSHERRY C K.Spermatic granuloma.An uncommon complication of the tension-free hernia repair[J].SurgEndosc,1996,10 (5):537-539.
[6]TAN O,HA T,CARR B R,et al.Predictive value of postwashed total progressively motile sperm count using CASA estimates in 6871 non-donor intrauterine insemination cycles[J].JAssistReprodGenet,2014,31(9):1147-1153.
[7]IBANESCU I,LEIDING C,CIORNEI S G,et al.Differences in CASA output according to the chamber type when analyzing frozen-thawed bull sperm[J].AnimReprodSci,2016,166:72-79.
[8]袁平庆,张哲欢,罗琛,等.计算机辅助精液分析精子运动参数在体外受精中的应用[J].南方医科大学学报,2013,33(3):448-450.
YUAN P Q,ZHANG Z H,LUO C,et al.Computer-assisted sperm analysis for assessing sperm mobility parameters ininvitrofertilization[J].JournalofSouthernMedicalUniversity,2013,33(3):448-450.(in Chinese)
[9]BEN A H.Relationship between the characteristics of the human sperm movement and their attachment to the zona pellucida[J].JGynecolObstetBiolReprod(Paris),2013,42(1):49-55.
[10]JANUSKAUSKAS A,GIL J,SÖDERQUIST L,et al.Effect of cooling rates on post-thaw sperm motility,membrane integrity,capacitation status and fertility of dairy bull semen used for artificial insemination in Sweden[J].Theriogenology,1999,52(4):641-658.
[11]EHLERS J,BEHR M,BOLLWEIN H,et al.Standardization of computer-assisted semen analysis using an e-learning application[J].Theriogenology,2011,76(3):448-454.
[13]OLIVEIRA L Z,DE ARRUDA R P,DE ANDRADE A F C,et al.Assessment of field fertility and severalinvitrosperm characteristics following the use of different Angus sires in a timed-AI program with suckled Nelore cows[J].LivestSci,2012,146(1):38-46.
[14]FARRELL P B,PRESICCE G A,BROCKETT C C,et al.Quantification of bull sperm characteristics measured by computer-assisted sperm analysis (CASA) and the relationship to fertility[J].Theriogenology,1998,49(4):871-879.
[15]HALLAP T,HÅÅRD M,JAAKMA U,et al.Does cleansing of frozen-thawed bull semen before assessment provide samples that relate better to potential fertility?[J].Theriogenology,2004,62(3-4):702-713.
[16]马红,王文涛,付博,等.精液品质及其体内和体外受精能力的相关性研究[J].畜牧与兽医,2012,44(3):27-30.
MA H,WANG W T,FU B,et al.Relationships among procine semen quality and fertilityinvitroandinvivo[J].AnimalHusbandryandVeterinary,2012,44(3):27-30.(in Chinese)
[17]WARD F,RIZOS D,CORRIDAN D,et al.Paternal influence on the time of first embryonic cleavage post insemination and the implications for subsequent bovine embryo developmentinvitroand fertilityinvivo[J].MolReprodDev,2001,60(1):47-55.
[18]PUGLISI R,BALDUZZI D,GALLI A.Invitrosperm penetration speed and its relationship withinvivobull fertility[J].ReprodDomestAnim,2004,39(6):424-428.
[19]ZHANG B R,LARSSON B,LUNDEHEIM N,et al.Relationship between embryo developmentinvitroand 56-day nonreturn rates of cows inseminated with frozen-thawed semen from dairy bulls[J].Theriogenology,1997,48(2):221-231.
[20]MORRIS L H,JOHNSON W H,LEIBO S P,et al.Relationship between the characteristics of frozen-thawed ram spermatozoa andinvitroembryo production[J].ReprodFertilDev,2001,13(2-3):193-201.
[21]GAZO I,SHALIUTINA-KOLEOVA,DIETRICH M A,et al.The effect of reactive oxygen species on motility parameters,DNA integrity,tyrosine phosphorylation and phosphatase activity of common carp (CyprinuscarpioL.) spermatozoa[J].MolReprodDev,2015,82(1):48-57.
[22]TATEMOTO H,MUTO N,SUNAGAWA I,et al.Protection of porcine oocytes against cell damage caused by oxidative stress duringinvitromaturation:role of superoxide dismutase activity in porcine follicular fluid[J].BiolReprod,2004,71(4):1150-1157.
[23]YESTE M,FLORES E,ESTRADA E,et al.Reduced glutathione and procaine hydrochloride protect the nucleoprotein structure of boar spermatozoa during freeze-thawing by stabilising disulfide bonds[J].ReprodFertilDev,2013,25(7):1036-1050.
[24]朱化彬,王皓宇,杜卫华,等.我国胚胎生物技术进展及其在良种牛扩繁中的应用[J].中国畜牧杂志,2014,50(2):61-67.
ZHU H B,WANG H Y,DU W H,et al.The proceedings of embryo biotechnologies and their use in cattle in China[J].ChineseJournalofAnimalScience,2014,50(2):61-67.(in Chinese)
(编辑程金华)
Correlation between Sperm Kinetics Parameters and Fertility of Holstein Sex-sorted Sperminvitroandinvivo
HU Ting-xi1,2,LIU Xia1,SUN Wei-jun1,HAO Hai-sheng1,ZHAO Xue-ming1,WANG Zong-li2,DU Wei-hua1*,ZHU Hua-bin1
(1.InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China;2.CollegeofAnimalScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China)
This study was performed to predict fertility of bull sperm duringinvitrofertilization (IVF) and artificial insemination (AI) according to its kinetics parameters.The sex-sorted sperm from 3 Holstein bulls were estimated with computer assisted sperm analysis system (CASA).Moreover,the IVF and AI with those sperm were carried out.The rate of fertilization,embryo cleavage,blastocyst formation and TCN,ICM/TCN of blastocyst obtained by IVF,conception rate during AI were counted and analyzed.Results showed that VAP (102.82vs91.55vs80.67),VCL (201.75vs180.23vs168.58),ALH (9.33vs8.31vs7.42) of sperm were significantly different among bull A,B,C (P<0.05).Additionally above 3 parameters were positively correlated with the fertilization rate,cleavage rate of IVF embryos.Sorted sperm from bull A had a significantly higher BCF (20.36vs18.05 & 16.23) and LIN (46.06vs42.00 & 40.81) than that from bull B,C (P<0.05).Also,the 2 parameters were positively correlated with blastocyst rate of IVF embryos.Vitality (29.00vs38.00 & 80.62),VSL (68.20vs36.50 & 79.00) of sperm from bull C were significantly lower than that from bull A and B (P<0.05),and had a positive correlation with ICM/TCN of blastocysts.However there was no correlation between the kinetics parameters and conception rate in AI.Conclusively,the fertility of sperm in IVF can be predicted by the kinetics analysis,but that prediction in AI requires further research.
sex-sorted sperm;kinetics analysis;fertilizationinvitro;artificial insemination
10.11843/j.issn.0366-6964.2016.08.026
2016-03-14
国家科技支撑项目(2012BAD12B01-2);家畜胚胎工程与繁殖创新团队(ASTIP-IAS06-2016);基本科研业务费重点项目(2013ywf-zd-2)
胡庭溪(1987-),男,辽宁沈阳人,博士生,主要从事动物遗传育种与繁殖研究,E-mail:htx19871005@126.com
杜卫华,博士,副研究员,E-mail:dwh@iascaas.net.cn
S823.3+4
A
0366-6964(2016)08-1727-06



