申小强,左玉柱,邸晶美,顾文源,范京惠
(河北农业大学动物医学院,保定 071001)
不同内吞方式中的关键因子抗体对树突状细胞捕获猪细小病毒样颗粒的影响
申小强,左玉柱*,邸晶美,顾文源,范京惠*
(河北农业大学动物医学院,保定 071001)
为了探明猪脾树突状细胞(DC)捕获猪细小病毒样颗粒的方式,通过磁性筛选的方法从猪的脾分离DC,DC与肌动蛋白抗体小窝蛋白caveolin-1抗体、猪IgG受体FcγRI(CD64)的抗体及DEC205抗体分别在37 ℃下作用1 h后,再与荧光素FITC标记的猪细小病毒样颗粒(FITC-PPV-VLPs-E290)在37 ℃下作用1 h,应用流式细胞仪及共聚焦显微镜检测体外DC对FITC-PPV-VLPs-E290的捕获情况。结果显示,经肌动蛋白抗体处理的DC几乎不能捕获FITC-PPV-VLPs-E290,经caveolin-1抗体处理的DC 对PPV-VLPs-E290的捕获效率明显下降。而CD64 及DEC205抗体则对DC的捕获效率无影响,表明DC对PPV-VLPs-E290的捕获依赖于肌动蛋白,与巨胞饮、小窝蛋白介导的内吞方式有关,而与吞噬作用及DEC205依赖的网格蛋白介导的方式无关。
病毒样颗粒;树突状细胞;捕获方式
病毒样颗粒(virus-like particles,VLPs)是含有某种病毒的一个或多个蛋白的空心颗粒,在结构上保留了天然病毒的空间构象和诱导中和抗体的抗原表位;且允许外源基因或基因片段插入而形成嵌合型VLPs,并将外源性抗原展示在其表面[1],既能激发体液免疫,又能激发细胞和黏膜免疫,可作为外源性抗原的转运系统[2],来设计携带不同抗原表位的嵌合VLPs。对PPV的相关研究表明,PPV的VP2核衣壳蛋白基因在体外表达后,可以自我组装成VLPs,用其免疫母猪能够使母猪抵御强毒的攻击[3],在 PPVVP2基因的N端插入外源基因(片段)不影响VLPs的形成,且形成的嵌合型VLPs可引起机体产生同时针对外源肽和载体的免疫反应,具有双重免疫效果,国内外学者利用PPV VP2蛋白基因的这一特点,分别构建了携带不同抗原表位的猪细小病毒样颗粒(PPV-VLPs),并证实了这些嵌合PPV-VLPs的良好免疫原性及其作为病毒样颗粒疫苗的广阔应用前景[4-6]。然而,嵌合型病毒样颗粒作为外源性抗原被提呈至MHC Ⅰ类分子途径,引发外源抗原表位特异性CTL反应的机制,目前并不明确。
我们以前的研究已经证实,PPV-VLPs-E290可被猪DC捕获,并定位于DC的晚期内吞体[7],为了进一步探明猪DC捕获携带外源抗原表位的猪细小病毒样颗粒的方式,本研究使用不同的抗体对DC捕获抗原的可能途径进行了研究,发现DC对PPV-VLPs的捕获与肌动蛋白、巨胞饮及小窝蛋白介导的方式有关,而与吞噬作用及网格蛋白介导的方式无关。
1 材料与方法
1.1材料
1.1.1实验动物经PCR 和ELISA 检测,CSFV及PPV核酸及其抗体均为阴性的仔猪。
1.1.2主要试剂Ficoll-Paque PREMIUM 1.084单核细胞分离液为GE Healthcare Life Science公司产品;anti-porcine CD172 antibody 及anti-porcine CD11R antibody为AbDSerotec公司产品;Rat anti-mouse IgG1 microbeads 及磁性分选器为Miltenyi Biotec产品;anti-caveolin-1 抗体、anti-DEC-205 抗体、anti-CD64 抗体及 anti-actin 抗体均为Abcam产品。
1.2方法
1.2.1DC及FITC-PPV-VLPs-E290的制备猪脾CD172a+CD11R+DC及FITC-PPV-VLPs-E290的制备按照文献[7]制备方法进行。
1.2.2DC对 PPV-VLPs-E290体外摄取效率分析为了确定DC在体外对 PPV-VLPs-E290的摄取效率,将制备的CD172a+CD11R+DC分别与10、20、30、40、50、60 μg 的FITC-PPV-VLPs-E290在37 ℃和0 ℃各孵育15 min、0.5 h、1 h、1.5 h。反应结束后,加入冷的PBS,350 g离心5 min,洗涤细胞,共洗涤3次,以去除未被摄取的FITC-PPV-VLPs-E290。取一部分细胞进行流式细胞仪分析,检测摄入FITC-PPV-VLPs-E290的DC比例。
1.2.3不同抗体对DC捕获 PPV-VLPs-E290的抑制分析未免疫猪的CD172a+CD11R+ DCs,先分别与小窝蛋白(caveolin-1)的抗体(3 μg·mL-1)、DEC-205抗体(2 μg·mL-1)、IgG受体CD64的抗体(5 μg·mL-1)、肌动蛋白抗体(2 μg·mL-1)、在37 ℃作用1 h后,加入FITC-PPV-VLPs-E290再孵育1 h,DC细胞经PBS洗涤3次后,一部分用共聚焦显微镜观察捕获FITC-PPV-VLPs-E290情况,一部分经流式细胞术检测FITC阳性细胞的比例,同时设立同种型抗体处理组及非处理的DCs作为对照。
2 结 果
2.1DC 对FITC-PPV-VLPs-E290的捕获效率分析
分别用10、20、30、40、50、60 μg的FITC-PPV-VLPs-E290,体外与DC在37 ℃共孵育1 h,流式细胞仪检测DC的摄取效率。结果显示,当DC与50 μg的FITC-PPV-VLPs-E290共孵育时,摄取效率最高(图1)。
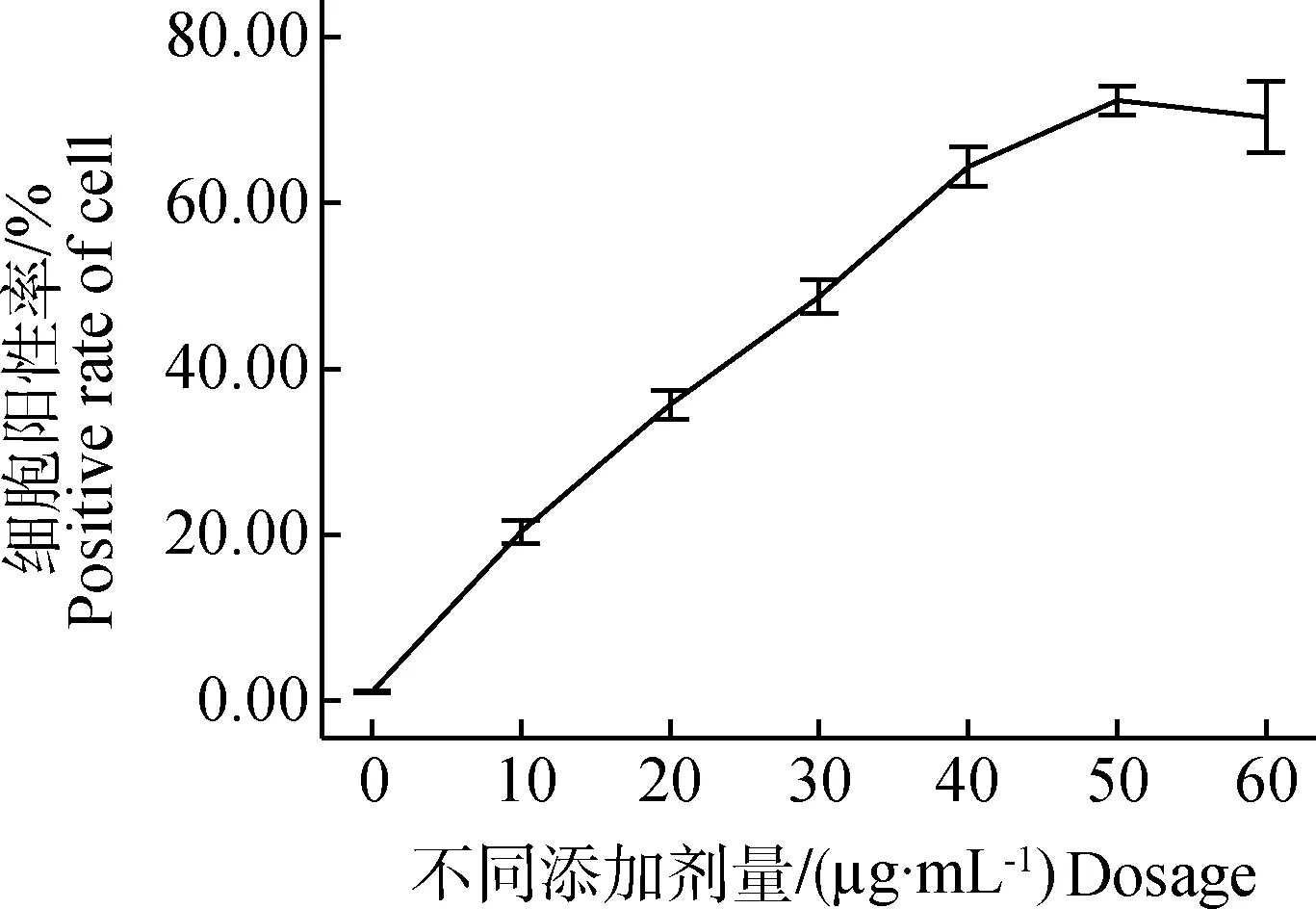
图1 不同剂量的FITC-PPV-VLPs-E290对DC的摄取效率影响检测Fig.1 Endocytosis ability analysis of DCs to diffrent amount of FITC-PPV-VLPs-E290
分别取与50 μg FITC-PPV-VLPs-E290在37 ℃共孵育15 min、0.5 h、1 h、1.5 h的DC,PBS洗涤后,流式细胞仪检测不同孵育时间对DC捕获FITC-PPV-VLPs-E290效率的影响。同时设立0 ℃反应的DC为对照。结果表明,DC在孵育0.5 h时,对FITC-PPV-VLPs-E290的摄取率为40%左右,孵育1 h时,摄取率达72%左右,之后随时间的增加,摄取率增加不明显(图2、3)。
2.2抗肌动蛋白抗体对DC内吞 PPV-VLPs-E290的抑制分析
抗肌动蛋白抗体与DC反应后,流式细胞仪检测及共聚焦显微镜观察,均显示与未处理组相比,FITC阳性细胞的比例明显下降,几乎降至空白对照细胞水平,表明肌动蛋白抗体能严重抑制DC捕
获PPV-VLPs-E290的效率(图4、5)。
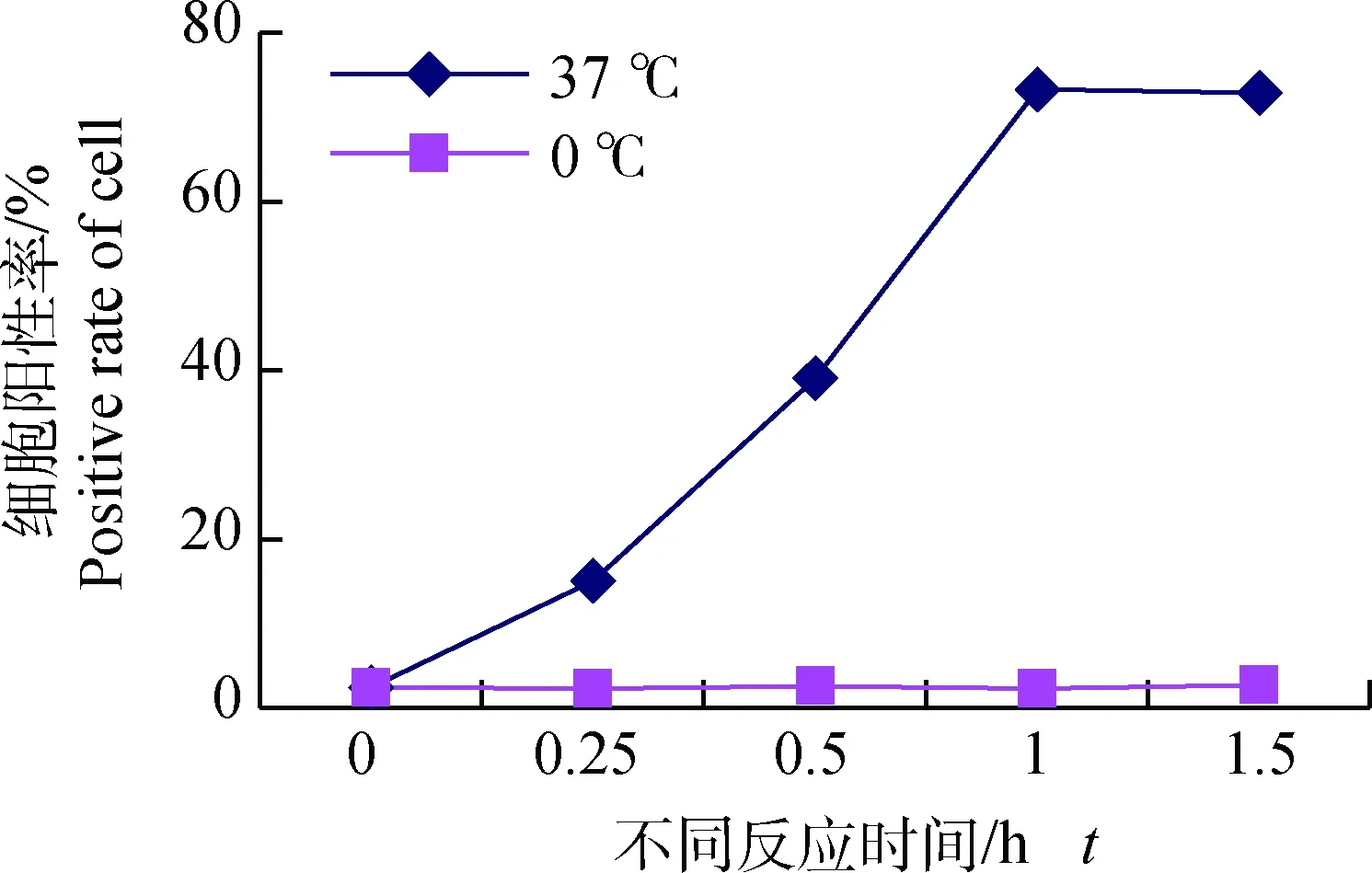
图2 不同作用时间及温度对DC的摄取效率影响检测Fig.2 Effect of different reaction time and temperature to endocytosis ability of DCs

图3 树突状细胞的内吞分析Fig.3 Uptake analysis of DC
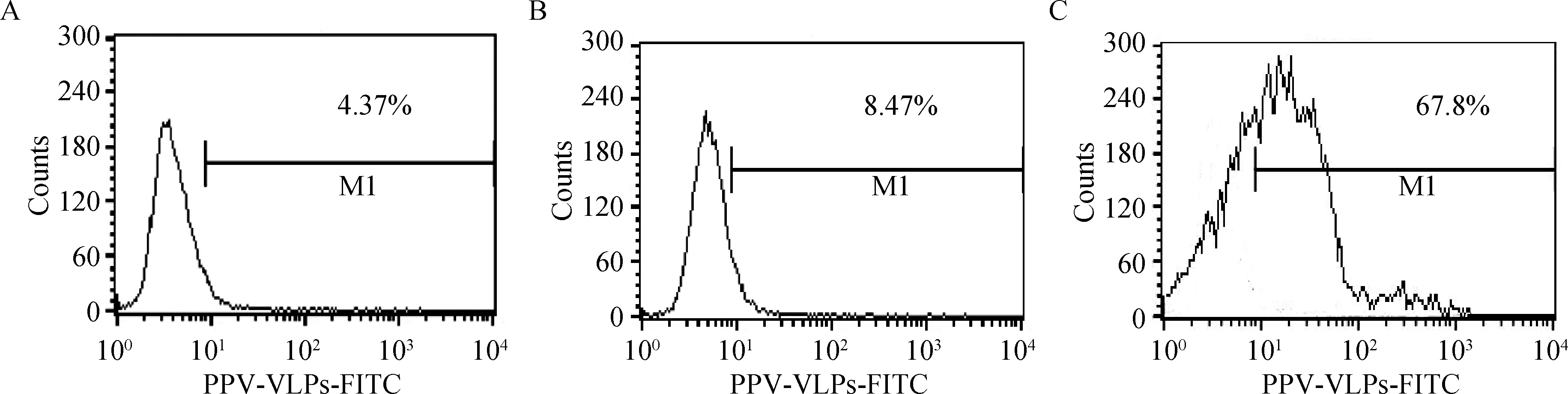
A.mock DC细胞;B.经肌动蛋白抗体处理DC对FITC-PPV-VLPs-E290的内吞;C.未经处理DC对FITC-PPV-VLPs-E290的内吞A.Mock dendritic cells;B.FITC-PPV-VLPs-E290 capture of DC treated by anti-actin antibody;C.FITC-PPV-VLPs-E290 capture of untreated DC图4 流式细胞仪检测肌动蛋白抗体对DC内吞FITC-PPV-VLPs-E290的影响Fig.4 Endocytosis effect of anti-actin antibody detected by flow cytometry

A.DC mock 对照;B.未经处理的DC对FITC-PPV-VLPs-E290的内吞;C.经肌动蛋白抗体处理DC对FITC-PPV-VLPs-E290的内吞A.Mock dendritic cells;B.FITC-PPV-VLPs-E290 capture of untreated DC;C.FITC-PPV-VLPs-E290 capture of DC treated by anti-actin antibody图5 共聚焦显微镜检测肌动蛋白抗体对DC内吞FITC-PPV-VLPs-E290的影响Fig.5 Endocytosis effect of anti-actin antibody detected by confocal microscopy
2.3抗DEC-205抗体对DC内吞 PPV-VLPs-E290的抑制分析
DC经DEC205抗体处理后,与FITC-PPV-VLPs-E290在37 ℃共孵育1 h,经流式细胞仪检测及共聚焦显微镜观察,FITC阳性DC细胞的比例未发生明显改变(图6、7)。

A.Mock DC细胞;B.经DEC205抗体处理DC对FITC-PPV-VLPs-E290的内吞;C.未经处理DC对FITC-PPV-VLPs-E290的内吞A.Mock dendritic cells;B.FITC-PPV-VLPs-E290 capture of DC treated by anti-DEC205 antibody;C.FITC-PPV-VLPs-E290 capture of untreated DC图6 流式细胞仪检测DEC205抗体对DC内吞FITC-PPV-VLPs-E290的影响Fig.6 Endocytosis effect of anti-DEC205 antibody assessed by Flow cytometry

A.Mock DC细胞对照;B.未经处理的DC对FITC-PPV-VLPs-E290的内吞;C.经DEC205抗体处理的DC对FITC-PPV-VLPs-E290的内吞A.Mock dendritic cells;B.FITC-PPV-VLPs-E290 capture of untreated DC;C.FITC-PPV-VLPs-E290 capture of DC treated by anti-DEC205 antibody图7 共聚焦显微镜检测DEC205抗体对DC内吞FITC-PPV-VLPs-E290的影响Fig.7 Endocytosis effect of anti-DEC205 antibody assessed by confocal microscopy
2.4抗caveolin-1抗体对DC内吞 PPV-VLPs-E290的抑制分析
抗caveolin-1抗体与DC反应后,流式细胞仪检测及共聚焦显微镜观察,均显示FITC阳性细胞的比例明显较少。表明caveolin-1抗体能抑制DC内吞 PPV-VLPs-E290的效率(图8、9)。
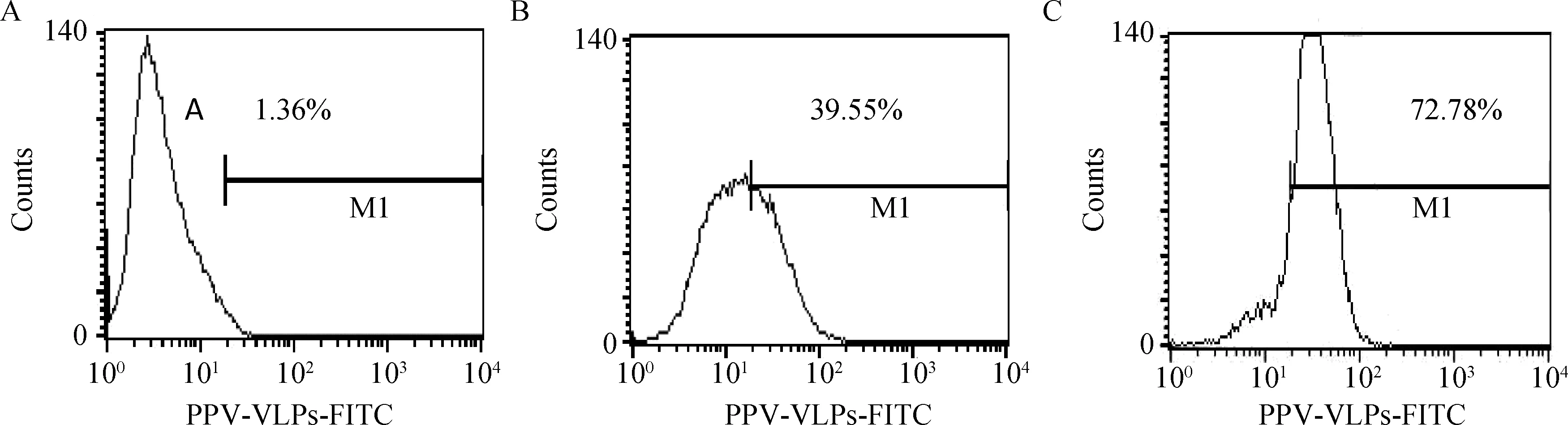
A.Mock DC细胞;B.经caveolin-1抗体处理DC对FITC-PPV-VLPs-E290的内吞;C.未经处理的DC对FITC-PPV-VLPs-E290的内吞A.Mock dendritic cells;B.FITC-PPV-VLPs-E290 capture of DC treated by anti-caveolin-1 antibody;C.FITC-PPV-VLPs-E290 capture of untreated DC图8 流式检测caveolin-1抗体对DC内吞FITC-PPV-VLPs-E290的影响Fig.8 Endocytosis effection of caveolin-1 antibody assessed by Flow cytometry

A.DC mock 对照;B.未经处理的DC对FITC-PPV-VLPs-E290的内吞;C.经caveolin-1抗体处理DC对FITC-PPV-VLPs-E290的内吞A.Mock dendritic cells;B.FITC-PPV-VLPs-E290 capture of untreated DC;C.FITC-PPV-VLPs-E290 capture of DC treated by anti-caveolin-1 antibody图9 共聚焦显微镜检测caveolin-1抗体对DC内吞FITC-PPV-VLPs-E290的影响Fig.9 Endocytosis effection of anti-caveolin-1 antibody assessed by confocal microscopy
2.5CD64抗体对DC内吞 PPV-VLPs-E290的抑制分析
DC经CD64抗体处理后,与FITC-PPV-VLPs-E290在37 ℃共孵育1 h,经流式细胞仪检测及共聚焦显微镜观察,FITC阳性DC细胞的比例均未发生明显改变(图10、11)。
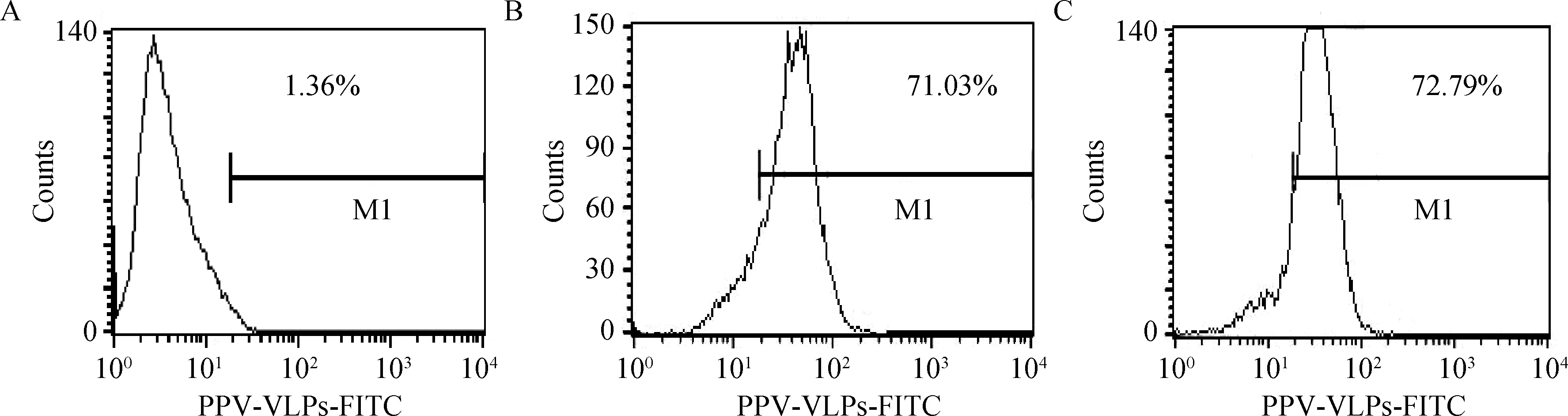
A.mock DC细胞;B.经CD64抗体处理DC对FITC-PPV-VLPs-E290的内吞;C未经处理DC对FITC-PPV-VLPs-E290的内吞A.mock dendritic cells;B.FITC-PPV-VLPs-E290 capture of DC treated by anti-CD64 antibody;C.FITC-PPV-VLPs-E290 capture of untreated DC图10 流式细胞仪检测CD64抗体对DC内吞FITC-PPV-VLPs-E290的影响Fig.10 Endocytosis effect of anti-CD64 antibody assessed by Flow cytometry
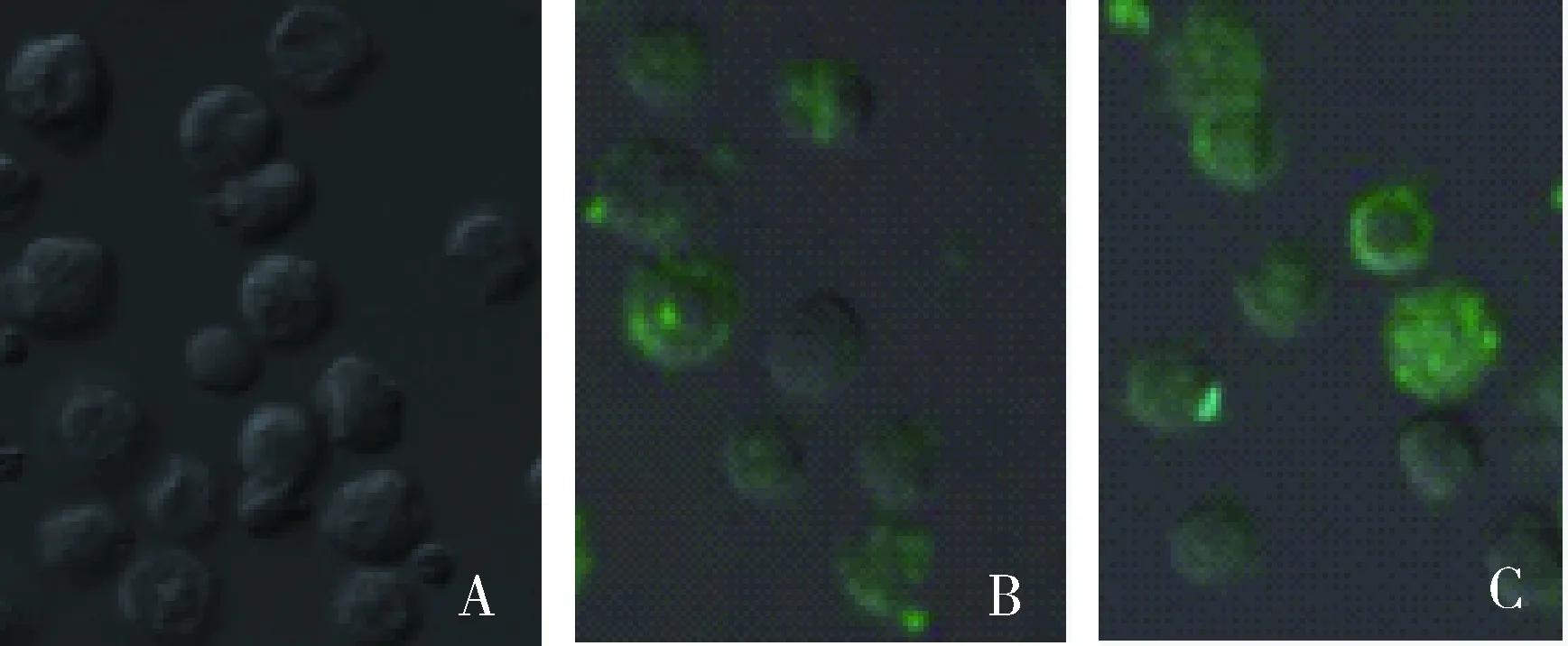
A.DC mock 对照;B.经CD64抗体处理的DC对FITC-PPV-VLPs-E290的内吞;C.未经处理的DC对FITC-PPV-VLPs-E290的内吞A.Mock dendritic cells;B.FITC-PPV-VLPs-E290 capture of DC treated by anti-CD64 antibody;C.FITC-PPV-VLPs-E290 capture of untreated DC图11 共聚焦显微镜检测抗体受体对DC内吞FITC-PPV-VLPs-E290的影响Fig.11 Endocytosis effect of anti-CD64 antibody assessed by confocal microscopy
3 讨 论
树突状细胞是体内的一类专职抗原提呈细胞,它们的功能是捕获、处理抗原,并将处理后的抗原呈递给T淋巴细胞。在树突状细胞摄取外界抗原物质的过程中,肌动蛋白及其调节蛋白发挥了重要作用。肌动蛋白聚合,促使细胞膜内化,在吞噬作用和巨胞饮中尤为明显[8-9]。另外,在受体介导的内吞方式中,肌动蛋白亦与网格蛋白、及其他蛋白相互作用,促使质膜囊泡内化[10]。 为了确定猪DC捕获细小病毒样颗粒PPV-VLPs-E290的方式,是否与肌动蛋白有关,本研究首先用抗肌动蛋白的抗体与DC在37 ℃作用1 h,然后再与FITC-PPV-VLPs-E290作用,结果显示,FITC阳性细胞的数量与未处理组出现明显差异。经肌动蛋白抗体处理的DC几乎不能捕取FITC-PPV-VLPs-E290。说明猪DC对细小病毒样颗粒PPV-VLPs-E290的捕获与肌动蛋白密切相关。
为了进一步明确DC捕获猪细小病毒样颗粒PPV-VLPs-E290的方式,我们首先对目前了解较为透彻的网格蛋白介导的内吞方式进行了鉴定。网格蛋白介导的内吞是一种严格受体依赖,并需要网格蛋白和 GTPase发动蛋白参与的内吞方式[11-12]。在各种不同的受体中,属于C型凝集素超家族成员的甘露糖受体家族(MR),是一类由细胞膜经网格蛋白介导的内吞作用而进入细胞内部的受体家族。在受体介导的内吞过程中起重要作用[13]。作为其成员之一的DEC-205,分布于肠上皮细胞、胸腺上皮细胞、B细胞、以及树突状细胞等多种抗原提呈细胞表面,除了能够介导抗原提呈细胞对抗原物质的内化外,还能高效介导抗原在抗原提呈细胞内的处理及提呈[14]。降低抗原提呈细胞表面DEC-205 的表达,会导致抗原提呈细胞对抗原捕获和提呈效率的下降[15]。 而一些无法被体内抗原提呈细胞有效捕获,并提呈至T细胞的多肽或小分子抗原,与DEC-205的抗体通过基因工程或化学融合技术结合后,则可有效激活体内的T细胞,引发T细胞免疫反应[16,17],或刺激保护性T细胞免疫应答[18]。另外,在介导外源性抗原的交叉提呈方面,许多能介导外源性抗原交叉提呈的抗原内化受体如MR/CD206及DC-SIGN/CD209 等[19],交叉提呈抗原的效率亦明显低于DEC-205[20]。 为了明确猪DC捕获细小病毒样颗粒PPV-VLPs-E290的方式,是否与DEC-205依赖的网格蛋白介导的内吞方式有关,本研究使用的DC先用抗DEC-205的抗体处理,然后再与FITC-PPV-VLPs-E290作用,流式细胞仪及共聚焦显微镜检测结果显示,经DEC-205抗体处理后的DC,对PPV-VLPs-E290的捕获效率未见明显变化。说明DEC-205依赖的、网格蛋白包被小窝介导的内吞在PPV-VLPs-E290的摄取过程未起到明显的作用。
细胞膜的膜穴样凹陷(caveolae)介导的内吞是树突状细胞捕获外界抗原物质的另一重要方式[21],在此过程中,小窝蛋白(caveolin)尤其是caveolin-1发挥着了重要作用,常将其作为该捕获方式的标志蛋白。为了确定猪DC捕获猪细小病毒样颗粒PPV-VLPs-E290的方式,是否与caveolin-1介导的方式有关,DC预先用抗caveolin-1抗体处理,然后再与FITC-PPV-VLPs-E290作用,结果显示,FITC阳性细胞的比例明显下降。
吞噬作用依赖于肌动蛋白、发动蛋白以及与细胞膜受体等位的多价配体[21-22]。吞噬主要捕获大于0.5~1 μm的颗粒[23]。除了单纯疱疹病毒Ⅰ型(HSV-1) 和巨型病毒(mimivirus)或人类腺病毒(HAdV-C2)被聚集于可溶性的受体,并靶向结合于Fc受体 CD64外[24-25],小于0.5 μm的分子主要通过内吞的方式而非吞噬的方式被摄取。为了了解猪细小病毒样颗粒PPV-VLPs-E290是否可以通过Fc受体 CD64介导的吞噬方式进入DC,本研究中作者先用抗CD64的抗体处理DC,然后再与FITC-PPV-VLPs-E290作用,结果显示,抗CD64的抗体对DC捕获病毒样颗粒FITC-PPV-VLPs-E290的效率没有影响。
以上研究结果表明,DC摄取FITC-PPV-VLPs-E290方式依赖于肌动蛋白,与DEC-205依赖的网格蛋白介导的内吞及吞噬作用无关,而与膜穴样凹陷介导的内吞有关。 考虑到巨胞饮介导的内吞亦依赖于肌动蛋白,而caveolae-1依赖的膜穴样凹陷介导的内吞方式被抑制后,DC捕获FITC-PPV-VLPs-E290的效率虽然明显下降,但并未完全抑制。因此推断,巨胞饮在DC 捕获FITC-PPV-VLPs-E290的过程中亦发挥了重要作用。但DC是否还可通过网格蛋白及小窝蛋白(caveolin)非依赖的其他途径摄取FITC-PPV-VLPs-E290,有待于进一步的研究。
[1]ZELTINS A.Construction and characterization of virus-like particles:a review[J].MolBiotechnol,2013,53(1):92-107.
[2]ROY P,NOAD R.Virus-like particles as a vaccine delivery system:myths and facts[J].AdvExpMedBiol,2009,665:145-158.
[3]ANTONIS A F,BRUSCHKE C J,RUEDA P,MARANGA L,et al.A novel recombinant virus-like particle vaccine for prevention of porcine parvovirus-induced reproductive failure[J].Vaccine,2006,24(26):5481-5490.
[5]MARTINEZ X,REGNER M,KOVARIK J,et al.CD4-independent protective cytotoxic T cells induced in early life by a non-replicative delivery system based on virus-like particles[J].Virology,2003,305(2):428-435.
[6]范京惠,左玉柱,唐立杰,等.含CSFV T细胞表位的猪细小病毒样颗粒的表达及小鼠免疫试验[J].农业生物技术学报,2007,15 (5):746-751.
FAN J H,ZUO Y Z,TANG L J,et al.Expression ofPorcineparvovirus-like particles carrying a CSFV T cell epitope and its immunization on mice[J].JournalofAgriculturalBiotechnology,2007,15 (5):746-751.(in Chinese)
[7]申小强,王超,左玉柱,等.猪细小病毒样颗粒在树突状细胞中定位的研究[J].河北农业大学学报,2014,37 (6):95-100.
SHEN X Q,WANG C,ZUO Y Z,et al.Location study of recombinant parvovirus-like particles in dendritic cells[J].JournalofAgriculturalUniversityofHebei.2014,37 (6):95-100.(in Chinese)
[8]MAY R C,MACHESKY L M.Phagocytosis and the actin cytoskeleton[J].JCellSci,2001,114:1061-1077.
[9]KERR M C,TEASDALE R D.Defining macropinocytosis[J].Traffic,2009,10:364-371.
[10]HUANG Y H,BISWAS C,DEHRING D A,et al.The actin regulatory protein HS1 is required for antigen uptake and presentation by dendritic cells[J].JImmunol, 2011,187:5952-5963.
[11]SCHMID S L,FROLOV V A.Dynamin:functional design of a membrane fission catalyst[J].AnnuRevCellDevBiol,2011,27,79-105
[12]FERGUSON S M,DE CAMILLI P.Dynamin,a membrane remodelling GTPase[J].NatRevMolCellBiol,2012,13,75-88.
[13]BARTH H,ULSENHEIMER A,PAPE G R,et al.Uptake and presentation of hepatitis C virus-like particles by human dendritic cells[J].Blood,2005,105 (9):3605-3615.
[14]FLACHER V,TRIPP C H,STOITZNER P,et al.Epidermal langerhans cells rapidly capture and present antigens from C-type lectin-targeting antibodies deposited in the dermis[J].JInvestDermatol.2010,130(3):755-762.
[15]WADIA P P,HERRERA N D,ABECASSIS M M,et al.Mycophenolic acid inhibits maturation and function of human dendritic cells and B cells[J].HumImmunol,2009,70(9):692-700.
[16]BONIFAZ LC,BONNYAY DP,CHARALAMBOUS A,et al.In vivo targeting of antigens to maturing dendritic cells via the DEC-205 receptor improves T cell vaccination[J].JExpMed,2004,199(6):815-824.
[17]WANG B,KUROIWA J M,HE L Z,et al.The human cancer antigen mesothelin is more efficiently presented to the mouse immune system when targeted to the DEC-205/CD205 receptor on dendritic cells[J].AnnNYAcadSci,2009,1174:6-17.
[18]GURER C,STROWIG T,BRILOT F,et al.Targeting the nuclear antigen 1 of epstein-Barr virus to the human endocytic receptor DEC-205 stimulates protective T-cell responses[J].Blood,2008,112(4):1231-1239.
[19]TASSANEETRITHEP B,BURGESS T H,GRANELLI P A,et al.DC-SIGN (CD209) mediates dengue virus infection of human dendritic cells[J].JExpMed,2003,197:823-829.
[20]BOZZACCO L,TRUMPFHELLER C,SIEGAL F P,et al.DEC-205 receptor on dendritic cells mediates presentation of HIV gag protein to CD8+T cells in a spectrum of human MHC I haplotypes[J].ProcNatlAcadSciUSA,2007,104 (4):1289-1294.
[21]MERCER J,GREBE U F.Virus interactions with endocytic pathways in macrophages and dendritic cells.TrendsMicrobiol,2013,21(8):380-388.
[22]SWANSON,J A.Shaping cups into phagosomes and macropinosomes[J].NatRevMolCellBiol,2008,9,639-649.
[23]FLANNAGAN R S,JAUMOUILLE V,GRINSTEIN S.The cell biology of phagocytosis[J].AnnuRevPathol,2012,7:61-98.
[24]CLEMENT C,TIWARI V,SCANLAN P M,et al.A novel role for phagocytosis-like uptake in herpes simplex virus entry[J].JCellBiol,2006,174,1009-1021.
[25]MEIER O,GASTALDELLI M,BOUCKE K,et al.Early steps of clathrin-mediated endocytosis involved in phagosomal escape of Fcgamma receptor-targeted adenovirus[J].JVirol,2005,79,2604-2613.
(编辑白永平)
The Influence of Antibodies against Key Factors of Different Endocytic Pathways on Dendritic Cells Uptake Recombinant Parvovirus-like Particles
SHEN Xiao-qiang,ZUO Yu-zhu*,DI Jing-mei,GU Wen-yuan,FAN Jing-hui*
(CollegeofVeterinaryMedicine,AgriculturalUniversityofHebei,Baoding071001,China)
Recombinant parvovirus-like particles (PPV-VLPs) are particulate exogenous antigens that induce strong CTL response.In order to decipher the mechanisms responsible for CTL activation by such exogenous antigen and the probable endocytic pathways in PPV-VLP capture,we analyzed the influence of different antibodies on dendritic cells (DCs) endocytic uptaking recombinant parvovirus-like particles.The results analyzed by FACStar cytometer and confocal microscopy showed that the PPV-VLPs capture efficiency of spleen DCs pretreated with anti-CD64 and anti-DEC205 antibodies was not affected.However,anti-caveolin-1 antibodies treated DCs was severely reduced.DCs pretreated with anti-actin antibodies were barely to uptake PPV-VLPs.These results showed that the uptake of PPV-VLPs seems to be related to macropinocytosis and caveolae-mediated endocytosis in an actin-dependent pathway,not clathrin-coated pits or phagocytosis.
parvovirus-like particles;dendritic cells;uptake pathways
10.11843/j.issn.0366-6964.2016.09.022
2016-03-09
国家自然基金资助项目(31101847)
申小强(1989-),男,河北邯郸人,硕士生,主要从事动物传染病学研究
左玉柱,男,副教授,硕导,主要从事动物传染病学的教学、科研与社会服务工作,E-mail:zuoyuzhu@163.com;范京惠,女,博士,副教授,硕导,主要从事兽医微生物与免疫学的教学与科研工作,E-mail:jinghui76@163.com
S852.4
A
0366-6964(2016)09-1924-07



