胡孟娟,周丽娜,牛延萍,徐立新,宋小凯,李祥瑞,严若峰
(南京农业大学动物医学院,南京 210095)
捻转血矛线虫寄生于牛、羊、骆驼等反刍动物皱胃,吸食宿主血液,繁殖力高,流行广泛,致病性强[1]。宿主感染该病原易引起严重胃炎、贫血、腹泻等[2],大量感染致使幼龄动物死亡,对全世界畜牧业产生巨大威胁,并造成严重经济损失[3]。因此,研究并开发出一种有效的疫苗来防治该病尤为重要。随着各方面研究的深入,人们逐步认识到,要想研制有效的疫苗,必须深入了解捻转血矛线虫寄生过程中的一些重要问题,包括线虫侵入宿主机制、消化道附着机制、吸血机制和免疫抑制机制等[4]。
半胱氨酸蛋白酶(cysteine protease,CP)是一类重要的细胞内蛋白酶,在生物进化过程中非常保守,其活性中心含有半胱氨酸残基,广泛存在于各种生物体中[5]。近年来对寄生虫半胱氨酸蛋白酶研究颇多,如弓形虫、旋毛虫、肝片吸虫等,研究发现该酶参与寄生虫摄取营养、免疫逃避、在宿主体内移行等过程,是一种良好的疫苗候选抗原。利用Race技术克隆捻转血矛线虫半胱氨酸蛋白酶(Hc58),并对其序列和蛋白质功能进行分析,结果表明该基因全长序列为851 bp,编码217个氨基酸,该蛋白质属于木瓜蛋白酶类的C1族组织蛋白酶B样蛋白酶,可能在捻转血矛线虫的食血过程和在宿主体内存活起到重要作用[6]。同时构建了捻转血矛线虫Hc58 DNA疫苗,并进行了山羊免疫保护性试验,研究发现每克粪便虫卵数、虫卵孵化率和皱胃荷虫数比对照组分别减少了28.02%、47.6%和28.3%,结果表明Hc58 DNA疫苗具有较好的免疫保护效果[7]。本试验通过体外试验分析Hc58对山羊PBMCs的影响,结果对了解该蛋白质诱导宿主免疫保护机制具有一定意义。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 3~6月龄健康山羊,购自南京某郊区养殖场。
1.1.2 质粒与菌种 pET-28a-Hc58质粒,大肠杆菌BL21均由本实验室保存。
1.1.3 主要工具酶和试剂 限制性核酸内切酶BamHⅠ、HindⅢ购自大连宝生物(TaKaRa)工程有限公司;Pierce®BCA Protein Assay Kit蛋白定量分析试剂盒购于美国 Thermo公司;淋巴细胞分离液为天津灏洋生物公司产品;RPMI1640培养基、DMEM培养基及胰酶消化液均购于Gbico公司;胎牛血清购自Life technologies公司;12孔、24孔、96孔Costar®细胞培养板购自Corning公司;E.Z.N.ATMTotal RNA kit I为OMEGA公司产品;总一氧化氮检测试剂盒购自碧云天公司;Millcell®Hanging Cell Culture Inserts购自Merck-Millipore公司;HiScriptTMQ RT SuperMix for qPCR试剂盒、ChamQTMSYBR®qPCR Master Mix均购于南京诺唯赞公司;Annexin V-FITC Kit购自南京福麦斯生物公司;FITC-dextran为美国Sigma公司产品;其余试剂为国产分析纯。
1.1.4 主要仪器与设备 ImageQuant300凝胶成像分析系统(美国GE公司),5417R冷冻台式离心机(德国Eppendorf公司),Thermo Scientific 8000 CO2细胞恒温培养箱(Thermo),ABI7500荧光定量PCR仪,PCR扩增仪(日本TaKaRa),BD FACSCalibur 流式细胞仪(美国Bectom Dickinson公司)。
1.2 试验方法
1.2.1 重组质粒的鉴定与表达 将重组质粒转化至大肠杆菌BL21感受态细胞中,随机挑取单菌落,提取质粒用BamHⅠ、HindⅢ进行双酶切鉴定,将阳性质粒送去南京擎科生物公司进行测序。将测序正确的菌液接种于含1 μg·mL-1Kana抗生素的液体LB培养基中,次日以1∶100接种于1 000 mL液体LB培养基中,置于37 ℃恒温摇床180 r·min-1摇至OD600 nm值为0.4~0.6,加入IPTG使其终浓度为0.1 mmol·L-1继续诱导5 h。收集菌体,超声破碎,SDS-PAGE检测菌体分布在上清或包涵体。
1.2.2 重组蛋白质的纯化 参照说明书使用镍柱吸附蛋白质原理对重组蛋白质进行纯化,经SDS-PAGE检测后,将重组蛋白质放入含梯度浓度尿素的复性缓冲液中分别复性透析8 h,经聚乙二醇浓缩后,测定浓度,过滤除菌分装冻存。
1.2.3 山羊PBMCs和单核细胞的分离与培养 从健康山羊颈静脉中无菌采取抗凝血,参照淋巴细胞分离液说明书分离PBMCs。台盼蓝染色观察活细胞在95%以上。将收集的PBMCs用含1%的双抗和10%胎牛血清的1640培养液吹悬混匀,调整细胞浓度为1×106·mL-1。单核细胞具有贴壁生长的特性,由此可进行分离。将分离的PBMCs或单核细胞与终质量浓度为0、10、20、40 μg·mL-1的重组蛋白质Hc58共孵育,置于37 ℃,5%CO2的细胞培养箱培养。
1.2.4 重组蛋白质对单核细胞分泌一氧化氮的影响 取“1.2.3”处理好的单核细胞悬液,每孔1 mL,分别加入24孔板中,并设置pET-28a标签蛋白对照组,每组三个重复。培养24 h后,离心取细胞上清,按照碧云天总NO检测说明书进行测定。
1.2.5 重组蛋白质对山羊单核细胞吞噬能力的影响 将“1.2.3”处理好的单核细胞接种于24孔板中,每孔1 mL,同时设置pET-28a标签蛋白对照组,每组三个重复。培养48 h后,收集细胞,每管加入1 mL预冷的PBS溶液洗涤,用100 μL PBS溶液重悬细胞,再加入100 μL异硫氰酸荧光素标记的葡聚糖(FITC-dextran),混匀,分别置于4和37 ℃避光孵育1 h;用预冷的含2% FBS的PBS溶液洗涤,再用500 μL PBS溶液重悬细胞;转入流式管中,上流式细胞仪进行检测。参照文献[8]细胞吞噬指数(cell phagocytosis index,PI)计算公式PI=MFI试验组/MFI细胞对照组对试验数据进行处理。
1.2.6 重组蛋白质对PBMCs分泌细胞因子的影响 取24孔板,每孔1 mL加入“1.2.3”处理好的PBMCs细胞悬液,设置pET-28a标签蛋白对照组,每组三个重复。培养24 h后,参照总RNA提取试剂盒说明书对细胞RNA进行提取,并反转录为cDNA。参照文献[9]设计并合成山羊细胞因子IL-2、IL-4、IL-10、IL-17、IFN-γ和TGF-β的引物,以β-actin为内参,采用荧光定量PCR对山羊PBMCs细胞因子转录水平进行测定。
1.2.7 重组蛋白质对PBMCs迁移的影响 取24孔板,每孔加入“1.2.3”处理好的PBMCs细胞悬液1 mL,同时设置pET-28a标签蛋白对照组,每组三个重复,培养24 h后,进行细胞计数;再嵌入迁移小室,培养2 h后,收集迁移至下室的细胞,经过计数,算出细胞的迁移率。
1.2.8 重组蛋白质对PBMCs凋亡的影响 于24孔板中分别加入“1.2.3”处理好的PBMCs细胞悬液1 mL,并设置pET-28a标签蛋白对照组,每组三个重复。培养48 h后,收集细胞于1.5 mL Eppendorf管中,500 g离心5 min,弃上清;用预冷的1×Binding Buffer洗涤两遍;100 μL 1×Binding Buffer重悬细胞;再加入10 μL Annexin V-FITC;轻轻吹打混匀,避光孵育15 min;再用1×Binding Buffer洗涤两遍,弃上清,加入500 μL 1×Binding Buffer和5 μL碘化丙啶(propidium iodide),轻轻混匀,转入流式管,上机检测细胞凋亡。
1.3 数据处理
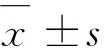
2 结 果
2.1 捻转血矛线虫Hc58的鉴定表达与纯化
重组原核表达质粒pET-28a-Hc58经BamHⅠ和Hind Ⅲ酶切鉴定,显示有一条载体条带和一条850 bp左右的目的片段,结果与预测相符。将重组质粒转入大肠杆菌进行诱导表达,重组蛋白主要以包涵体的形式存在,获得的融合蛋白相对分子质量约为27 ku(图1)。
2.2 重组蛋白质对山羊单核细胞分泌NO的影响
单核细胞与不同浓度的重组蛋白Hc58作用后,在质量浓度为20和40 μg·mL-1时,能显着(P<0.01或P<0.001)增强单核细胞分泌NO,而在质量浓度为10 μg·mL-1时,影响不明显(图2)。本研究中,pET-28a标签蛋白对照组与细胞对照组无显着差异,说明融合蛋白质中标签蛋白对试验无影响。
2.3 重组蛋白质对山羊单核细胞吞噬能力的影响
与细胞对照组相比,试验组中3种质量浓度的重组蛋白质Hc58均能显着(P<0.01或P<0.001)促进山羊单核细胞的吞噬能力(图3)。
2.4 重组蛋白质对山羊PBMCs分泌细胞因子的影响
重组蛋白质Hc58刺激PBMCs后,3个试验组中,IL-2、IL-4、IL-17转录量均显着(P<0.01或P<0.001)高于细胞对照组;当蛋白质质量浓度为10和20 μg·mL-1时, IFN-γ转录量极显着(P<0.001)高于细胞对照组,而IL-10、TGF-β变化不明显(图4)。
2.5 重组蛋白质对山羊PBMCs迁移能力的影响
试验结果显示,3种浓度的重组蛋白质Hc58与PBMCs作用后,蛋白质质量浓度为20和40 μg·mL-1时,能显着(P<0.01或P<0.001)促进山羊PBMCs的迁移,作用效果随着Hc58的浓度增加而增强(图5)。
2.6 重组蛋白质对山羊PBMCs凋亡的影响
本试验中,PBMCs经不同浓度的Hc58作用后,细胞凋亡的比例呈剂量依赖性。其中,20和40 μg·mL-1的重组蛋白质能极显着的促进细胞凋亡(P<0.001)(图6、图7)。
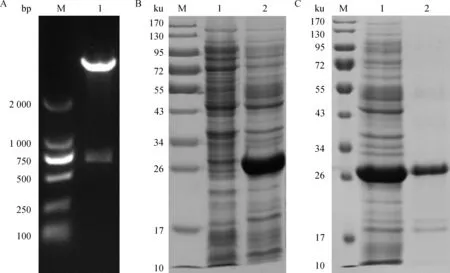
A.重组质粒pET-28a-Hc58的双酶切鉴定(M. DNA相对分子质量标准;1.pET-28a-Hc58经BamHⅠ、Hind Ⅲ的酶切产物);B.重组蛋白Hc58的分布(M.蛋白质相对分子质量标准;1.表达产物上清;2.表达产物沉淀);C.重组蛋白Hc58的纯化(M.蛋白质相对分子质量标准;1.纯化前包涵体蛋白;2.纯化后包涵体蛋白)A. Identification of recombinant plasmid pET-28a-Hc58 by restriction enzyme digestion (M. DNA marker; 1.pET-28a-Hc58 digested by BamHⅠand Hind Ⅲ); B. Distribution of recombinant Hc58 (M. Protein marker; 1.Supernatant of expression products; 2.Precipitate of expression productions); C. Purification of recombinant Hc58(M.Protein marker; 1.Inclusion body without purification; 2.Purified protein from inclusion body)图1 Hc58基因的鉴定表达与蛋白质纯化Fig.1 Identification, expression and purification of recombinant Hc58
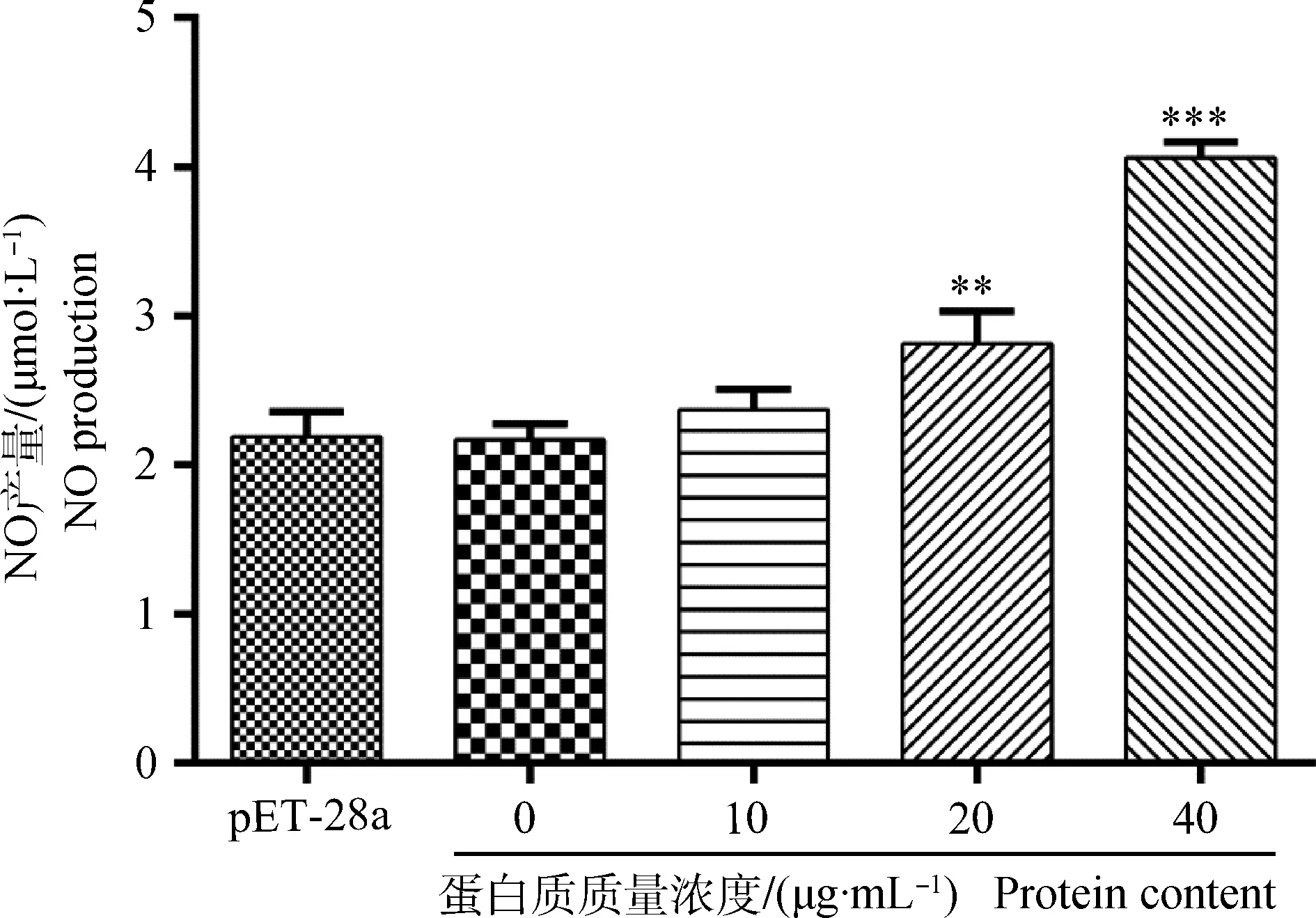
与细胞对照组(0 μg·mL-1)相比,**.P<0.01;***.P<0.001。下图同Compared with the control group (0 μg·mL-1),**.P<0.01; ***.P<0.001. The same as follow图2 重组蛋白质Hc58对山羊单核细胞分泌NO的影响Fig.2 Effect of recombinant Hc58 on the NO production of goat monocytes
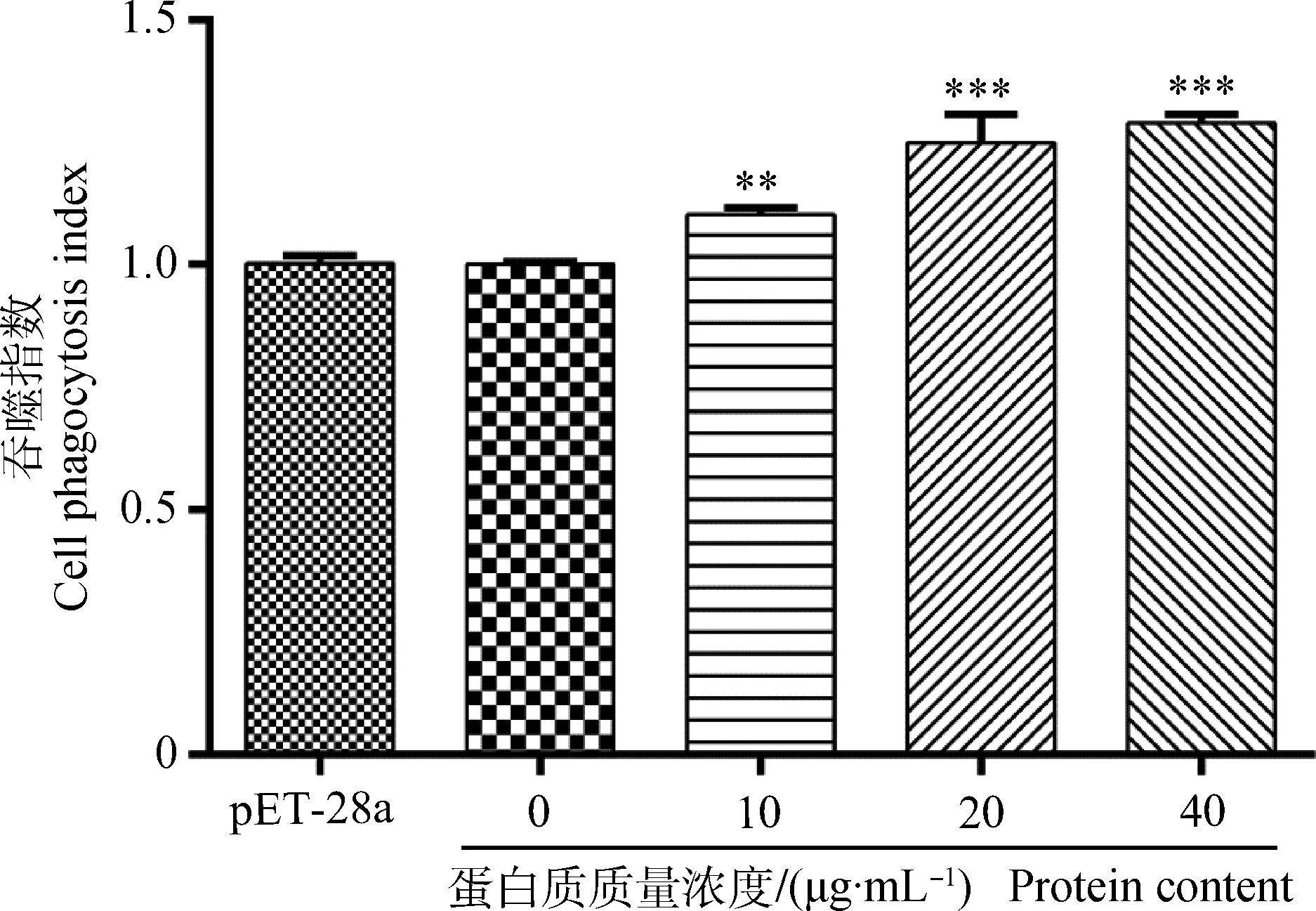
图3 重组蛋白质Hc58对山羊单核细胞吞噬功能的影响Fig.3 Effect of recombinant Hc58 on the phagocytosis of goat monocytes
3 讨 论
寻找具有免疫保护效果的虫体抗原是捻转血矛线虫疫苗研究的一个重要方向。研究发现一些膜内分泌蛋白,尤其是酶类,不仅具有很强的抗原性,而且在同一虫体的不同发育时期均有分泌,参与虫体的入侵、吸附、繁殖、免疫逃避等过程,并在寄生虫与宿主之间的相互作用中扮演重要角色[10]。捻转血矛线虫半胱氨酸蛋白酶Hc58分布于肠微绒毛表面,具有血凝活性,可降解山羊血红蛋白、IgG和纤维蛋白原,具有显着的免疫原性[11]。
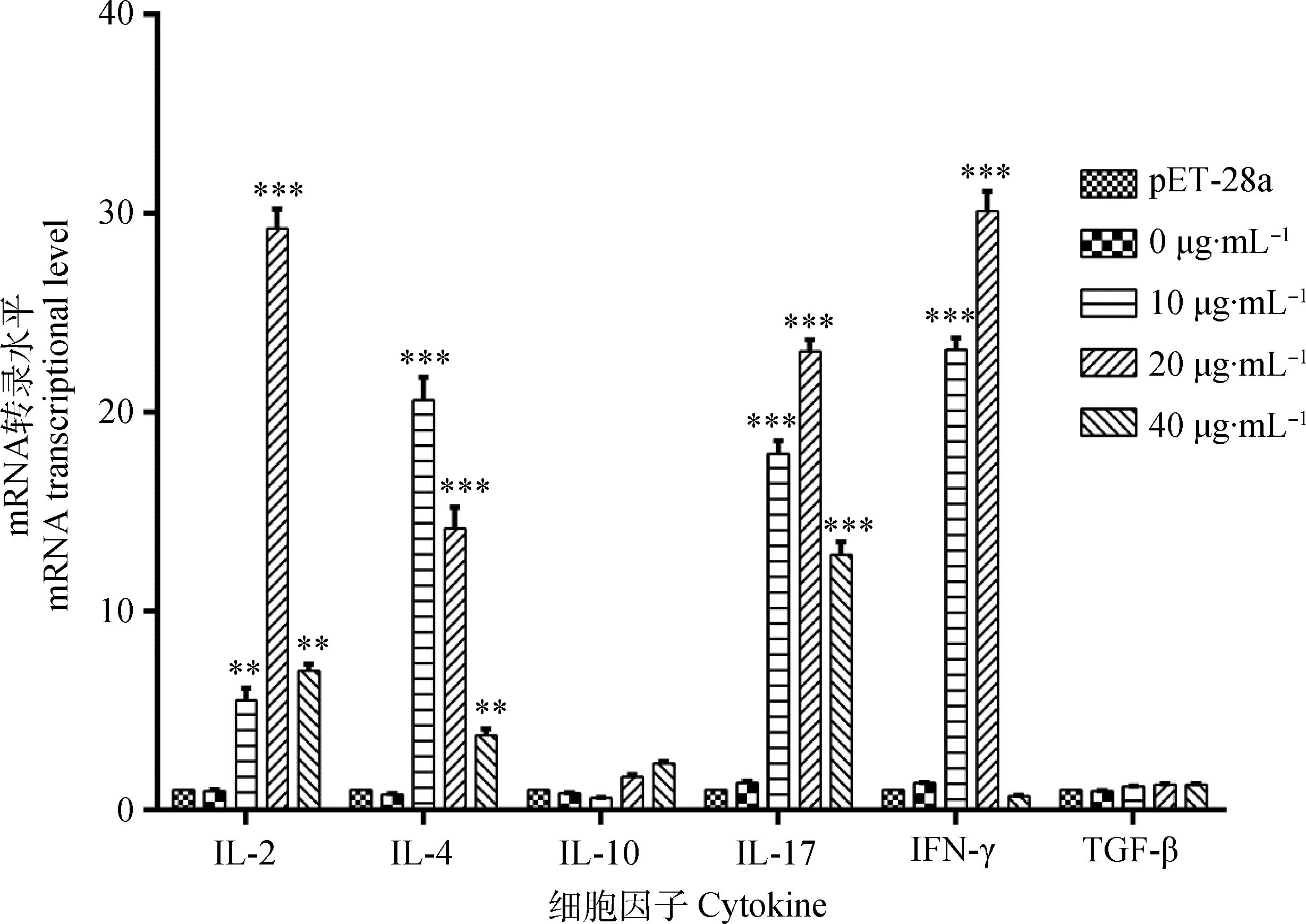
图4 重组蛋白质Hc58影响山羊PBMCs多种细胞因子mRNA转录情况Fig.4 The mRNA transcriptional level of multiple cytokines in PBMCs of goat stimulated by recombinant Hc58
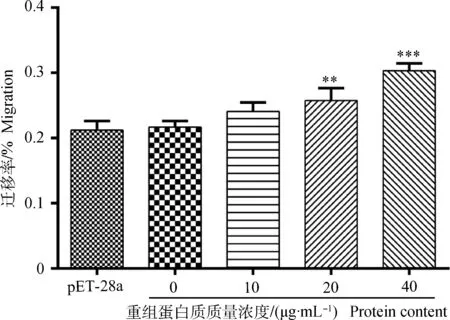
图5 重组蛋白质Hc58对山羊PBMCs迁移的影响Fig.5 Effect of recombinant Hc58 on the migration of goat PBMCs
外周血单个核细胞(PBMCs)指外周血中具有单个核的细胞,包括淋巴细胞、单核细胞、树突状细胞等,是免疫系统功能研究的重要成分[12]。笔者从细胞吞噬、迁移等几个方面进一步研究重组蛋白Hc58对PBMCs免疫功能的影响,为阐释捻转血矛线虫与宿主之间的免疫机制奠定基础。
NO是体内重要的信使分子,参与细胞杀伤、内分泌激素的释放等过程,与许多疾病的发生、发展密切相关[13]。研究表明,NO在机体抵抗锥虫、疟原虫、血吸虫、利什曼原虫等大多数寄生虫感染过程中发挥重要作用[14]。吴玲燕等[12]研究表明,捻转血矛线虫重组蛋白NDUDC刺激山羊PBMCs能够促进NO的分泌,且呈剂量依赖性。而本试验中,20和40 μg·mL-1重组蛋白质Hc58刺激单核细胞后,也能显着促进单核细胞释放NO。而且单核细胞或巨噬细胞被活化后,吞噬能力增强,能清除体内病原体和损伤的细胞[15]。本试验发现重组蛋白质Hc58能显着增强单核细胞的吞噬功能,加强了机体的防御能力。
Th1、Th2类免疫和炎症反应分泌的细胞因子在抵抗寄生虫感染中起重要的作用[16]。IL-2和IFN-γ由Th1类细胞分泌,IL-4由Th2类细胞分泌。IL-2可刺激T细胞增殖而增强细胞毒性T细胞和自然杀伤细胞的活性。IFN-γ可刺激巨噬细胞活化,增强其抗原提呈能力。IL-4可促进B细胞的生长增殖及分泌IgE抗体[17]。IL-17由Th17类细胞分泌,主要是在机体受到真菌或其他外源物质攻击时通过在感染部位募集中性粒细胞发挥作用[18]。而IL-10和TGF-β则由Treg细胞分泌,TGF-β则可能是机体关闭免疫应答的信号,对各类免疫细胞均具有抑制作用[19]。Y. L. Wen等[15]和M. Ehsan等[16]研究发现,捻转血矛线虫重组蛋白Miro-1、精氨酸激酶可通过Th1、Th2和Th17来调节寄生虫与宿主之间的免疫应答,其中Th2类免疫占主导作用。而本试验中IL-2、IL-4、IFN-γ、IL-17转录水平变化明显,IL-10、TGF-β变化不明显,且20 μg·mL-1重组蛋白Hc58试验组IL-2、IFN-γ转录水平极显着高于对照组(P<0.001),变化最为明显,表明Hc58可诱导Th1、Th2、Th17类细胞分泌细胞因子调节宿主的免疫功能,且主要诱导Th1类免疫反应。
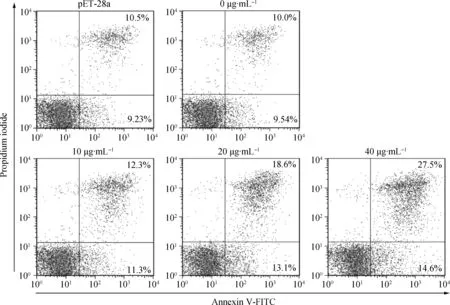
图6 双染流式分析Fig.6 The flow cytometry picture showed double staining by Annexin V-FITC and Propidium iodide
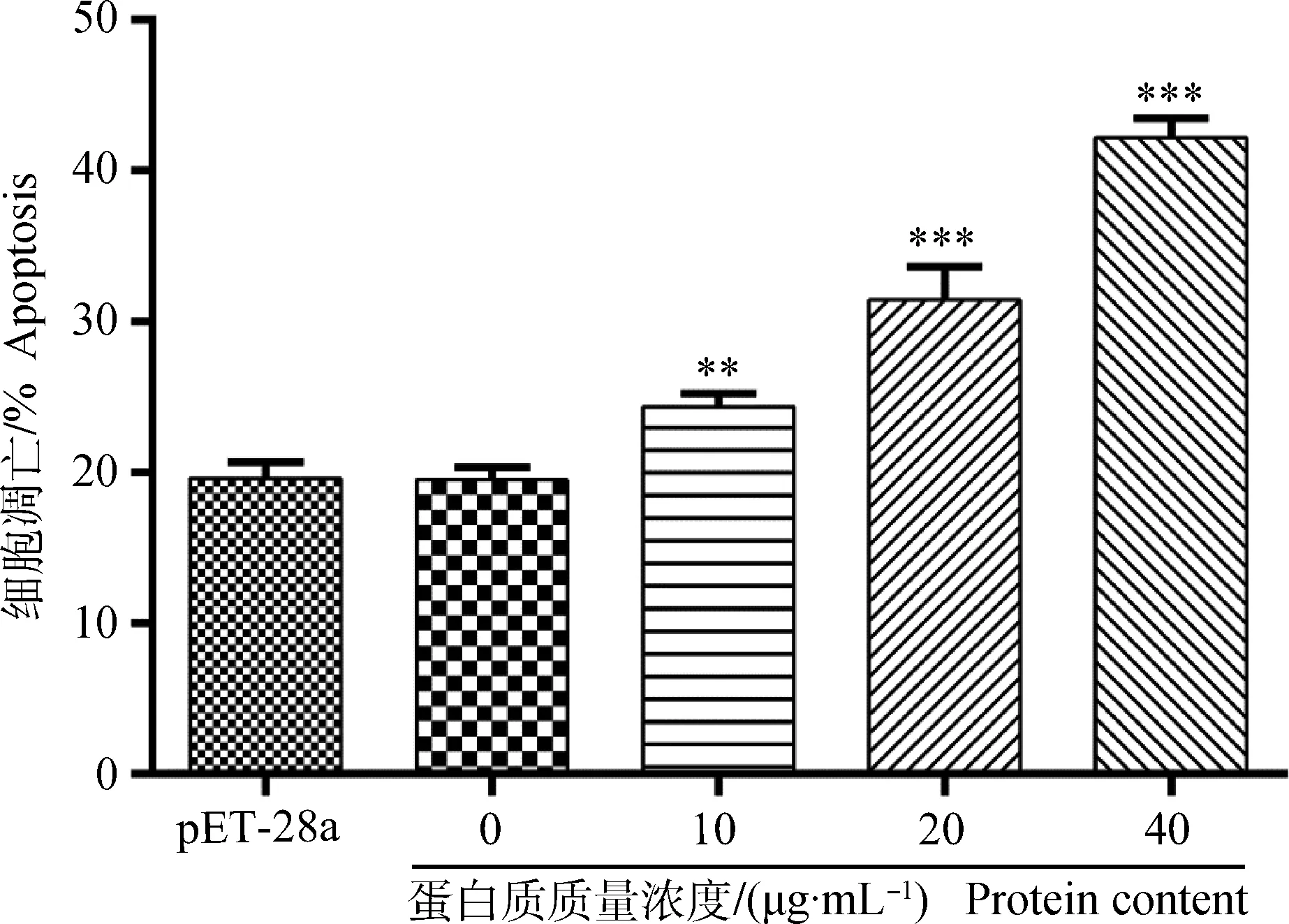
图7 重组蛋白质Hc58对山羊PBMCs凋亡的影响Fig.7 Effect of recombinant Hc58 on the apoptosis of goat PBMCs
细胞迁移是机体正常发育和生理活动的基础,在胚胎发育、免疫防御、损伤修复以及肿瘤转移等许多生理和病理过程中发挥核心作用[20]。当宿主感染病原体时,为了防止其入侵,免疫细胞会向感染部位迁移,参与机体的免疫防御。本次试验表明,高浓度的Hc58能显着增加PBMCs的迁移率,有利于机体清除病原菌和有害物质。
细胞凋亡是由基因控制的细胞主动性死亡过程,受多种基因的调控,对疾病的预防与诊治有着重要的意义。本研究中作者发现重组蛋白Hc58能显着诱导山羊PBMCs的凋亡,对促进衰老损伤细胞的清除、生物体进化、机体内环境稳态的维持等有着重要作用。本试验仅初步研究了重组蛋白质对PBMCs凋亡的作用,至于其如何诱导细胞凋亡机制和信号传导途径尚不清楚,有待于深入探索。
本文通过重组蛋白质Hc58与山羊PBMCs共同作用,体外试验测定其部分免疫指标,了解到该蛋白质对PBMCs发挥免疫功能具有重要意义,后续会通过体内试验进一步研究Hc58对山羊免疫保护机制的影响。
4 结 论
体外试验表明重组蛋白质Hc58具有促进NO分泌和细胞的吞噬作用,上调IL-2、IL-4、IL-17和IFN-γ的表达,显着增强细胞迁移和凋亡,可通过多种途径影响山羊PBMCs免疫功能的发挥。
参考文献(References):
[2] BESIER R B, KAHN L P, SARGISON N D, et al. The pathophysiology, ecology and epidemiology ofHaemonchuscontortusinfection in small ruminants[J].AdvParasitol, 2016, 93: 95-143.
[4] KNOX D P, REDMOND D L, NEWLANDS G F, et al. The nature and prospects for gut membrane proteins as vaccine candidates forHaemonchuscontortusand other ruminant trichostrongyloids[J].IntJParasitol, 2003, 33(11): 1129-1137.
[5] 吴 凡, 李德臣, 郝 瑜, 等. 家蚕半胱氨酸蛋白酶的研究进展[J]. 蚕业科学, 2017, 43(2): 336-340.
WU F, LI D C, HAO Y, et al. Research progress on cysteine protease ofBombyxmori[J].ScienceofSericulture, 2017, 43(2): 336-340. (in Chinese)
[6] MULEKE C I, YAN R F, XU L X, et al. Characterization of HC58cDNA, a putative cysteine protease from the parasiteHaemonchuscontortus[J].JVetSci, 2006, 7(3): 249-255.
[7] MULEKE C I, YAN R F, SUN Y M, et al. Cellular immune response and abomasum worm burden in goats vaccinated with HC58cDNA vaccine againstH.contortusinfection[J].AdvLifeSciTechnol, 2013, 13: 26-33.
[8] LI Y, YUAN C, WANG L K, et al. Transmembrane protein 147 (TMEM147): another partner protein ofHaemonchuscontortusgalectin on the goat peripheral blood mononuclear cells (PBMC)[J].ParasitVectors, 2016, 9: 355.
[9] 牛延萍. 捻转血矛线虫过氧化物酶基因的克隆和5种蛋白的抗原特性分析[D]. 南京: 南京农业大学, 2012.
NIU Y P. Cloning of peroxidase and antigenic characteristics analysis of five proteins inHaemonchuscontortus[D]. Nanjing: Nanjing Agricultural University, 2012. (in Chinese)
[10] SIBLEY L D. The roles of intramembrane proteases in protozoan parasites[J].BiochimBiophysActa, 2013, 1828(12): 2908-2915.
[11] 张立武. 重组捻转血矛线虫半乳糖结合凝集素免疫山羊真胃细胞因子表达定位[D]. 南京: 南京农业大学, 2007.
ZHANG L W. Localization of cytokines in abomasum of goats immunized with recombinant galectins ofHaemonchuscontortus[D]. Nanjing: Nanjing Agricultural University, 2007. (in Chinese)
[12] 吴玲燕, 王玉俭, 温玉玲, 等. 捻转血矛线虫NADH: 泛醌氧化还原酶结构域包含蛋白基因的克隆表达及功能分析[J]. 畜牧兽医学报, 2017, 48(4): 722-730.
WU L Y, WANG Y J, WEN Y L, et al. Cloning, expression and function analysis of NADH: ubiquinone oxidoreductase domain containing protein inHaemonchuscontortus[J].ActaVeterinariaetZootechnicaSinica, 2017, 48(4): 722-730. (in Chinese)
[13] 杨旭然, 陈庭金, 余新炳. 诱导型一氧化氮合酶与寄生虫感染的研究进展[J]. 中国病原生物学杂志, 2016, 11(9): 855-857.
YANG X R, CHEN T J, YU X B. A review of advances in the study of inducible nitric oxide synthase and parasitic infection[J].JournalofPathogenBiology, 2016, 11(9): 855-857. (in Chinese)
[14] OLEKHNOVITCH R, BOUSSO P. Induction, propagation, and activity of host nitric oxide: lessons fromLeishmaniainfection[J].TrendsParasitol, 2015, 31(12): 653-664.
[15] WEN Y L, WANG Y J, WANG W J, et al. Recombinant Miro domain-containing protein ofHaemonchuscontortus(rMiro-1) activates goat peripheral blood mononuclear cellsinvitro[J].VetParasitol, 2017, 243: 100-104.
[16] EHSAN M, GAO W X, GADAHI J A, et al. Arginine kinase fromHaemonchuscontortusdecreased the proliferation and increased the apoptosis of goat PBMCsinvitro[J].ParasitVectors, 2017, 10(1): 311.
[17] MUKAI K, TSAI M, STARKL P, et al. IgE and mast cells in host defense against parasites and venoms[J].SeminImmunopathol, 2016, 38(5): 581-603.
[18] RAPHAEL I, NALAWADE S, EAGAR T N, et al. T cell subsets and their signature cytokines in autoimmune and inflammatory diseases[J].Cytokine, 2015, 74(1): 5-17.
[19] O’SHEA J J, PAUL W E. Mechanisms underlying lineage commitment and plasticity of helper CD4+T cells[J].Science, 2010, 327(5969): 1098-1102.
[20] 宋海飞, 林博文, 龚诚宸, 等. 细胞迁移相关蛋白酶的研究进展[J]. 生物化学与生物物理进展, 2017, 44(2): 99-109.
SONG H F, LIN B W, GONG C C, et al. The research progress on proteases involved in cell migration[J].ProgressinBiochemistryandBiophysics, 2017, 44(2): 99-109. (in Chinese)



