孙 璐,任祯慧,宋润杰,权海云,焦韵洁,黄竹涛,王敬龙,赵宝玉,路 浩*
(1.西北农林科技大学动物医学院,杨凌 712100;2.西藏农牧科学院草业科学研究所,拉萨 850000)
棘豆属植物在世界范围内大约有300种,主要分布在北半球的欧亚和北美等地[1],我国有125种、4个变种和4个变型[2],其中有近10种有毒植物[3],主要分布于内蒙古、新疆、青海、西藏等西部草原[4]。动物采食棘豆属有毒植物后表现有后肢拖地、摇摆,步态不稳,四肢麻痹僵硬,头颈部不断做水平摆动等以运动机能障碍为特征的临床症状,也可导致母畜不孕、流产,公畜不育,胎儿畸形,畜产品质量下降,甚至家畜大量死亡,严重阻碍了畜牧业的健康发展[5-6]。
内生真菌(fungal endophyte)是指在健康植物内寄生、在各种组织器官内部或者细胞间隙中度过全部或近乎全部生活周期而不使寄主表现任何症状的一类真菌,包括菌根真菌和所有植物病原菌在内的一个大类群[7]。1999年,Braun等[8]从疯草中发现内生真菌并初步认为疯草产毒机制与其内生真菌感染有关。随后,Cook等[9]、Gao等[10]和Grum等[11]先后通过qPCR及LC-MS证明棘豆蠕孢菌(Undifilumoxytropis)是棘豆属有毒植物主要毒性成分——苦马豆素(swainsonine)生物合成的根本原因。研究表明,内生真菌在棘豆属有毒植物中分布广泛,路浩等[12]从急弯棘豆中分离到镰刀菌属、裸胞壳菌属和曲霉菌属;陈基萍等[13]从黄花棘豆、兰花棘豆、变异黄芪等中分离到毛壳菌属、梭孢壳属、足孢子菌属等内生真菌;而后周启武等[14]从小花棘豆中分离到链格孢属、镰刀菌属和埃里砖格孢属;路浩等[15]从甘肃棘豆中分离到链格孢属、附球菌属、镰刀菌属等内生真菌。
毛序棘豆(Oxytropistrichophora)属于豆科棘豆属的多年生灌木,根粗壮,茎短被白色硬毛,适应性强,分布于塔什库尔干西部边境,高山带石质山坡[16],在河北、北京、山西阳高县、陕西延安和绥德及甘肃定西等地均有分布[17]。经调查发现,动物一般不主动采食毛序棘豆,且它与其他有毒棘豆的外形相似,因此怀疑该植物属于疯草的一种。但目前有关毛序棘豆的研究较少,特别是尚未见有毛序棘豆内生真菌种类与种群分布特点的报道,因此,本试
验采用表面消毒法分离毛序棘豆内生真菌,运用形态学和ITS序列分析技术进行内生真菌种属鉴定,阐明毛序棘豆内生真菌的种类及种群分布特点,研究结果可进一步丰富棘豆属有毒植物内生真菌多样性,也为毛序棘豆内生真菌次生代谢产物研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 实验所用毛序棘豆植物样本于2016年5月采自甘肃省通渭县,对刚采集的新鲜植物样本作干燥处理后带回实验室保存备用,该植物样品包含根、茎、叶和种子。
1.1.2 主要仪器、设备与试剂 霉菌培养箱(中仪国科)、XP基因扩增仪(杭州博日)、TG16A台式高速离心机(上海卢湘)、冰箱、光学显微镜(厦门麦克奥迪)、凝胶成像分析系统(SYNGENE)、无水乙醇、2%次氯酸钠、2% CTAB分离缓冲液、氯仿、异戊醇、3 mol·L-1NaAc、真菌通用引物ITS1和ITS4、2×EsTaqMAsterMix(Dye)、1×TBE缓冲液、DNA Marker(2 000 bp)、核酸染料(StarGreen)、中性树胶等。
1.1.3 培养基 马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA):马铃薯200 g·L-1,20 g·L-1琼脂粉,20 g·L-1葡萄糖。
1.2 毛序棘豆内生真菌的分离
1.2.1 植物样品的表面消毒 将毛序棘豆植物样品的根、茎、叶、种子用去离子水洗去表面泥沙和尘土,用无菌镊子将植物的根、茎、叶分离后用去离子水浸泡2~3 h,然后在无菌实验操作台对植物组织进行表面消毒。表面消毒的程序:75%酒精漂洗30 s;无菌水漂洗1 min;2%次氯酸钠漂洗2 min;无菌水漂洗1 min,重复4次;由于次氯酸钠消毒作用较强,因此将2%次氯酸钠的消毒时间作适量调整,如表1所示。将最后一次清洗所得灭菌去离子水滴入PDA培养基的表面,做组织印记检测,培养一周后观察该培养基表面是否有其他微生物生长,以此验证表面消毒效果。
表1植物组织表面消毒时间选择
Table1Thesurfacedisinfectionscheduleofplanttissues

min
1.2.2 毛序棘豆内生真菌的分离 将漂洗完的植物的根、茎、叶和种子用已高压过的滤纸包裹,尽可能将水分吸干,然后用手术剪将根、茎剪成2~5 mm,叶剪成3 mm×3 mm的小块,由于毛序棘豆的种子较小,将其剪开,留有创面即可,注意在剪不同植物组织时要用酒精棉球消毒,防止不同组织内的真菌交叉,而后将已剪好的植物组织用无菌镊子分别接种于PDA平板上,每个次氯酸钠时间梯度接两个PDA平板,接种时注意将切口接入培养基内,然后放置于真菌恒温培育箱内,25 ℃培养一周后将具有明显菌落差异的真菌挑取顶端菌丝重新接种到新的PDA平板上,重复该操作直至得到纯化菌株,将其作分离率(isolation rate,IR)分析,来衡量毛序棘豆每个组织部位受内生真菌浸染的程度,而后将纯化菌株接种至PDA斜面培养基上,25 ℃培养一段时间后置于4 ℃冰箱中保存备用。
1.3 毛序棘豆内生真菌的形态学鉴定
根据真菌在PDA培养基上的生长状况,将纯化菌株接种在固体培养基上,每天固定时间记录菌落的生长状况,包括菌落颜色、形态、大小等,在菌落生长到一定阶段,采用菌丝插片的方法制作菌丝玻片,用显微镜观察菌丝、产孢结构、产孢子梗着生情况、孢子形态等微观特征,将所观察记录的结果参考《真菌鉴定手册》[18]对其进行初步种属鉴定。
1.4 5.8S rDNA-ITS序列分析
1.4.1 内生真菌基因组DNA的提取 采用改良CTAB法提取纯化菌株DNA[19]:刮取菌丝置于研钵中,分两次加液氮20 mL,快速研磨成粉末状,称取50 mg于1.5 mL的离心管内,加入600 μL2% CTAB 缓冲液(65 ℃预热),振荡混匀后置于65 ℃水浴锅中45~60 min,期间颠倒混匀3次;加入600 μL混合液(氯仿∶异戊醇=24∶1,-20 ℃预冷),室温孵育3~5 min后,4 ℃ 12 000 r·min-1离心5 min,吸取上清液于新的1.5 mL的离心管,重复三次;将最后一次离心所得上清液吸至2.0 mL的离心管内,加60 μL 3 mol·L-1NaAc溶液(pH 6.0)和900 μL无水乙醇(-20 ℃预冷)轻轻颠倒混匀后,置于-20 ℃的冰箱中1 h以上或过夜;4 ℃ 12 000 r·min-1离心5 min后,弃去上清液,75%的乙醇溶液(-20 ℃预冷)清洗沉淀3次,挥干乙醇;加入30~50 μL ddH2O溶解DNA,而后置于-20 ℃冰箱中保存备用。
1.4.2 5.8S rDNA-ITS片段的扩增与核苷酸序列的测定 5.8S rDNA-ITS片段扩增采用50 μL的PCR体系,该反应体系:真菌通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGC-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)各2 μL,DNA模板3 μL,2×EsTaqMaster Mix 23 μL,ddH2O 20 μL;PCR反应条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃终延伸2 min,4 ℃保温10 min。
将PCR产物用移液枪吸取6 μL点样,并吸取同样体积的DNA marker(2 000 bp),倒入电泳液(1×TAE缓冲液)至刚刚没过电泳胶,连接电泳仪正负极开通电源,电泳条件:电压90 V、电流500 A、40 min;电泳结束后,用凝胶成像仪观察电泳结果。若观察到明显的电泳条带,则将PCR产物吸取20 μL至0.5 mL离心管中,标记后送往测序公司进行检测。
1.4.3 毛序棘豆内生真菌的系统进化分析 将测序结果序列与NCBI的DNA数据库进行比对,选出比对结果中相似度较高并且种属关系较近的序列,结合形态学观察确定菌株种属,将所得菌株种属作相对分离频率(relative frequency,RF)分析,来衡量某个属的内生真菌的优势度;然后将测序结果导入到MEGA 5.05软件中采用邻接法(Neighbor-Joining,NJ)构建系统发育树[20],自展次数为1 000次,根据系统发育树判断其亲缘关系,并进行系统进化分析。
2 结 果
2.1 毛序棘豆内生真菌的分离
在对毛序棘豆植物组织进行表面消毒时,将2%次氯酸钠消毒时间作以梯度,接种后观察发现,1和 1.5 min消毒时间下的印记对照平板均被除内生真菌外的其他微生物污染,且在1 min 45 s和2 min 消毒时间下分离所得的内生真菌种类最多,因此次氯酸钠的消毒时间选定为2 min,将在此消毒时间分离并纯化所得菌株,根据其形态合并为29株,将所得数据作分离率分析,可知茎的分离率最高,根和叶次之,而种子中未分离出(表2)。
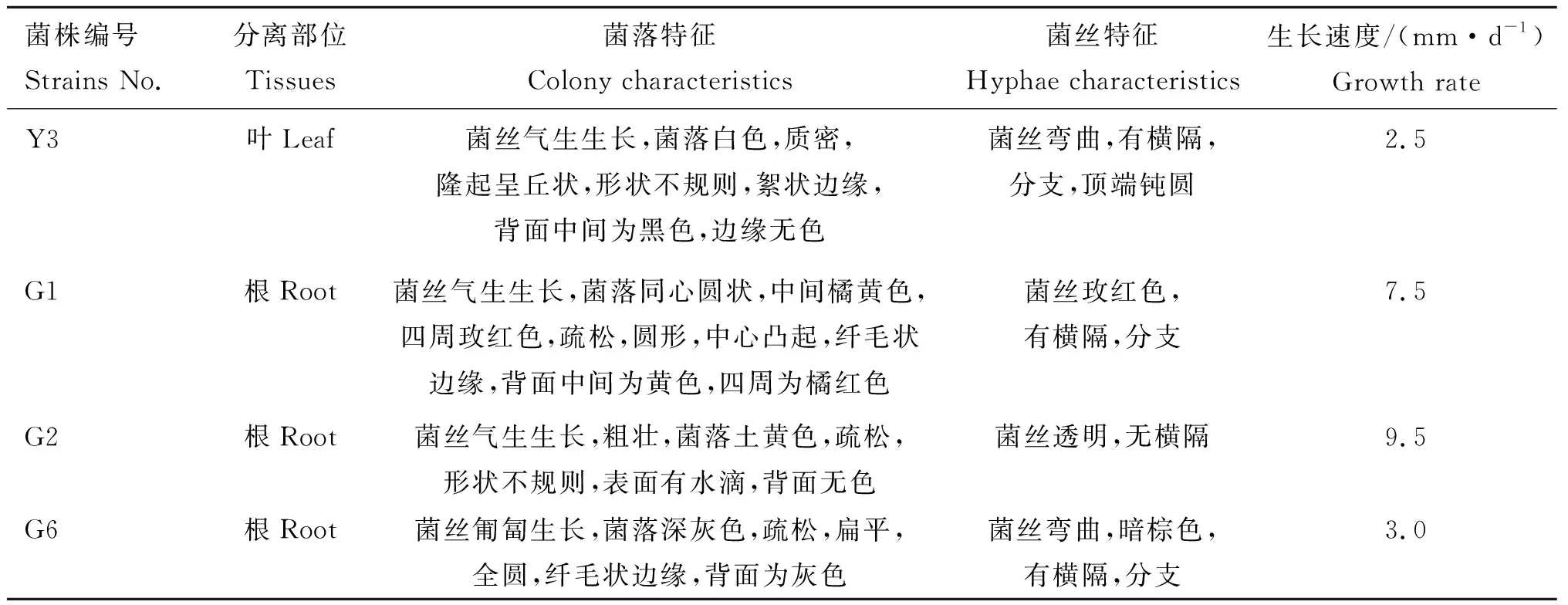
2.2 毛序棘豆内生真菌的形态特征
采用PDA培养基培养纯化后的菌株,在培养过程中记录菌落及菌丝的主要特征,结果如表3所示。
2.3 毛序棘豆内生真菌的5.8S rDNA-ITS序列分析
将PCR产物的测序结果在NCBI上比对,比对结果如表4所示,相似度都高达96%以上,得到分属于4纲,5目,6科,10属,共29种内生真菌,其中有6种未命名,Paraphomasp.(P1235)未见相对应的中文属名(表4),从毛序棘豆不同组织内生真菌的菌属相对分离频率(表5)来看,毛序棘豆内生真菌总相对分离频率为79.31%,其中茎的内生真菌相对分离频率最高,为48.28%,根和叶次之分别为31.03%和20.69%,就分离到的菌属而言,镰刀菌属(Fusariumsp.)分别以17.24%和13.79%的相对分离频率成为根和叶的优势菌属;链格孢菌属(Alternariasp.)以27.59%的相对分离频率成为茎的优势菌属;木霉菌属(Trichodermasp.)的Trichodermaviride(wxm58)广泛存在于根、茎、叶三种组织,部分优势菌属的菌落和菌丝形态如图1所示。
表2毛序棘豆内生真菌分离结果
Table2IsolationresultsofendophyticfungifromOxytropistrichophora

组织部分Tissues2%NaClO灭菌时间/minSterilization time组织块数Tissues number菌落总数Colony number分离率/%Isolation rate叶Leaf254611.11茎Stem2461839.13根Root2461123.91种子Seed25400
表3毛序棘豆内生真菌的形态学特征
Table3MorphologicalcharacteristicsofendophyticfungiformOxytropistrichophora
菌株编号Strains No.分离部位Tissues菌落特征Colony characteristics菌丝特征Hyphae characteristics生长速度/(mm·d-1)Growth rateY3叶Leaf菌丝气生生长,菌落白色,质密,隆起呈丘状,形状不规则,絮状边缘,背面中间为黑色,边缘无色菌丝弯曲,有横隔,分支,顶端钝圆2.5G1根Root菌丝气生生长,菌落同心圆状,中间橘黄色,四周玫红色,疏松,圆形,中心凸起,纤毛状边缘,背面中间为黄色,四周为橘红色菌丝玫红色,有横隔,分支7.5G2根Root菌丝气生生长,粗壮,菌落土黄色,疏松,形状不规则,表面有水滴,背面无色菌丝透明,无横隔9.5G6根Root菌丝匍匐生长,菌落深灰色,疏松,扁平,全圆,纤毛状边缘,背面为灰色菌丝弯曲,暗棕色,有横隔,分支3.0

(转下页 Carried forward)

(转下页 Carried forward)
表4毛序棘豆内生真菌鉴定结果
Table4IdentificationresultsofendophyticfungifromOxytropistrichophora

菌株编号Strains No.属Genus种SpeciesY3壳多隔孢属(Stagonospora)Stagonosporopsis astragali (AS1S2-1)G1镰刀菌属(Fusarium)Fusarium tricinctum(WBS014) G2毛霉属(Mucor)Mucor hiemalis(WBS012) G6壳多隔孢属(Stagonospora)Stagonosporopsis cucurbitacearum(JH3J1-4)G7未定属Fungal sp.(YWZKDF2-1) G8漆斑菌属(Myrothecium)Myrothecium verrucaria(E21) G10-Paraphoma sp.(P1235) GY1镰刀菌属(Fusarium)Fusarium tricinctum(WBS031)GY2镰刀菌属(Fusarium)Fusarium tricinctum(QL1-1)GY3镰刀菌属(Fusarium)Fusarium tricinctum(Z5)GY4镰刀菌属(Fusarium)Fusarium lateritium(MAFF 235344) J1小双胞腔菌属(Didymella)Didymellaceae sp.(sib5-1-2)J2茎点霉属(Phoma)Phoma fungicola (H11_H10_1104035152Q)J5茎点霉属(Phoma)Phoma medicaginis(1-00219-2)

(转下页 Carried forward)

A. GJY4的菌落;B. GJY4的菌丝10×100;C. JVI的菌落;D. JVI的菌丝10×100;E. J17的菌落;F. J17的菌丝10×100;G. G1的菌落;H.G1的菌丝10×100A. The colony of GJY4; B. The hyphae of GJY4, 10×100; C. The colony of JVI; D. The hyphae of JVI, 10×100; E. The colony of J17; F. The hyphae of J17, 10×100; G. The colony of G1; H. The hyphae of G1, 10×100图1 毛序棘豆内生真菌菌落及菌丝形态Fig.1 Morphology of colonies and hyphae of endophytic fungi from Oxytropis trichophora
将所得菌株采用MEGA软件建立系统发育树(图2),由亲缘关系的远近可以将除去族外菌株Mucorhiemalis(WBS012)的其余菌株分为种群Ⅰ和种群Ⅱ,自检支持率分别为89%和99%;根据亲缘关系远近,种群Ⅰ又可分为种群A和种群B,且自检支持率均为99%。种群Ⅱ又可进一步分为种群C和种群D,自检支持率分别为93%和92%,种群A可分为两个种群,自检支持率分别为60%和62%,种群B内有自检支持率分别为96%、92%的两个种群,而种群C和种群D则无下属的分支。


图2 基于5.8S rDNA-ITS序列由邻近法构建的系统发育树Fig.2 Phylogenetic tree constructed with the program Neighbor-joining (NJ) based on 5.8S rDNA-ITS sequences
3 讨 论
采用表面消毒法将植物组织样本进行消毒,而消毒剂消毒时,通常是由表面缓慢往里渗透的,因此作用时间越长,植物内生真菌被杀灭的可能性越大,被分离出的越少,但是,作用时间太短又不足以杀灭组织表面的微生物,达不到灭菌的效果,因此需要找出植物组织的最佳消毒时间,由于本试验中2%次氯酸钠的消毒作用较强,因此仅将其作用时间作浓度梯度,而后观察到2 min为根、茎、叶的最佳消毒时间。路浩等[12]在急弯棘豆内生真菌的分离鉴定中观察到根、茎、叶、花和种子的最佳消毒时间也是2 min;而曹丹丹等[21-22]在分离变异黄芪和茎直黄芪植株中的内生真菌时发现茎的最佳消毒时间分别为2和3 min,叶和花的最佳消毒时间为3 min;表明同属植物的最佳表面消毒时间有相同的可能,而不同属植物的消毒时间有差异。另外,在培养过程中还发现菌落的生长速率一般在6 d以后有明显或不明显的下降,可见这些菌株的生长周期较短,为快生型菌类。由表2可以看出,茎的分离率最高,为39.13%;根次之,为23.91%;叶为11.11%;而种子中未分离到内生真菌,可能毛序棘豆内生真菌的传播方式为水平传播。此外,路浩等[12]发现急弯棘豆植物样本中,茎和叶中分离到的内生真菌最多,根、花和种子分离到的较少。周启武等[14]发现小花棘豆植株中叶的内生真菌分离率为56.82%,为最高;种子的分离率为42.37%,次之;茎和叶柄的内生真菌分离率在30.00%左右,为最少。随后,路浩等[15]发现甘肃棘豆植株中茎内生真菌的分离率(83.03%)高于叶(57.67%);曹丹丹等[21-22]发现变异黄芪植株中叶的内生真菌分离率最高,为100.00%;花次之,为45.00%;而茎直黄芪根、茎的内生真菌分离率均在80.00%左右。由此可见,内生真菌侵染有毒植物的组织部位较为广泛。
将所得的毛序棘豆内生真菌鉴定后的结果进行分析后,可知(表5)茎的相对分离频率最高,根和叶次之,且远低于茎的相对分离频率,就分离到的菌属而言,镰刀菌属(Fusariumsp.)分别以17.24%和13.79%的相对分离频率成为根和叶的优势菌属,链格孢菌属(Alternariasp.)以27.59%的分离率成为茎的优势菌属,而木霉菌属(Trichodermasp.)在毛序棘豆植物组织内的分布最为广泛,在根、茎、叶中均有分布;路浩等[12]发现在急弯棘豆植株中,分离到镰刀菌属(Fusariumsp.)、裸胞壳菌属(Emericellasp.)、曲霉菌属(Aspergillussp.)的内生真菌;周启明等[14]发现小花棘豆中的优势菌属为镰刀菌属(Fusariumsp.)、埃里砖格孢属(Embellisiasp.)和Undifilumsp.;路浩等[15]发现甘肃棘豆中的优势菌属为Undifilumsp.,曹丹丹等[21-22]发现变异黄芪中优势菌属为炭角菌属和Undifilumsp.,茎直黄芪中的优势菌属为链格孢属(Alternariasp.)和Undifilumsp.,而这五种有毒植物中都分离到镰刀菌属(Fusariumsp.)的内生真菌[12,14-15,21-22],由于镰刀菌属(Fusariumsp.)下属的菌株种类繁多,且一般可通过土壤侵入植物组织,而且镰刀菌能够在土壤中营腐生生活,所以根和土壤中的茎一般较易感染,因此,这也是其分布广泛的原因之一,另外镰刀菌属的变异性较大,有出现高致病性菌株的可能,且危害严重[23];小花棘豆、甘肃棘豆和茎直黄芪中均分离到链格孢菌属(Alternariasp.)的内生真菌[21-22],链格孢菌属(Alternariasp.)分布广泛,种类多样,变异性较大,不但能够感染植物,给农林业造成经济损失,而且其中有些种类甚至可以感染人或动物,危害人畜健康[24]。
4 结 论
通过对毛序棘豆各组织内生真菌的分离与鉴定,共获得10属29种内生真菌;在毛序棘豆各组织中,内生真菌对茎的侵染频率最高,根次之,叶最少;链格孢菌属(Alternariasp.)是毛序棘豆植株茎中的优势菌属,镰刀菌属(Fusariumsp.)是毛序棘豆植株根和叶中的优势菌属。



