范子玲,宋玉锡,张 江,赵 畅,白云龙,孙书函,夏 成
(黑龙江八一农垦大学 动物科技学院,黑龙江 163319)
在过去几十年来,奶牛产奶量在急剧的增加,而生殖性能却逐渐下降。高产奶牛产后的繁殖效率降低,严重影响着世界范围内奶牛业的健康发展[1]。高产奶牛产后的繁殖效率降低,产后第一次排卵和受胎的天数延长[2]。近25年来,英国和美国奶牛的产后首次授精受胎率大约以每年0.5%和1%的速度下降[3]。因此,高产奶牛产后繁殖障碍严重影响着世界范围内奶牛业的健康发展。而卵巢静止属于奶牛产后乏情中的一种,约占奶牛卵巢疾病的26.3%,有时可高达50%以上[4]。在现代奶牛业可持续健康发展中,卵巢静止发病机理的阐明及防治成为一项重要的研究。
目前,与奶牛卵巢静止相关的研究主要是关注某些物质对卵泡生长或卵巢活性等的影响[5-7],对卵巢静止奶牛和健康奶牛整体代谢物变化的研究较少。而代谢物是生命系统调控的下游产物,能够最直接全面的反映出机体的代谢状态,许楚楚等[8]应用核磁共振技术确立了奶牛产后乏情的血浆差异代谢物。范子玲等[9]应用GC/MS技术对卵巢静止奶牛血浆代谢谱进行了分析。
有关奶牛血浆的代谢图谱分析已有进展,但尚未有从奶牛乳清层面进行的代谢研究。奶牛乳清样品产量大,易获取,作为检测样本更方便。本研究利用代谢组1H-NMR技术对卵巢静止奶牛的乳清和血清进行检测,通过对差异代谢物进行代谢通路分析,归纳出卵巢静止奶牛体内的代谢异常,为今后深入研究奶牛卵巢静止的发生机制和防治提供理论依据。
1 材料与方法
1.1 试验动物
本试验开展于黑龙江省某大型集约牛场,奶牛自由采食全混合日粮(TMR),采用散栏式饲养模式。在产后45~60 d,随机选取年龄、胎次、体况相近,泌乳量约为10吨的健康经产荷斯坦奶牛。14头正常发情奶牛为对照组(A),14头卵巢静止奶牛为试验组(B)。泌乳早期TMR主要包括:精料、青贮、干草、脂肪,其含量分别为8~9 kg、17~20 kg、3.5~4.0 kg、300~400 g;TMR营养主要包括:干物质(DM)、粗蛋白、脂肪、钙(Ca)、磷(P)、中性洗涤纤维、酸性洗涤纤维、产奶净能,测定其水平分别为55.60%、16%、5.60%、180 g、116 g、39.10%、20.30%、7.32 MJ·kg-1。
发情奶牛的判定标准:选取产后45~60 d的奶牛,能够自主发情且发情症状明显,经直肠和B超检查,子宫无异常,双侧或单侧卵巢上出现能够发生排卵的卵泡(直径15~20 mm)。
卵巢静止奶牛的判定标准:选取产后45~60 d没有发情表现的奶牛,经直肠和B超检查,子宫无异常,双侧卵巢均没有卵泡发育,或发育卵泡直径小于8 mm。
1.2 样品采集
血液样品的采集:于产后45~60 d,清晨采集空腹奶牛尾静脉血液10 mL,3 000 r·min-1离心10 min,取上清液12 000 r·min-1离心10 min,取上清液分装于1.5 mL离心管中,封口膜包好,液氮速冻,并迅速置于-80 ℃超低温冰箱保存,待测。
乳样的采集:乳样采集与血液采集同时进行,弃前三把乳汁,利用加州乳房炎检测法(CMT)对乳汁样品进行隐性乳房炎的筛查,弃掉有凝胶反应阳性及可疑奶牛样品,将正常奶牛乳样用封口膜包好,液氮速冻,并迅速置于-80 ℃超低温冰箱保存,待测。
1.3 1H-NMR试验
1.3.1 样品前处理 血清样品制备:将血清样品从-80 ℃冰箱中取出,于室温下解冻,每管取600 μL血清加入1 200 μL的甲醇溶液,混匀并于-20 ℃静置20 min充分提取。之后12 000 r·min-1, 4 ℃离心15 min,取上清,用氮吹仪去除甲醇,当溶液剩余1/3时,用封口膜封上管口并戳数个小孔,-80 ℃冰箱冷冻过夜,用冷冻干燥仪将样品冻干成粉末,将冻干的血清样品溶于600 μL含0.05% (w/v)TSP的99.8%的D2O磷酸盐缓冲溶液(0.2 mol·L-1Na2HPO4,0.2 mol·L-1NaH2PO4,pH=7.0),涡旋,并于12 000 r·min-1,4 ℃离心10 min后,取550 μL上清液至5 mm核磁管中待测。
乳清样品制备:将乳汁样品从-80 ℃冰箱中取出,于室温下解冻,每管取2 mL乳汁于10 mL离心管中,再加入4 mL甲醇:乙睛(v/v,1∶1),混匀并于-20 ℃静置20 min充分提取。其余步骤同血清样品制备。
1.3.21H-NMR检测和数据处理 血清和乳清样品的1H-NMR检测在500 MHz核磁共振波谱仪(AVANCE III, Bruker, Switzerland)上进行。测试温度为298 K,D2O和TSP分别用于场频锁定和化学位移参考(1H,0.00 ppm)。脉冲序列采用一种横向弛豫编辑过的Carr-PurcellMeiboom-Gill(CPMG)序列(90(τ-180-τ) n-acquisition)和10 ms的总自旋回波延迟(2nτ)。1H-NMR采集扫描次数(NS)为32,采样点数(TD)为32 k,光谱宽度为10 000 Hz。
血清和乳清样品的所有1H-NMR数据均需在Topspin软件中进行零点、相位、基线的校正,将内参TSP的峰位置调成零点位移。将处理后的谱图导入R软件中,再次对谱图进行零点、基线、相位的校正。对于血清样品谱图,在0.8~8.5 ppm化学位移区间内,采用0.015 ppm单位进行等间距分段积分,来降低数据点数,同时除去水峰及其影响区域4.5~5.18 ppm区间内的共振信号。对于乳清样品谱图,积分区间为0.75~8.4 ppm,水峰及其影响区域为4.4~5.175 ppm。所有的谱图数据进行PQN(probability quotient normalized)标准化处理,之后进行Pareto(mean-centered and pareto-scaled)平均中心化和标度化处理。
运用Chenomx软件进行化合物的指认,对峰进行拟合对比,选定峰型匹配良好的化合物,并结合代谢物组学数据库MMCD和HMDB等,再以统计全相关谱(STOCSY)分析方法对1H-NMR谱进行峰代谢物的辅助指认。
1.3.3 统计分析 经过前期处理的1H-NMR数据导入R软件中,进行多元统计分析和单变量分析。
多元统计分析先采用无监督的主成分分析(PCA)来观察各样本之间的总体分布和整个分析过程的稳定性,然后用有监督的偏最小二乘法OSC-PLS-DA分析来区分各组间代谢轮廓的总体差异,找到组间的差异代谢物。单变量分析主要采用t-检验(正态分布)和秩和检验(非正态分布)评估代谢物组间变化的显着性,通过Benjamini & Hochberg方法校正组间代谢物变化倍率值及其相关P值[10-11],在对数(log2)转化后进行编码。结合两种统计分析方法,最终筛选出差异代谢物。
1.3.4 代谢通路分析 用KEGG数据库搜索差异代谢物的相关代谢通路,再用代谢物通路分析软件MetaboAnalyst 3.0(http://www.metaboanalyst.ca)对差异代谢物进行代谢通路分析。
2 结 果
2.1 发情和卵巢静止奶牛乳清和血清典型1H-NMR图谱
如图1所示,A、B图分别为发情组和卵巢静止组奶牛乳清典型的1H-NMR谱图,图中所有信号峰处于0.5~8.5 ppm,除去4.4~5.175 ppm水峰及其影响区域,并将低场区5.175~8.5 ppm进行扩大200倍以便于观察,其中29种化合物被指认出来。
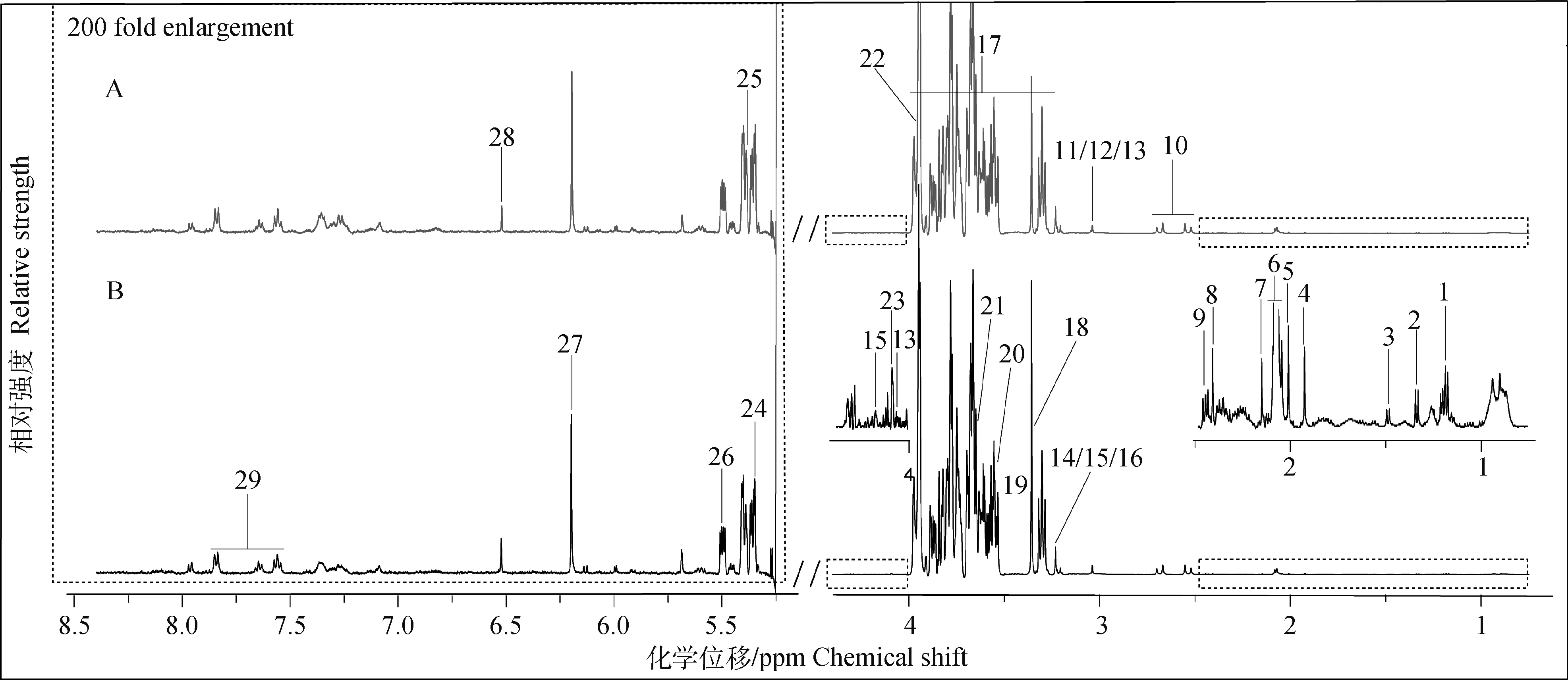
A.发情组奶牛乳清典型的1H-NMR谱图;B. 卵巢静止组奶牛乳清典型的1H-NMR谱图。1. β-羟丁酸;2. 乳酸;3. 丙氨酸;4. 乙酸;5. 乙酰胺;6. N-乙酰碳水化合物;7. 乙酰胆碱;8. 琥珀酸;9. 戊邻酮二酸盐;10. 柠檬酸;11. 肌酸;12. 磷酸肌酸;13. 肌酐;14. 胆碱;15. 磷酸胆碱;16. 甘油磷酸胆碱;17. 乳糖;18. 甲醇;19. 牛磺酸;20. 甘氨酸;21. 肌醇;22. 乙醇酸;23. 半乳糖;24. 麦芽糖;25. 尿囊素;26. 葡萄糖-1-磷酸;27. 乳清酸;28. 延胡索酸;29. 马尿酸A.Typical 1H-NMR spectrum of whey of estrus cows; B. Typical 1H-NMR spectrum of whey of ovarian quiescence cows. 1. β-hydroxybutyrate; 2. Lactate; 3. Alanine; 4. Acetate; 5. Acetamide; 6. N-acetylcarbohydrates; 7. Acetylcholine; 8. Succinate; 9. 2-oxoglutarate; 10. Citrate; 11. Creatine; 12. Creatine phosphate; 13. Creatinine; 14. Choline; 15. O-phosphocholine; 16. Glycerophosphocholine; 17. Lactose; 18. Methanol; 19. Taurine; 20. Glycine; 21. myo-inositol; 22. Glycolate; 23. Galactose; 24. Maltose; 25. Allantoin; 26. Glucose-1-phosphate; 27. Orotate; 28. Fumarate; 29. Hippurate图1 发情和卵巢静止奶牛乳清样品1H-NMR典型谱图(500 Hz)Fig.1 Typical 1H-NMR spectrums (500 Hz) of whey from estrus and ovarian quiescence cows
如图2所示,A、B图分别为发情组和卵巢静止组奶牛血清典型的1H-NMR谱图,图中所有信号峰处于0.5~8.5 ppm,除去4.5~5.18 ppm水峰及其影响区域,并将低场区5.18~8.5 ppm扩大10倍,以便于观察,其中26种化合物被指认出来。
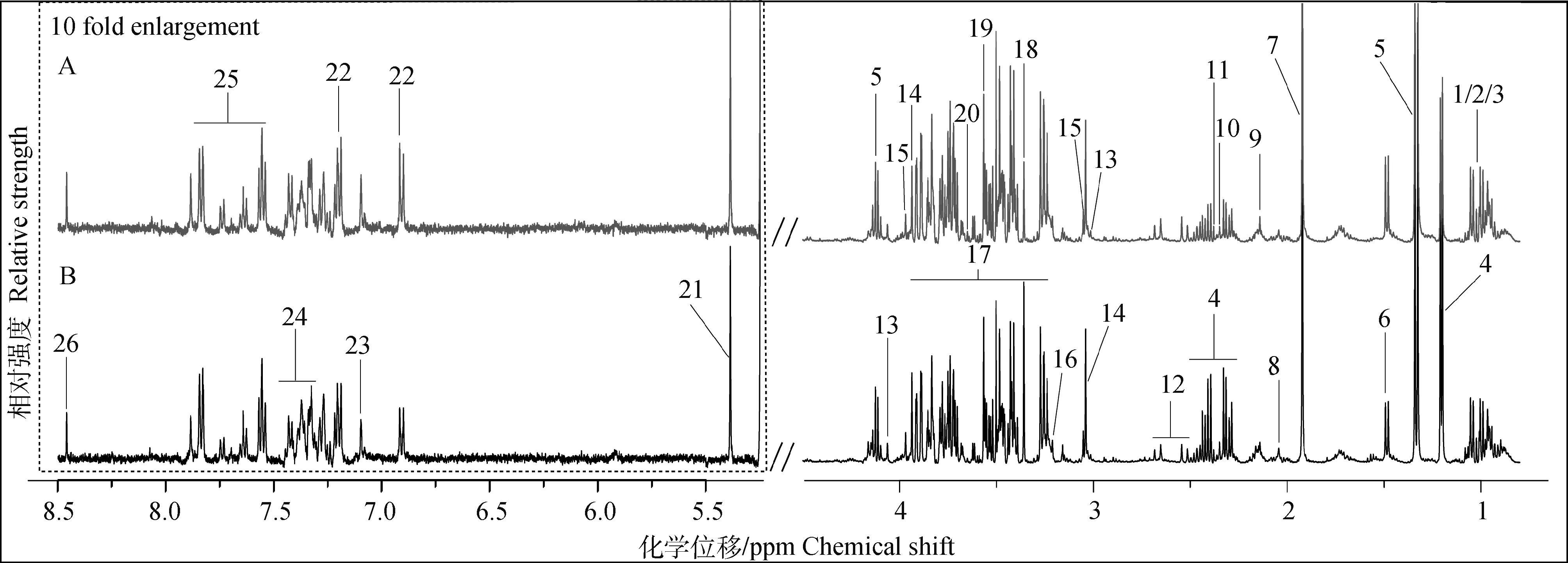
A.发情组奶牛血清典型的1H-NMR谱图;B. 卵巢静止组奶牛血清典型的1H-NMR谱图。1. 异亮氨酸;2. 亮氨酸;3. 缬氨酸;4. β-羟丁酸;5. 乳酸;6. 丙氨酸;7. 乙酸;8. 谷氨酸;9. 谷氨酰胺;10. 丙酮酸;11. 琥珀酸;12. 柠檬酸;13. 肌酐;14. 肌酸;15. 磷酸肌酸;16. 磷酸胆碱;17. 葡萄糖;18. 甲醇;19. 甘氨酸;20. 肌醇;21. 尿囊素;22. 酪氨酸;23. 苯丙氨酸;24. 马尿酸;25. 组氨酸;26. 甲酸A.Typical 1H-NMR spectrum of serum of estrus cows; B. Typical 1H-NMR spectrum of serum of ovarian quiescence cows. 1. Isoleucine; 2. Leucine; 3. Valine; 4. β-hydroxybutyrate; 5. Lactate; 6. Alanine; 7. Acetate; 8. Glutamate; 9. Glutamine; 10. Pyruvate; 11. Succinate; 12. Citrate; 13. Creatinine; 14. Creatine; 15. Creatine phosphate; 16. Phosphocholine; 17. Glucose; 18. Methanol; 19. Glycine; 20. Myo-inositol; 21. Allantoin; 22. Tyrosine; 23. Phenylalanine; 24. Hippurate; 25. Histidine; 26. Formate图2 发情和卵巢静止奶牛血清样品1H-NMR典型谱图(500 Hz)Fig.2 Typical 1H-NMR spectrums (500 Hz) of serum from estrus and ovarian quiescence cows
2.2 发情和卵巢静止奶牛乳清和血清代谢物的多元统计分析
PCA结果显示,每组样品存在一定的分离趋势,为滤除与分组无关变量,进一步进行OSC-PLS-DA。由奶牛乳清和血清样品1H-NMR数据的OSC-PLS-DA得分图(图3a,3b)可知,发情组和卵巢静止组奶牛分列左右,明显分开,说明两组间差异显着。由彩色S曲线图(图3c,3d)可知,乳清中有11种差异代谢物组间变化显着,血清中有11种差异代谢物组间变化显着。甲醇是由于样品处理时挥发不干净造成的差异,所以不计入差异代谢物。
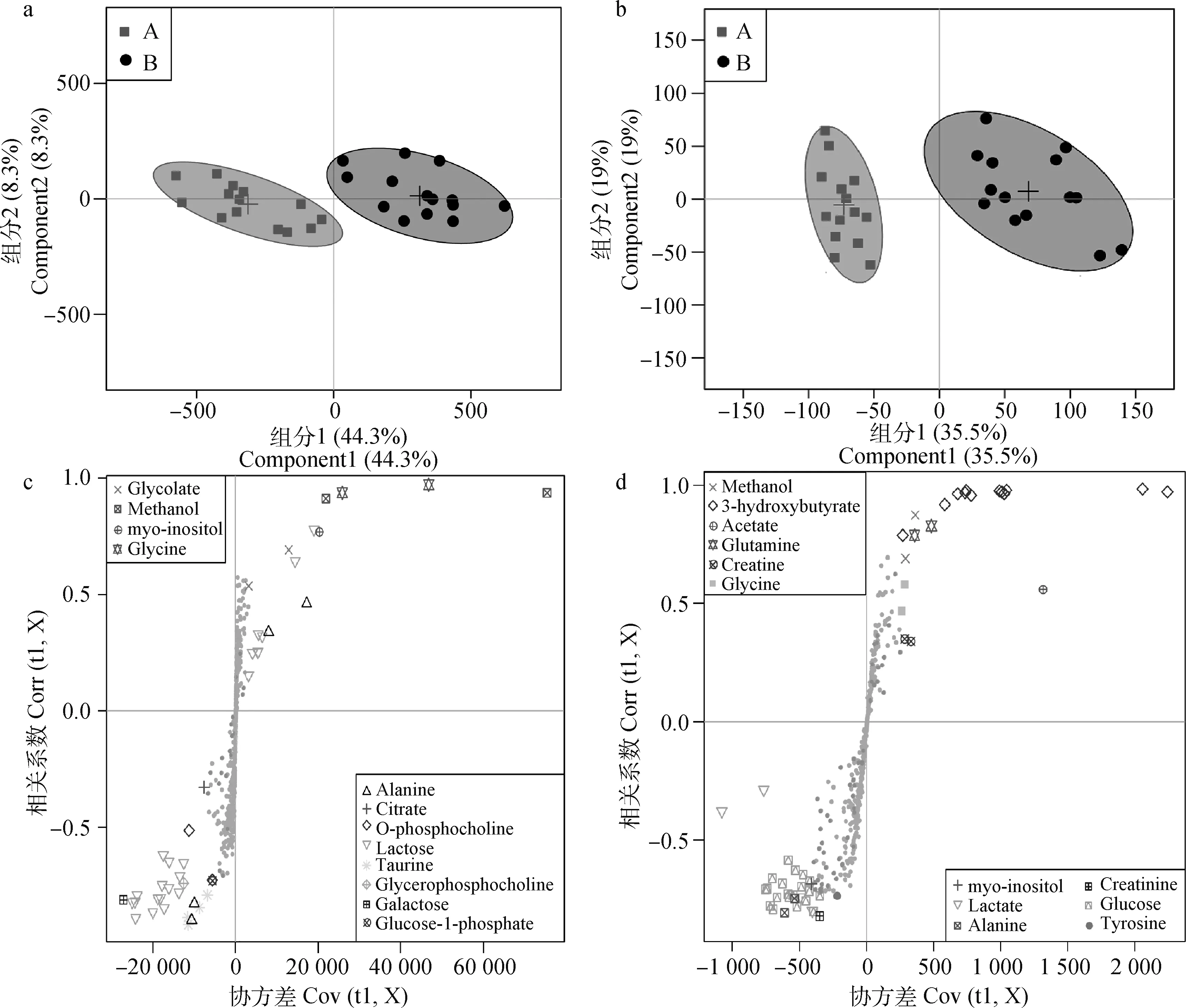
a.乳清得分图;b.血清得分图:一个点代表一个样品,椭圆代表95%的置信区间;A.发情组(■);B.卵巢静止组(●)。c.乳清S曲线图;d.血清S曲线图:不同形状的点代表不同的代谢物,在右上和左下方,离原点越远差异越显着a. The whey score chart; b. The serum score chart: One point represents a sample and the ellipse represents the 95% confidence interval; A. Estrous group (■); B. Inactive ovaries group (●). c. The whey S-plot; d. The serum S-plot: dots with different color and shape represent different metabolites; Dots in the upper right and lower left, the farther away from the origin, the more significant difference图3 发情和卵巢静止奶牛乳清和血清的OSC-PLS-DA得分图和S曲线图Fig.3 OSC-PLS-DA score plots and S-plots in whey and serum from estrus and ovarian quiescence cows
2.3 发情和卵巢静止奶牛乳清和血清代谢物单变量分析
用单变量分析对代谢物进行统计(表1),筛选出乳清中显着变化的代谢物13个,卵巢静止组升高的有琥珀酸、磷酸肌酸、甘氨酸、肌醇、乙醇酸、乳清酸,下降的有丙氨酸、肌酐、磷酸胆碱、乳糖、牛磺酸、半乳糖、葡萄糖-1-磷酸。血清中显着变化的代谢物13个,卵巢静止组升高的有β-羟丁酸、乙酸、谷氨酰胺、甘氨酸,下降的有丙氨酸、琥珀酸、柠檬酸、肌酐、磷酸胆碱、葡萄糖、肌醇、酪氨酸、组氨酸。
2.4 发情和卵巢静止奶牛乳清和血清差异代谢物通路分析
如图4所示,两组奶牛乳清(图4a)差异代谢物主要参与牛磺酸和亚牛磺酸代谢、半乳糖代谢、原代胆汁酸生物合成等。两组奶牛血清(图4b)差异代谢物主要参与丙氨酸、天冬氨酸和谷氨酸代谢、乙醛酸和二羧酸代谢、柠檬酸循环、苯丙氨酸、酪氨酸和色氨酸生物合成等。
表11H-NMR鉴定的发情组和卵巢静止组乳清和血清代谢物及组间倍率和P值
Table1Metabolitesinthewheyandserumidentifiedby1H-NMRandtheirfoldchangesandtheP-valuebetweenestrusandovarianquiescencecows

样品Sample代谢物Metabolite名称Name化学位移a/ppmChemical shiftlog2(FC)bP乳清Galactose半乳糖4.09(t)-0.74∗∗∗乳清Alanine丙氨酸1.48(d)-0.45∗乳清Succinate琥珀酸2.40(s)0.59∗∗乳清Creatine phosphate磷酸肌酸3.04(s)0.23∗乳清Creatinine肌酐3.05(s), 4.07(s)-0.47∗∗乳清O-phosphocholine磷酸胆碱3.22(s), 4.17(s)-1.03∗乳清Lactose乳糖3.30 (t), 3.54 (m), 3.57-3.64 (m), -0.63∗∗3.66-3.94 (m), 3.98 (m), 5.24 (d)乳清Taurine牛磺酸3.43(t)-1.50∗∗∗乳清Glycine甘氨酸3.56(s)0.35∗∗∗乳清Myo-inositol肌醇3.65(dd)0.16∗乳清Glycolate乙醇酸3.95(s)0.25∗乳清Orotate乳清酸6.20(s)0.24∗乳清Glucose-1-phosphate葡萄糖-1-磷酸5.50(m)-0.88∗血清β-hydroxybutyrateβ-羟丁酸1.20(d), 2.31(dd), 2.41(dd)1.01∗∗∗血清Alanine丙氨酸1.49(d)-0.35∗∗∗血清Acetate乙酸1.92(s)0.34∗血清Glutamine谷氨酰胺2.12(m)0.34∗∗血清Succinate琥珀酸2.38(s)-0.33∗血清Citrate柠檬酸3.53(s), 3.67(s)-0.26∗血清Creatinine肌酐3.03(s), 4.06(s)-0.18∗∗血清O-phosphocholine磷酸胆碱3.22(s)-0.38∗血清Glucose葡萄糖3.25 (dd), 3.38-3.56 (m), -0.26∗∗3.69-3.92 (m), 5.24 (d)血清Glycine甘氨酸3.57(s)0.18∗血清Myo-inositol肌醇3.65(dd)-1.18∗∗血清Tyrosine酪氨酸6.91(d), 7.19(d)-0.15∗血清Histidine组氨酸7.10(s), 7.90(s)-0.29∗∗
a.峰的多重性:s. 单峰;d. 双峰;t. 三重峰;m. 多重峰。b.根据log2(FC)进行编码,卵巢静止组相对于发情组,正数表示升高,负数表示下降。*.P<0.05,**.P<0.01,***.P<0.001
a. Peak multiplicity: s. single; d. doublet; t. triplet; m. multiplet.b.Coded according to the log2(FC),positive numbers means rising, negative numbers means falling in ovarian quiescence cows compared to estrus cows. *.P< 0.05,**.P< 0.01,***.P< 0.001

a.乳清代谢物主要参与的通路;b. 血清代谢物主要参与的通路。气泡面积表示通路的影响大小,颜色越深表示通路意义越大a.The pathways involved by metabolites in whey; b.The pathways involved by metabolites in serum.Bubble area is proportional to the impact of each pathway, the darker the color, the greater the meaning of the pathway图4 发情和卵巢静止奶牛乳清和血清差异代谢物通路分析Fig.4 Pathway analysis of the differential metabolites in whey and serum of estrus and ovarian quiescence cows
3 讨 论
乳中差异代谢物与血中差异代谢物联系起来可构建成一个代谢互作网络图(图5),通过网络图来进一步揭示差异代谢物与卵巢静止的关系,主要表现为:糖代谢过程减弱、氨基酸代谢异常、脂动员增强。
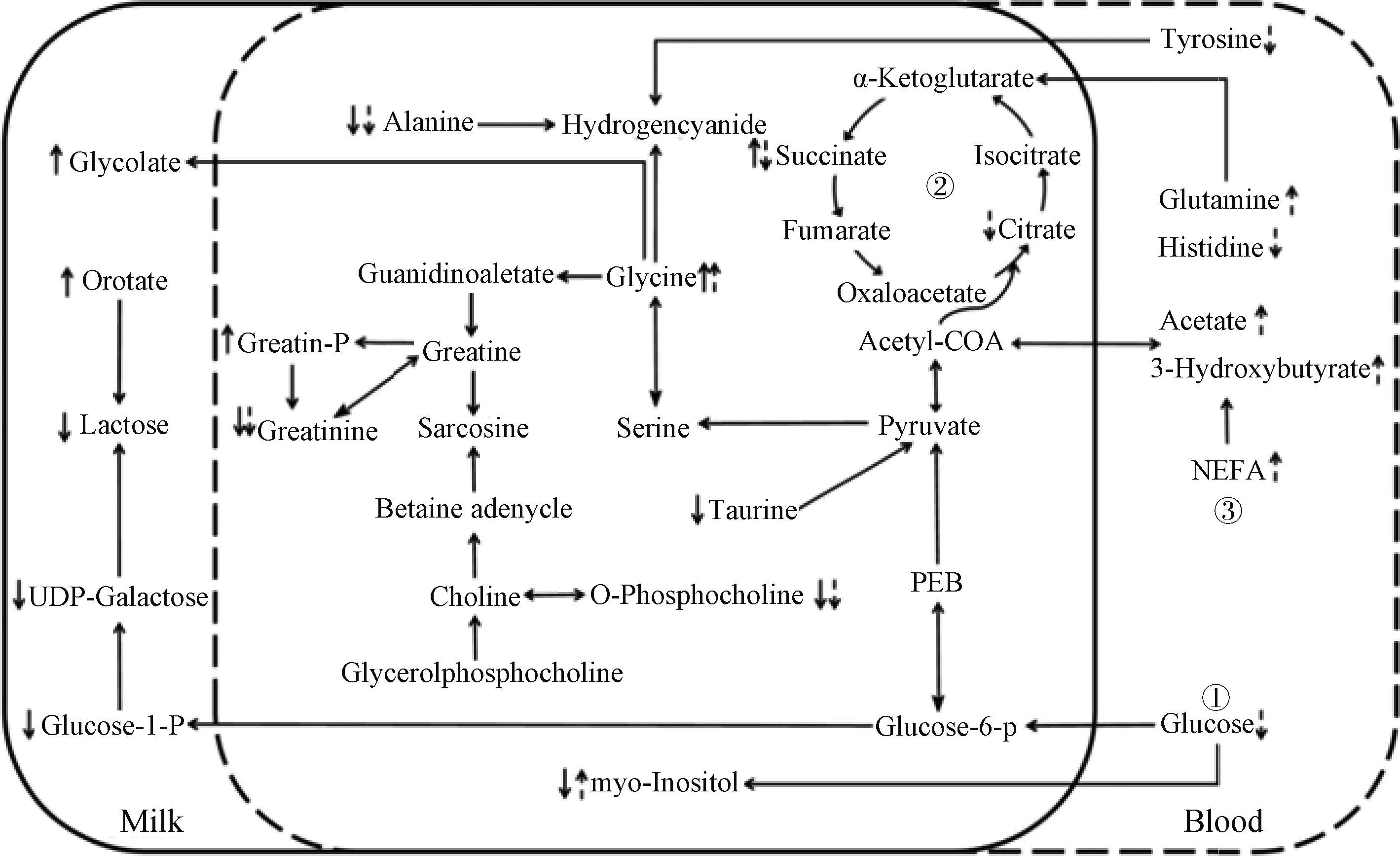
↑和↓分别代表增加和减少,实线箭头表示乳清中的变化,虚线箭头表示血清中的变化。①糖代谢;②三羧酸循环;③脂代谢↑ and ↓ represent increase and decrease, solid arrows indicate changes in whey, dashed arrows indicate changes in serum. ①glucose metabolism; ②tricarboxylic acid cycle; ③lipid metabolism图5 乳清和血清差异代谢物网络互作图Fig.5 The network interaction diagram of differential metabolites in whey and serum
3.1 卵巢静止奶牛糖脂代谢变化
乳糖是乳中最稳定的成分,是维持乳腺正常渗透压的主要物质。只有乳腺才能合成乳糖。由于乳腺中缺乏葡萄糖-6-磷酸酶,限制糖异生,所以乳腺中所需的葡萄糖都来自于血液[12]。因此,卵巢静止奶牛乳糖降低主要是血中葡萄糖降低或供应不足所引起的。由于泌乳需要大量葡萄糖来合成乳糖[13],会降低奶牛血糖,引起能量负平衡,从而抑制奶牛发情。在乳腺内乳糖合成酶的催化作用下,一部分葡萄糖先转化为半乳糖,之后再与葡萄糖结合生成乳糖。其余葡萄糖在乳腺中的代谢包括:(1)转换为葡萄糖-6-磷酸,在磷酸葡萄糖变位酶的作用下生成葡萄糖-1-磷酸,进而产生UDP-半乳糖;(2)进入戊糖磷酸途径产生还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH);(3)通过三羧酸循环(TCA)完全氧化供能;(4)转化为甘油进行三酰甘油的合成[14]。在本试验中,卵巢静止组奶牛乳中乳糖、半乳糖、葡萄糖-1-磷酸均显着的下降,这是由于奶牛本身处于能量负平衡状态,饲料供应和异生的葡萄糖不能满足泌乳合成乳糖的需要,也无法满足奶牛产后生殖机能恢复所需的能量,就无法维持卵巢卵泡的正常发育。而卵巢静止奶牛血中葡萄糖、琥珀酸和柠檬酸也降低,提示通过TCA供能的途径减弱,不能给卵泡提供足够的能量物质,会使NADPH供氢体不足,进而使性激素的合成减少,致使卵泡发育不良。
卵巢静止奶牛糖代谢供能不足,NEFA和BHBA升高,刺激机体脂动员增强,提供能量来满足机体对能量需求[15]。血中乙酸的升高,乙酸在肝细胞中转化成乙酰CoA,此过程中会消耗肝细胞内的ATP;BHBA和乙酸生成的乙酰CoA进入TCA,彻底氧化供能[16]。在本试验中,TCA的氧化供能减弱,机体供能不足,不能缓解能量负平衡。反而,NEFA和BHBA的增加会提高酮病或脂肪肝发生的风险[17]。而且,NEFA对卵泡颗粒细胞和卵母细胞的生成发育存在毒性,这些都影响奶牛卵泡的正常发育,导致奶牛卵巢静止。
牛磺酸是有机酸和胆汁的主要成分。牛磺酸可通过血液循环分泌到乳汁中。牛磺酸已被证明可以降低载脂蛋白B100和脂类的分泌,其是极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)的组成部分[18],VLDL是奶牛肝中的重要转运蛋白,具有转移三酰甘油的作用。因此,本试验中牛磺酸的降低,提示奶牛产后处于能量负平衡状态,机体体脂动员产生多余三酰甘油,因牛磺酸降低会影响VLDL合成,会使更多的三酰甘油沉积肝,影响糖异生供能,会加重能量负平衡,进而影响奶牛产后发情。
磷酸胆碱参与脂类代谢,是合成磷脂酰胆碱的前体[19]。磷脂酰胆碱在膜介导的信号传导中起作用。磷脂酸与Raf-1(丝氨酸/苏氨酸蛋白激酶-1)结合并促进其募集到质膜上,通过与网状激活系统(Ras)直接相互作用被激活。Ras介导的Raf-1激活导致促分裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3-激酶/丝氨酸激酶(PI3K/Akt)激活[20]。在本试验中,卵巢静止奶牛血中磷酸胆碱含量降低,可能会使磷脂酸含量降低,影响RAS-MAPK信号转导通路,进而抑制卵泡发育,导致奶牛卵巢静止发生。
3.2 卵巢静止奶牛氨基酸代谢变化
酪氨酸、组氨酸和丙氨酸均为生糖氨基酸,都是通过TCA来完成生糖过程。丙氨酸是一种由碳水化合物丙酮酸盐转化而来的非必需氨基酸,丙酮酸是葡萄糖酵解产生的关键性中间物质。其可转化为乙酰辅酶A,然后通过TCA实现机体内糖、脂肪和蛋白质三大物质之间的转化[21]。在本试验中,卵巢静止组奶牛血中酪氨酸、组氨酸和丙酮酸含量均下降,提示卵巢静止奶牛的生糖氨基酸不足或消耗过多。因此,生糖氨基酸供能障碍会引起奶牛卵泡不发育,造成奶牛卵巢静止。
谷氨酰胺和甘氨酸既是生糖氨基酸,也是合成谷胱甘肽的前体物质[22],谷胱甘肽也是特别重要的抗氧化剂,保护细胞免受自由基损伤[23]。在雄性和雌性的配子中,谷胱甘肽参与保护这些细胞免受氧化损伤。并且,谷胱甘肽在卵母细胞功能方面的活性包括维持减数分裂纺锤体形态,保护纺锤体免受氧化损伤,确保正常的合子形成[24]。两者在卵巢静止奶牛血中都升高,提示谷胱甘肽或蛋白质分解代谢增强。由于谷胱甘肽合成不足,不能给卵泡细胞提供足够的抗氧化能力,引起卵泡发育的氧化应激,造成发育不良。
3.3 奶牛乳清和血清代谢物的异同
乳中的代谢物来自血液和乳腺的从头合成,并受到乳腺和哺乳期奶牛代谢状态的影响[25]。牛乳中小代谢物主要是乳糖,但乳中还有很多代谢物,如:TCA中间体、氨基酸、有机酸和酮体等。这些代谢物都是由乳腺分泌到牛乳中,由血液中的前体组成[26]。然而,奶牛血液和乳中的成分受到营养摄入、疾病状态和哺乳期的影响,对它们之间的具体代谢关系所知有限[27]。NMR光谱数据中共振强度与它们的代谢物浓度成正比,利用先进的统计学方法可以获得真实的生物信息[28]。Ilves等[29]报道,血浆和乳汁的分子组成之间似乎关联性不大。与乳相比,血液对动物个体的依赖性更高,柠檬酸盐和乳糖的影响最大,因为它们在乳中含量较多。Maher等[27]指出,牛奶是一个独特的代谢室,其代谢物成分在很大程度上不受正常情况下血浆成分的影响。然而,三甲胺和二甲基砜在血浆和乳中存在高度的相关性,并且血浆缬氨酸水平与乳腺中氨基酸分解代谢的差异有关。因此,血清和乳清中变化不一致的差异代谢物琥珀酸可以得到解释。琥珀酸盐是TCA的中间体,并且在线粒体中ATP生成中起关键作用。琥珀酸盐是几种代谢途径交叉路口的重要代谢物,也参与活性氧的形成和消除[30]。由于其参与反应多而复杂,因此,其在卵巢静止奶牛血清中含量降低,乳清中含量升高及肌醇在血清中含量降低,乳清中含量升高,可能是乳腺特殊的需要,或其他综合因素的结果,有待进一步证实。
4 结 论
本试验应用1H-NMR技术,结合多元统计分析、单变量分析及生物信息学分析,筛选出乳清中13种差异代谢物和血清中13种差异代谢物。卵巢静止奶牛乳清和血清中多数代谢物不同或变化不一致,这表明奶牛产后卵巢静止发生时乳清和血清中代谢物存在较大差异。依据乳清和血清的差异代谢物构建了代谢网络图,阐明了奶牛产后发生卵巢静止时机体的糖代谢相关代谢物含量降低,三羧酸循环反应减弱,脂动员相关代谢物含量升高,氨基酸代谢异常,为今后深入研究奶牛产后卵巢静止发生机制和防治策略提供了新的方向。



