张海洋,陆翔宇,张家华,刘 欣,韩政轩,崔 安,赵 元,宋曼玉,刘 涛,范宏刚
(东北农业大学动物医学学院,哈尔滨 150030)
脓毒血症是由外伤感染、创伤、再灌注损伤及缺氧等所诱发的剧烈全身炎症反应综合征。在兽医临床中,脓毒血症主要继发于犬、猫子宫蓄脓,脓皮症及严重外科感染等过程中,如不及时治疗将导致多器官衰竭,最终导致患畜死亡[1]。脂多糖(LPS)是革兰阴性菌细胞壁主要成分,也是脓毒血症引发休克的主要启动因子[2]。近年来,腹腔注射LPS是建立脓毒血症动物模型的常用手段。LPS可造成机体多组织、器官继发性损伤[3-4],海马是其主要损伤靶组织之一[5]。海马是记忆和学习功能的主要场所,当受到有毒物质侵害时,神经胶质细胞,尤其是小胶质细胞会被促炎因子大量激活,释放炎性因子,引起海马炎症,严重时可导致动物行为异常和认知功能障碍[6]。
褪黑素(MT)是由脑松果体合成、分泌的一种吲哚类神经内分泌激素,具有调节机体昼夜节律、保护胆碱、抗氧化、抗炎等功效,参与体内多种生理反应[7]。目前,已应用于催眠、抗衰老、抗癌及抗心脑血管疾病治疗等领域[8-9]。近年来,MT在神经保护方面的作用日益受到重视。研究表明,其能修复受损的神经元突触,促进神经元间的信号交流,延缓神经退行性疾病的发生[10-11]。有研究发现,MT可以通过降低组织中IL-1β、IL-6及TNF-α等含量,改善炎症反应[12]。此外,MT还可上调抗炎因子IL-10和TGF-β蛋白及基因表达[9],发挥免疫调节作用,对抗寄生虫感染所引起的炎症反应[13]。因此,MT可以促进机体的免疫应答,抑制炎性因子的释放,使机体产生抗炎性因子,从而起到抗炎作用。但是,其在脓毒血症致海马炎性损伤中的具体作用尚待研究。
本研究从抑制小胶质细胞活化,减少促炎因子分泌,促进抗炎因子生成的角度,探究MT对LPS致大鼠海马炎性损伤的保护作用,为兽医和医学临床中推进MT在防治LPS导致的脓毒性脑病中的应用提供理论基础和试验依据。
1 材料与方法
1.1 试验动物与饲养
选取4周龄健康雄性SD大鼠40只,体重180~200 g,购自哈尔滨医科大学实验动物中心,进行标准化饲养管理,饲养温度控制在22~24 ℃,相对湿度50%~60%,保持室内光照12 h/12 h昼夜交替,保持通风良好,不限制饮食饮水,所有大鼠饲养1周后进入正式试验。
1.2 主要试剂
脂多糖(LPS,Sigma-Aldrich),褪黑素(MT,百灵威科技),总RNA提取试剂盒(Promega,U.S.),RIPA裂解液、苏木精-伊红(HE)染液(上海碧云天生物技术有限公司),β-actin、IL-10、TGF-β抗体(沈阳万类生物科技有限公司),IL-6、IL-1β、TNF-α抗体(Santa)(北京优维宁生物科技有限公司)。
1.3 仪器设备
3K-15高速低温离心机购自德国Sigma公司,Epoch2酶标仪购自美国BioTek公司,TanonESP300通用型电泳仪、Tanon5200全自动凝胶成像仪均购自上海天能科技有限公司,Forma(-80 ℃)超低温冰箱购自美国Thermo Fisher Scientific公司,Beckman225型自动pH计购自美国Beckman公司,高压蒸汽灭菌器、ZE260微量电子天平均购自杭州汇尔仪器设备有限公司,恒温培养摇床购自上海一恒科技有限公司,玻璃匀浆器购自南通市卫宁实验器材有限公司。
1.4 试验动物分组及处理
将40只健康雄性SD大鼠随机分为4组,分别为空白组(CON组)、模型组(LPS组)、褪黑素干预组(LPS+MT组)及褪黑素组(MT组)。CON组大鼠腹腔注射0.5 mL生理盐水,30 min后再腹腔注射0.5 mL生理盐水。LPS组大鼠腹腔注射0.5 mL生理盐水,30 min后再腹腔注射10 mg·kg-1[2]LPS (0.5 mL)。LPS+MT组大鼠腹腔注射10 mg·kg-1MT (0.5 mL),30 min后再腹腔注射10 mg·kg-1LPS (0.5 mL)。MT组大鼠腹腔注射10 mg·kg-1[14-15]MT (0.5 mL),30 min后再腹腔注射0.5 mL生理盐水。
1.5 大鼠行为学测试
造模4 h后对各组大鼠进行旷场试验,按本实验室前期旷场试验方法[16]加以改进,进行大鼠行为学测试。应用Super Maze软件记录并分析3 min内大鼠的表现,包括运动轨迹、静止时间、总路程以及跨格次数。
1.6 大鼠海马体系数测定
用电子天平称量大鼠体重并记录,按照解剖结构小心剥离大鼠(n= 7)完整海马,用电子分析天平称量海马质量并记录。整理记录的数值并计算海马体系数:
海马体系数(%)=海马重/体重×100。
1.7 大鼠海马HE染色
各试验组中随机选取3只大鼠大脑用于组织病理学观察。异氟醚麻醉后,采用颈椎脱臼法处死试验大鼠,取出大脑,浸入4%多聚甲醛溶液中,4 ℃固定48 h,乙醇梯度脱水,使用二甲苯透明,之后石蜡包埋,切片3~5 μm, HE染色,在光学显微镜下观察脑切片中海马区域病理组织变化。
1.8 实时荧光定量PCR检测Iba-1和CD11b mRNA表达
各试验组中随机选取3只大鼠取海马用于mRNA水平检测。用总RNA提取试剂盒提取总RNA,按试剂盒说明书操作,将mRNA逆转录为cDNA,得到的cDNA用于实时荧光定量PCR(RT-PCR)检测Iba-1和CD11b mRNA相对转录水平。PCR引物见表1,反应体系为:含酶混合物5 μL,ROX液0.2 μL,上、下游引物各0.4 μL,cDNA模板1.0 μL,dd H2O 3.0 μL, 总体积10 μL。扩增条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,95 ℃ 15 s,60 ℃ 1 min,35个循环。mRNA 的相对转录量采用2-ΔΔCT方法计算,并以β-actin为内参基因。
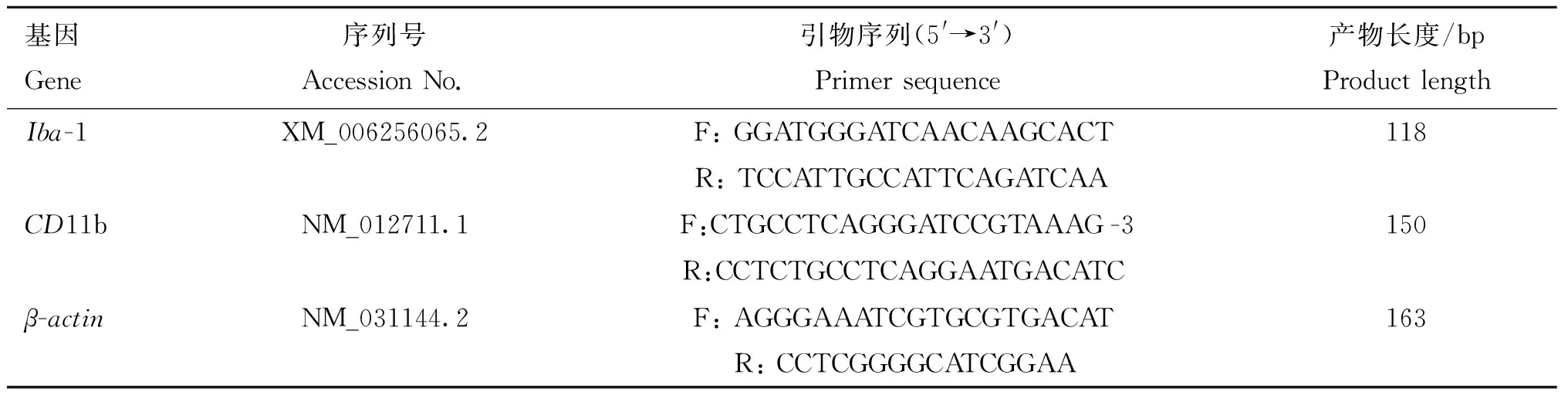
表1 RT-PCR引物序列Table 1 RT-PCR primers sequence
1.9 Western blot法检测炎性因子蛋白表达
各试验组中随机选取4只大鼠海马用于Western blot检测。称取50 mg大鼠海马组织,使用RIPA裂解液提取海马组织蛋白,向蛋白质样品中比例加入PAGE loading buffer,充分混匀,置于100 ℃沸水煮10 min使蛋白质变性。通过制备分离胶和浓缩胶、电泳、转膜、封闭、一抗孵育、二抗孵育和化学自发光等操作对IL-1β、TNF-α、IL-6、IL-10及TGF-β相关蛋白表达量进行检测。
1.10 统计学分析
利用 GraphPad Prism 7软件处理分析本试验获得的所有数据结果并作图,采用SPSS 22.0进行显着性分析。结果采用“平均值±标准差(Mean±SD)”表示,P>0.05表示差异不显着,P<0.05 表示差异显着,P<0.01表示差异极显着。
2 结 果
2.1 MT对LPS导致的大鼠异常行为的影响
旷场试验结果如图1所示,从运动轨迹和运动总路程来看,CON组大鼠活动范围广,运动总路程长;而LPS组大鼠活动范围边缘化,且运动总路程较CON组极显着减少(P<0.01);LPS+MT组与LPS组相比,活动范围广,且总路程较LPS显着增加(P<0.05);而MT组的运动轨迹和运动总路程与CON组相比均无明显差异(P>0.05);从跨格次数来看,LPS组大鼠与CON组大鼠相比,跨格次数极显着减少(P<0.01);MT+LPS组大鼠与LPS组相比,跨格次数显着增多(P<0.05);MT组大鼠与CON组大鼠相比,跨格次数无明显差异(P>0.05);从旷场中静止时间来看,LPS组与CON组相比,静止时间显着增加(P<0.05);MT+LPS组与LPS组相比,静止时间显着减少(P<0.05);MT组与CON组相比,静止时间无明显差异(P>0.05)。
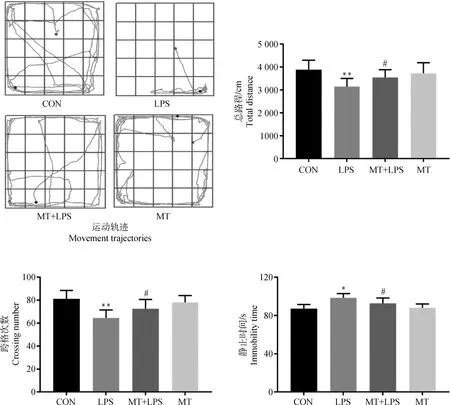
**表示相应LPS组与CON组相比差异极显着(P<0.01);*表示相应LPS组与CON组相比差异显着(P<0.05);#表示相应MT+LPS组与LPS组差异显着(P<0.05);##表示相应MT+LPS组与LPS组差异极显着(P<0.01);无标注表示相应MT组与CON组差异不显着(P>0.05)。下同** indicates that the corresponding LPS group is extremely significantly different from the CON group (P<0.01); * indicates that the corresponding LPS group is significantly different from the CON group (P<0.05);# indicates the corresponding MT + LPS group is significantly different from the LPS group (P<0.05); ## indicates the corresponding MT+LPS group is extremely significantly different from the LPS group (P<0.01); No label indicates that the corresponding MT group is not significantly different from the CON group (P>0.05). The same as below图1 各组大鼠在旷场中运动轨迹、总路程、跨格次数及静止时间Fig.1 The movement trajectories, total distance, crossing number and immobility time of rats in the open field
2.2 MT对LPS导致的海马体系数变化的影响
由于试验持续时间较短,各组大鼠体重变化不明显,LPS作用于海马组织时间较短,未见对海马组织造成实质性损伤,所以各组大鼠的海马体系数之间的差异不明显,具体结果见图2。
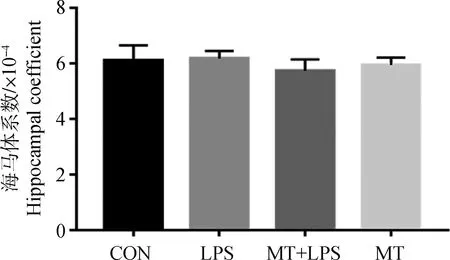
图2 各组大鼠海马体系数Fig.2 Hippocampus coefficient of rats in each group
2.3 MT对LPS导致的大鼠海马组织损伤的影响
对海马组织进行病理组织学观察(图3A)发现,CON组与MT组海马组织神经细胞排列致密整齐,细胞结构完整,细胞核清晰可见,未见明显病变。LPS组海马神经元排列不整,细胞间隙增大(黑色箭头所示),细胞结构不清晰(黄色箭头所示),核固缩、深染,神经细胞变性(红色箭头所示),胶质细胞浸润(蓝色箭头所示)。LPS+MT组海马神经元排列相对规律整齐,细胞形态较正常,细胞间隙稍微增大,变性细胞较少。但各组海马CA1区神经细胞数量并无显着变化(图3B)。

CON组和MT组海马组织神经细胞排列紧密整齐,细胞结构完整,细胞核清晰可见,未见明显病变。LPS组神经细胞排列紊乱,细胞间隙增大(如黑色箭头所示),细胞结构不清晰(如黄色箭头所示),细胞核固缩深染,神经细胞变性(如红色箭头所示),并伴有胶质细胞浸润(如蓝色箭头所示)。LPS+MT组海马神经元排列相对规律整齐,细胞形态较正常,细胞间隙稍微增大,变性细胞较少(如红色箭头所示)The hippocampal nerve cells of CON group and MT group were arranged in tight and neat arrangement, with intact cell structure, clear nucleus and no obvious lesions. In the LPS group, the nerve cells were disordered, the cell space was enlarged (as shown in the black arrows), the cell structure was unclear (as shown in the yellow arrows), the nuclei were pyknosis and deep stained, the nerve cells degenerated (as shown in the red arrow), and glial cell infiltrated (as shown in the blue arrow). In the LPS+MT group, the nerve cells were relative regular and neat, cells morphology were normal, intercellular space slightly enlarged, less cells degenerated (as shown in the red arrows)图3 MT对各组大鼠海马CA1区HE染色切片(A,400×)及神经细胞数量(B)Fig.3 HE staining sections(A,400×) and the number of nerve cells of hippocampal CA1 area of rats in each group (B)
2.4 MT对LPS诱导大鼠海马Iba-1和CD11b mRNA表达的影响
RT-PCR检测结果显示(图4),与CON组相比,LPS组海马组织Iba-1和CD11b mRNA表达量极显着升高(P<0.01),LPS+MT组与LPS组mRNA 表达量差异极显着降低(P<0.01),MT组与CON组相比,mRNA表达量无明显差异(P>0.05)。

图4 各组Iba-1和CD11b mRNA表达情况Fig.4 Iba-1 and CD11b mRNA expression in each group
2.5 MT对LPS导致大鼠海马IL-1β、TNF-α、IL-6、 IL-10及TGF-β蛋白表达的影响
Weston blot结果表明(图5),与CON组相比,LPS组促炎性因子IL-1β、TNF-α及IL-6蛋白表达极显着增加(P<0.01);LPS+MT组与LPS组相比,以上促炎因子蛋白表达均极显着减少(P<0.01);而MT组与CON组相比,以上促炎性因子蛋白表达均无明显差异(P>0.05);与CON组相比,LPS组抗炎性因子IL-10和TGF-β的蛋白表达极显着减少(P<0.01),LPS+MT组与LPS组相比,以上抗炎因子蛋白表达极显着增加(P<0.01),MT组与CON组相比,以上抗炎因子蛋白表达差异不显着(P>0.05)。

图5 各组大鼠海马中促炎因子IL-1β、TNF-α和IL-6及抗炎因子IL-10和TGF-β蛋白表达Fig.5 The protein expression of hippocampal pro-inflammatory factors IL-1β, TNF-α and IL-6, as well as anti-inflammatory factors IL-10 and TGF-β in each group
3 讨 论
LPS是脓毒血症的主要的致病因素之一,可导致海马损伤,主要表现为认知障碍及行为异常[17]。本研究发现,对大鼠腹腔注射LPS后,大鼠的自主探索行为减少及运动能力降低。海马组织病理切片也观察到,海马神经细胞排列松散,细胞间隙增大,细胞结构不清晰,核固缩、深染,神经细胞变性,胶质细胞浸润等现象。因此,LPS致大鼠海马炎性损伤模型建立成功。有研究表明,小胶质细胞过度激活是神经炎症的标志[18-20]。当中枢神经系统感受到刺激后,小胶质细胞能快速增殖活化,在吞噬坏死的细胞组织碎片的同时,也会释放大量IL-1β、IL-6和TNF-α等促炎因子,从而介导炎症的发生[21-23]。在本研究中,大鼠注射LPS后,小胶质细胞激活标志物Iba-1和CD11b的mRNA表达显着增加,促炎因子IL-1β、IL-6和TNF-α蛋白表达显着增加,抗炎因子IL-10和TGF-β蛋白表达显着减少。以上结果表明,LPS激活海马小胶质细胞进而调控炎性因子的释放,诱发海马炎性反应。
MT是由松果体合成并分泌入血及脑脊液中,以调控睡眠等生物周期节律的一种胺类激素[24-27]。研究发现,MT可通过减少IL-1β和IL-6的释放改善各种因素如手术创伤、铝中毒、甲基苯丙胺中毒以及老龄等导致的脑损伤[7,28-29]。在本研究中,LPS+MT组大鼠在旷场中的自主探索能力和运动能力较LPS组增强,海马组织病变较LPS组明显减轻,表明MT改善了LPS导致的海马损伤。在体外试验中,MT可抑制LPS诱导的小鼠小胶质细胞系BV-2的活化,且对LPS导致的神经干细胞的损伤有明显缓解作用[30-31]。此外,有研究报道,MT可降低LPS诱导的小鼠脾脏炎性因子IL-1和TNF-ɑ的分泌,同时增加抗炎性因子IL-10的分泌[32]。另有研究表明,在小鼠乳腺组织中MT可抑制LPS诱导的TNF-ɑ、IL-1β和IL-6的生成[33]。在本研究中,LPS+MT组大鼠海马中Iba-1和CD11b mRNA表达较LPS组显着下降,IL-1β、TNF-α及IL-6蛋白表达较LPS组显着下降,而IL-10和TGF-β蛋白表达较LPS组显着增加。以上结果表明,MT可抑制小胶质细胞激活,减少促炎因子释放,促进抗炎因子生成,进而改善LPS造成的大鼠海马炎性损伤。然而,LPS只是脓毒血症的主要致病因素之一,本研究模拟发生脓毒血症时LPS导致的海马炎性损伤并探究MT对其保护作用及机制。但脓毒血症的主要致病因素还包括细菌增殖和扩散等。因此,MT是否对除LPS以外的其他致病因素导致的脓毒性脑病起保护作用及其保护作用机制尚待进一步研究。
4 结 论
LPS可激活小胶质细胞,使其释放促炎因子IL-1β、IL-6和TNF-α导致海马炎性损伤,进而导致动物行为异常及认知功能障碍。MT可抑制LPS诱导的小胶质细胞活化,减少促炎因子的释放,同时增加抗炎因子的生成,进而改善LPS造成的大鼠海马炎性损伤。



