曹玉颖,王 杰,张希墨,吴琴尧,邱基程,李淑媛,张 璐,龚晓会,白如念,曹兴元*
(1.中国农业大学动物医学院,北京 100193;2.国家兽药残留基准实验室,北京 100193;3.北京市动物疫病预防控制中心,北京 100013)
盐酸多西环素属于四环素类抗生素,具有高效、长效、广谱等优点,抗菌效果是同类药物的2~4倍,属于快速抑菌剂,高浓度时具有杀菌作用,临床上主要用于治疗畜禽的支原体病、沙门菌病、大肠杆菌病和巴氏杆菌病等[1]。随着药物的广泛应用,药物残留问题引起社会的广泛关注,根据我国农业农村部发布的GB 31650—2019标准,多西环素在猪、鸡和牛等靶动物组织中的最高残留限量(MRL)均为皮+脂肪300 μg·kg-1、肌肉100 μg·kg-1、肾600 μg·kg-1、肝300 μg·kg-1 [2]。国内外对于盐酸多西环素不同制剂在猪、鸡、蛋、鱼和奶中的残留消除研究已有不少报道,但盐酸多西环素在羊上的研究还未见报道[3-7]。本试验旨在研究口服给予盐酸多西环素片后,确定多西环素在羔羊组织中的残留消除规律并计算其休药期,为盐酸多西环素片在羊临床疾病治疗上提供相关依据,保障消费者的食品安全。
1 材料与方法
1.1 试剂与药品
盐酸多西环素片:10 mg·片-1,批号为兽药字030462604,河北省远征禾木药业有限公司提供;盐酸多西环素标准品:含量≥ 98.7%,批号为20104,购自德国Dr. Ehrensorfer公司;超纯水:由Milli-Q超纯水仪制取;甲醇、乙腈均为色谱纯;磷酸氢二钠、枸橼酸、草酸、乙二胺四乙酸二钠(Na2-EDTA)、硫酸、草酸、钨酸钠和三氟乙酸均为分析纯。
1.2 主要仪器设备
高效液相色谱仪:Agilent 1260 HPLC-VWD;R 200 D感量0.000 01 g分析天平,德国Sartofius公司;KQ-500B型超声波清洗器,昆山市超声仪器有限公司;Centrifuge 5804R高速冷冻离心机,德国Eppendorf公司;MP 2002感量0.01 g天平,上海舜宇恒平科学仪器有限公司;Waters 200606固相萃取装置;N-EVAP-112氮吹仪,美国Organomation Associate公司;F-50无油真空泵,天津市科亿隆实验设备有限公司;6 cc/500 mg HLB固相萃取柱,Waters公司。
1.3 实验动物
健康小尾寒羊羔羊40头,雌雄各半,体重为15~20 kg, 其中,对照组5头,给药组35头。
1.4 给药与样品采集
给药组35只羔羊按照推荐剂量给药(5 mg·kg-1内服给药,每天1次,连用5 d)。于最后1次给药后分别在第0(12小时)、1、2、3、5、7和9天,随机选择5只 羔羊进行屠宰,快速取其肌肉、肝、脂肪和肾等组织(各组织样品约250 g),用滤纸吸取脏器表面血液。对照组未用药羊于第0天采集相同组织作为空白对照。
1.5 样品处理与检测
1.5.1 提取 不同样品提取方法如下。
1.5.1.1 脂肪:准确称取均质试料(1.00±0.01)g放置于10 mL离心管中,加ACN∶H2O=1∶9 的溶液2 mL,涡旋1 min,40 ℃超声5 min,4 ℃ 12 000 r·min-1离心10 min,取上清液。将残渣重复上述步骤重复提取1次,合并2次上清液,于-80 ℃ 冷冻除脂5 min,4 ℃ 12 000 r·min-1离心5 min, 取出上清液,备用。
1.5.1.2 肌肉、肝:准确称取均质试料(5.00±0.05)g放置于50 mL离心管中,加入提取液EDTA·2 Na-Mcllvaine缓冲溶液20 mL,涡旋1 min并振荡10 min,加0.34 mol·L-1硫酸溶液5 mL、7%钨酸钠溶液5 mL,并涡旋1 min,4 ℃ 8 500 r·min-1离心5 min,取上清液。残渣用提取液EDTA·2 Na-Mcllvaine缓冲溶液20、10 mL分别重复提取,合并3次上清液,中性滤纸过滤后,备用。
1.5.1.3 肾:准确称取均质试料(2.00±0.02)g,放置于50 mL离心管中,加入提取液EDTA·2 Na-Mcllvaine缓冲溶液10 mL,涡旋1 min,并振荡10 min, 加0.34 mol·L-1硫酸溶液2 mL、7%钨酸钠溶液2 mL,并涡旋1 min,4 ℃ 8 500 r·min-1离心5 min,取上清液。残渣用EDTA·2 Na-Mcllvaine缓冲溶液10 mL重复提取2次,合并3次上清液,中性滤纸过滤后,备用。
1.5.2 样品净化 使用HLB小柱进行样品净化,HLB柱依次用甲醇、水和EDTA·2 Na-Mcllvaine缓冲溶液各5 mL进行活化,然后将备用液全部过柱,依次用10 mL水和10 mL 5 %甲醇溶液淋洗,用真空泵干燥30 s,最后用5 mL甲醇洗脱并收集洗脱液于10 mL刻度试管中,于40 ℃水浴氮气吹至0.5~1.0 mL,用0.01 mol·L-1草酸溶液定容至2.0 mL,过滤,供高效液相色谱测定。
1.5.3 液相色谱条件 色谱柱C18(4.6 mm×150 mm,4 μm);流动相A为0.01 mol·L-1三氟乙酸溶液,B为乙腈,梯度洗脱,详情见表1;流速1.0 mL·min-1; 进样量50 μL;检测波长350 nm;柱温30 ℃。

表1 流动相梯度洗脱条件
1.6 方法学验证
1.6.1 标准曲线的制备 精密称取盐酸多西环素标准品10 mg,用色谱级甲醇配制成浓度1 mg·mL-1的储备液。使用0.01 mol·L-1草酸溶液将储备液稀释成浓度为50、100、200、500、1 000、 2 000、5 000 ng·mL-1的系列标准液,进行高效液相色谱测定。以标准溶液浓度为横坐标,测得的峰面积为纵坐标,并绘制标准曲线,求回归方程和相关系数。
1.6.2 灵敏度 按信噪比S/N≥3确定检测限(LOD),S/N≥10确定定量限(LOQ)。
1.6.3 准确度和精密度 在羔羊的可食性空白组织中添加定量限、MRL和2MRL 3种不同浓度盐酸多西环素标准溶液,每个浓度制备5个平行样品,重复3批次(连续测定3天),计算多西环素回收率、批内及批间变异系数。
2 结 果
2.1 标准曲线
样品中盐酸多西环素的色谱分析见图1。
采用带有加权因子(1/x2)一阶矫正类型来绘制不同浓度点之间的“最佳拟合”直线,以实现3条校正曲线中理论值与实测值的偏差平方和最小化,回归方程y=0.044x-0.414,R2=0.999,表明多西环素浓度在50~5 000 ng·mL-1色谱峰面积与浓度呈线性相关。
2.2 灵敏度
本方法测得多西环素在羔羊的肌肉组织中检测限为20 μg·kg-1(S/N≥3),定量限为50 μg·kg-1(S/N≥10);在羔羊的肝组织、肾组织、脂肪组织的检测限为50 μg·kg-1(S/N≥3),定量限为100 μg·kg-1(S/N≥10)。
2.3 准确度和精密度
多西环素在羔羊肌肉、肾、肝和脂肪中的回收率以及批内和批间变异系数见表2。组织中多西环素的回收率为60.49%~116.8%,批内、批间变异系数均小于15%。
2.4 组织中药物残留
每个采样时间各组织中的多西环素残留量如表3所示。结果表明:最后1次给药后第12小时,各组织药物残留浓度高低顺序依次为肾>肝>肌肉>脂肪,脂肪组织中的药物残留量低于定量限。最后1次给药后第1天,肌肉、肝和脂肪组织中的多西环素药物残留浓度均已低于检测限,肾组织中的多西环素药物残留浓度低于定量限,说明盐酸多西环素片在羔羊组织内代谢快速。
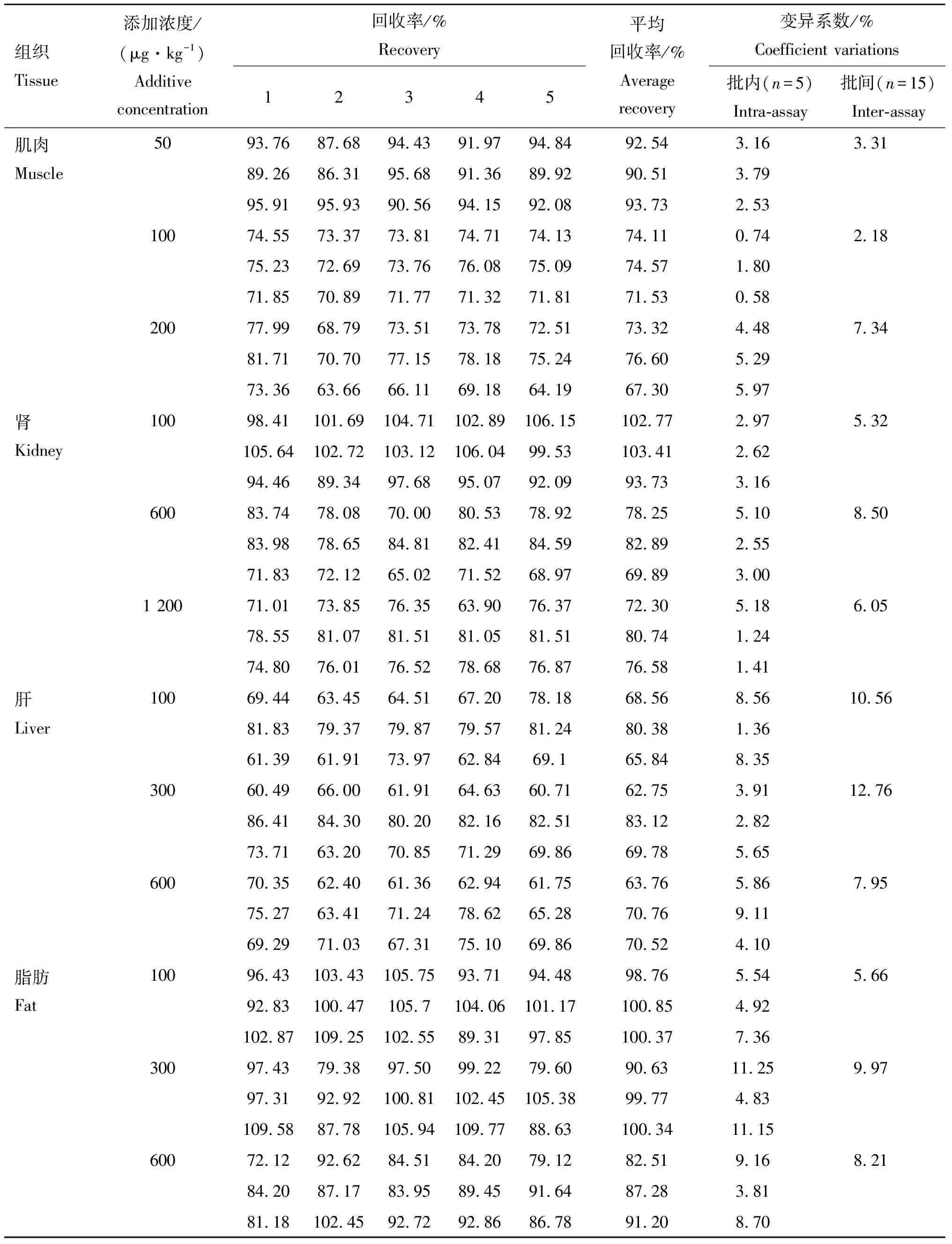
表2 多西环素在羔羊肌肉、肾、肝和脂肪中的回收率及变异系数
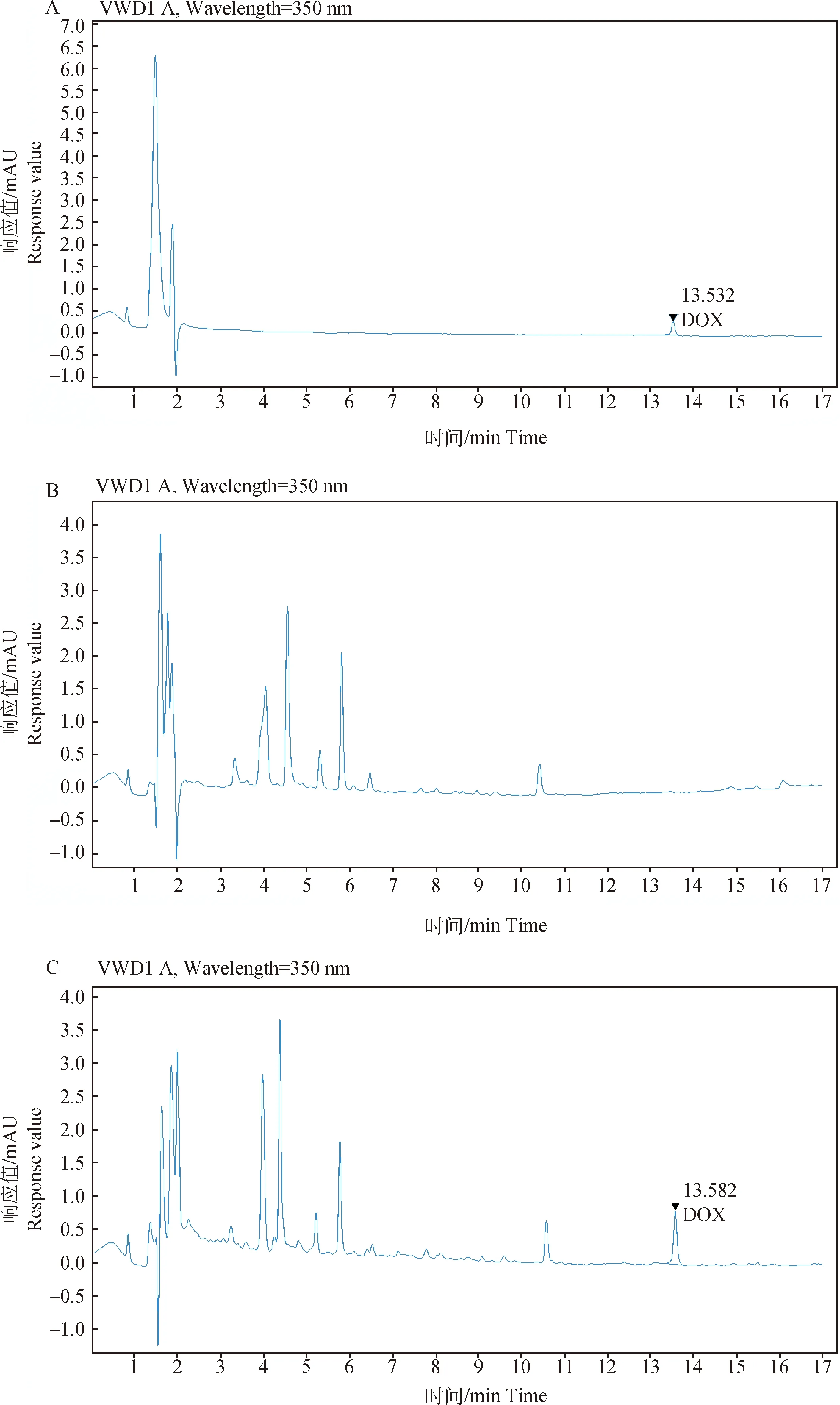
A. 盐酸多西环素标准溶液(50 ng·mL-1); B.空白肌肉组织; C.空白肌肉组织添加50 ng·mL-1盐酸多西环素A. Doxycycline hydrochloride standard solution(50 ng·mL-1); B. Blank muscle tissue; C. Blank muscle tissue with 50 ng·mL-1 doxycycline hydrochloride图1 盐酸多西环素色谱分析Fig.1 Chromatography of doxycycline hydrochloride

表3 内服给药后多西环素在各组织中的残留量
2.5 休药期计算
本试验药物残留浓度根据休药期决策标准,将各组织中的残留物低于各组织MRL的时间加上一个安全跨度值即为所求的休药期。安全跨度值是10%~30%的时间周期值或者1倍~3倍的组织消除半衰期,且建议最小安全跨度值为1~2 d。综上表明,为了保障消费者食品安全,建议盐酸多西环素片在羔羊体内的休药期为2 d[13-14]。
3 讨 论
3.1 多西环素在羔羊组织中的分离提取
本试验所需检测的羊组织:肌肉、肾、肝和脂肪。脂肪提取方法与其他3种组织的提取方法不同。在建立脂肪前处理方法的时候,发现使用二氯甲烷对脂肪进行溶解,EDTA·2 Na-Mcllvaine缓冲溶液提取多西环素时,回收率极低,期间采用超声、水浴加热以及-80 ℃冷冻除脂等方法来提高回收率,并未有明显改善。乙腈和甲醇是组织中残留物的常用提取剂,都有很强沉淀蛋白质的能力。甲醇属于两性物质,在进行样品处理之后,杂质峰增多,使用乙腈处理后杂质峰减少,经过不断优化提取方法,回收结果表明使用ACN∶H2O=1∶9的提取液提取,并通过涡旋、40 ℃超声、4 ℃ 12 000 r·min-1离心以及冷冻除脂等过程显着提高回收率,并使得回收率达到60%以上。
3.2 盐酸多西环素片休药期的制定
盐酸多西环素在羔羊组织中的残留消除规律还未被报道,且多西环素在羔羊组织中的最高残留限量未被制定。参照我国农业农村部GB 31650—2019标准和欧盟发布的多西环素在猪、鸡和牛等靶动物组织中的最高残留限量(MRL)均为皮+脂肪300 μg·kg-1、肌肉100 μg·kg-1、肾600 μg·kg-1、肝300 μg·kg-1 [2]。根据EMEA动物源性食品中兽药残留风险分析指南说明可以将已知的反刍动物有关MRL相互外推[8],因此,羔羊的MRL以牛相关组织的最高残留限量作为参考,即多西环素在羔羊组织中的最高残留限量(MRL)为皮+脂肪300 μg·kg-1、肌肉100 μg·kg-1、肾600 μg·kg-1、肝300 μg·kg-1。
盐酸多西环素不同制剂在猪、鸡、蛋、鱼和奶中的残留消除研究已有不少报道[3-7],其中,Croubles等[7]报道猪按体重以10.5 mg·kg-1的剂量连续饮水给药5 d,经简单决策法计算休药期为3 d。刘欣等[9]使用50%盐酸多西环素颗粒以10 mg·kg-1剂量在猪体内使用,连续给药5 d,使用WT 1.4软件测得盐酸多西环素颗粒在猪体内的休药期为12 d。黄耀凌等[10]使用盐酸多西环素注射液以10 mg·kg-1剂量在猪体内使用,连续给药3 d,使用WT 1.4软件测得盐酸多西环素长效注射液在猪体内的休药期为42 d。王金花等[11]测得盐酸多西环素注射液的休药期不低于16 d。李媚等[12]使用WT 1.4软件测得多西环素注射液在猪体内的休药期不低于28 d。不同剂型的药物通过不同的给药方式所表现的药物吸收及代谢消除规律不同,其制定的休药期也不同。
为研究盐酸多西环素片在羔羊组织中的残留消除规律以及制定其休药期,本试验采取高效液相色谱串联紫外检测器法进行多西环素的检测。本研究结果不符合使用WT1.4计算休药期的规定,因此,根据欧洲药品评估机构发布的《EMEA/CVMP/036/95》法规中的决策标准进行本研究的休药期计算。综上表明,为保障食品消费者安全,建议将盐酸多西环素片在羔羊组织内的休药期定为2 d。
4 结 论
5 mg·kg-1体重内服给予羔羊盐酸多西环素片后,根据欧洲药品评估机构法规《EMEA/CVMP/036/95》,建议盐酸多西环素片在羔羊组织中的休药期为2 d。



