谢志明,吴春梅,陈少元,王 照,王 岩
(1.白城师范学院生命科学学院,白城 137000;2.白城市洮北区农民科技教育中心,白城 137000;3.中国人民解放军32397部队医院神经内科,白城 137000;4.吉林省地方病第一防治研究所,白城 137000;5.白城市传染病医院,白城 137000)
铅是一种广泛存在于自然界中的有毒重金属,通常在环境中以有机(四乙基铅)和无机(醋酸铅、氯化铅和硝酸铅)等形式存在,其广泛使用造成严重的环境污染和健康问题,对肝、肾、脑等器官均有损害作用[1]。许多研究表明,铅暴露能促进活性氧自由基(ROS)的产生,使机体处于氧化应激状态,破坏机体氧化/抗氧化动态平衡,改变抗氧化酶活性及脂质过氧化水平,从而导致细胞氧化损伤[2,3],此外,ROS的过量产生可能会诱导细胞凋亡和炎症性疾病[4]。柴胡为伞形科多年生草本植物,是我国传统的中草药,包括北柴胡和小叶黑柴胡,具有抗炎及调节免疫作用。胡柴主要含有柴胡皂苷、甾醇、挥发油、脂肪油和多糖等物质[5],其中多糖结构是柴胡生物活性的基础,其为柴胡的主要活性成分之一[6],具有疏散解热、抗炎、免疫调节、保肝、抗病毒等多种功效[7-8],因此柴胡多糖的功能研究对疾病的治疗具有重要意义。
近年来,利用天然植物提取物来改善由于重金属暴露而对机体造成的各种生理损伤,是药理学和毒理学一个新兴的研究领域。研究发现,具有抗氧化潜力的植物提取物可以减轻因重金属暴露引起的机体损伤[9]。而目前关于柴胡多糖对铅中毒的研究甚少,因此本研究以染铅小鼠为模型,旨在探讨天然植物提取物柴胡多糖通过抑制氧化应激和炎症反应减轻铅诱导小鼠肝肾损伤的作用,以期为柴胡多糖的开发利用和铅中毒的缓减提供理论依据。
1 材料与方法
1.1 试验材料
样品柴胡(小叶黑柴胡根部)购于宝芝林农业科技有限公司,产地甘肃定西,用组织粉碎机粉碎,参考杨立明等[10]方法制备柴胡多糖(沸水浴浸提法,提取3次),冰乙酸去蛋白、乙醇沉淀制得粗多糖,经Sephadex G-75纯化得到纯多糖,淡棕色透明液体,经测定,其中糖含量为94.5%,酸水解后经气相色谱测定该多糖由半乳糖、葡萄糖、阿拉伯糖、木糖和鼠李糖组成。
1.2 试验方法
试验选取150只体重(18±2)g SPF级6~8周龄雄性健康昆明小鼠,购自中国药品生物制品检定所实验动物中心,进行2周适应性饲养,根据先前的研究,当醋酸铅添加剂量为5%时,小鼠表现出明显的中毒症状[11]。试验开始时,小鼠每天饮铅水(醋酸铅0.5%,溶于去离子水),设置对照组饮去离子水,连续4周,其中在第4周结束时,先测定小鼠肝、肾组织中铅蓄积含量,肝组织中ALT和AST活性及肝肾组织中MPO活性,验证建模是否成功。
建模结束后,将小鼠分成5组:对照组,铅处理组,柴胡多糖和铅联合处理Ⅰ组、Ⅱ组、Ⅲ组,每组3次重复。联合处理I组、II组及Ⅲ组每隔1 d灌胃柴胡多糖1次,灌胃剂量分别为100、200、400 mg·kg-1,连续2周,正常组和模型组小鼠灌胃给予等容量的蒸馏水。试验期间,动物室温度为(22±2)℃,相对湿度为(55±10)%,光/暗循环为12 h,环境保持清洁,在不锈钢笼子里饲养,严格控制铅污染,饮水进食用具为玻璃器皿使用前用酸浸泡,再用双蒸水清洗,各组间饲养管理无差异性。
1.3 样品采集
每天观察动物外观、体征、行为活动等,每周记录体重2次。各处理组在试验结束时,末次禁食不禁水24 h,小鼠摘眼球取血0.5 mL,肝素钠抗凝,断颈处死小鼠,打开腹腔,分离完整的肝和肾组织(分为两部分),用于铅含量测定和抗氧化指标测定,将肾用生理盐水洗净2~3次,用滤纸吸干水称重,全血、左肾和部分肝4 ℃保存,右肾及剩余组织于-80 ℃ 冰箱冷冻保存。
1.4 指标测定及方法
1.4.1 小鼠血液及组织中铅的测定 按照Moniuszko-Jakoniuk等[12]的方法测定铅含量。取1.0 mL全血、肾、肝,分别加混合酸进行湿法消化,用0.5 mol·L-1HNO3溶解残渣,定容,采用全自动石墨炉原子吸收分光光度法测定铅的含量。
1.4.2 小鼠组织抗氧化能力的测定 取小鼠肝、肾组织,按试剂盒要求制备组织匀浆,超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化物酶(CAT)、丙二醛(MDA)指标的测定均采用南京建成生物工程研究所生产的试剂盒,按照试剂盒说明进行操作。
1.4.3 小鼠血清及肝组织中丙氨酸转移酶(ALT)和谷草转移酶(AST)的活力测定 采用南京建成 ALT、AST 测定试剂盒(赖氏法)取小鼠血清和肝进行测定。血清样品直接取样进行测定,肝组织样品制备成10%的肝组织匀浆后,离心取上清液待测。
2018年4月至5月,我们在辽宁省盘锦市二界沟进行了中国对虾的苗种繁育,共培育出体长1~1.5cm的对虾苗种1.5亿尾。繁育技术总结如下:
1.4.4 小鼠血清血尿素氮(BUN)、肌酐(Scr)含量的测定 给药结束后,腹主动脉取血,离心分离血清,低温保存备用,采用全自动生化分析仪检测血BUN、Scr水平。
1.4.5 小鼠肝肾组织中炎症因子肿瘤坏死因子(TNF-α)、白细胞介素-6(IL-6)含量及髓过氧化物酶(MPO)活性的测定 按照酶联免疫吸附试验(ELISA)试剂盒说明书操作,测定小鼠肝肾组织中炎症因子TNF-α、IL-6含量,MPO活性测定具体参考杨珊等[13]方法。
1.4.6 实时荧光定量PCR检测基因表达 采用Trizol法从小鼠肝和肾中提取总RNA,根据试剂盒提供的指导说明,对总RNA进行反转录,以进行qRT-PCR分析,并使用cDNA样品进行qRT-PCR。引物的设计合成:以β-actin为内参基因,运用 Primer Premier 5.0设计引物,由生工生物工程(上海)股份有限公司合成引物,引物设计如表1,通过qRT-PCR测定基因表达水平,用对照组平均值归一法与2-ΔΔCt法进行计算相对mRNA表达水平。
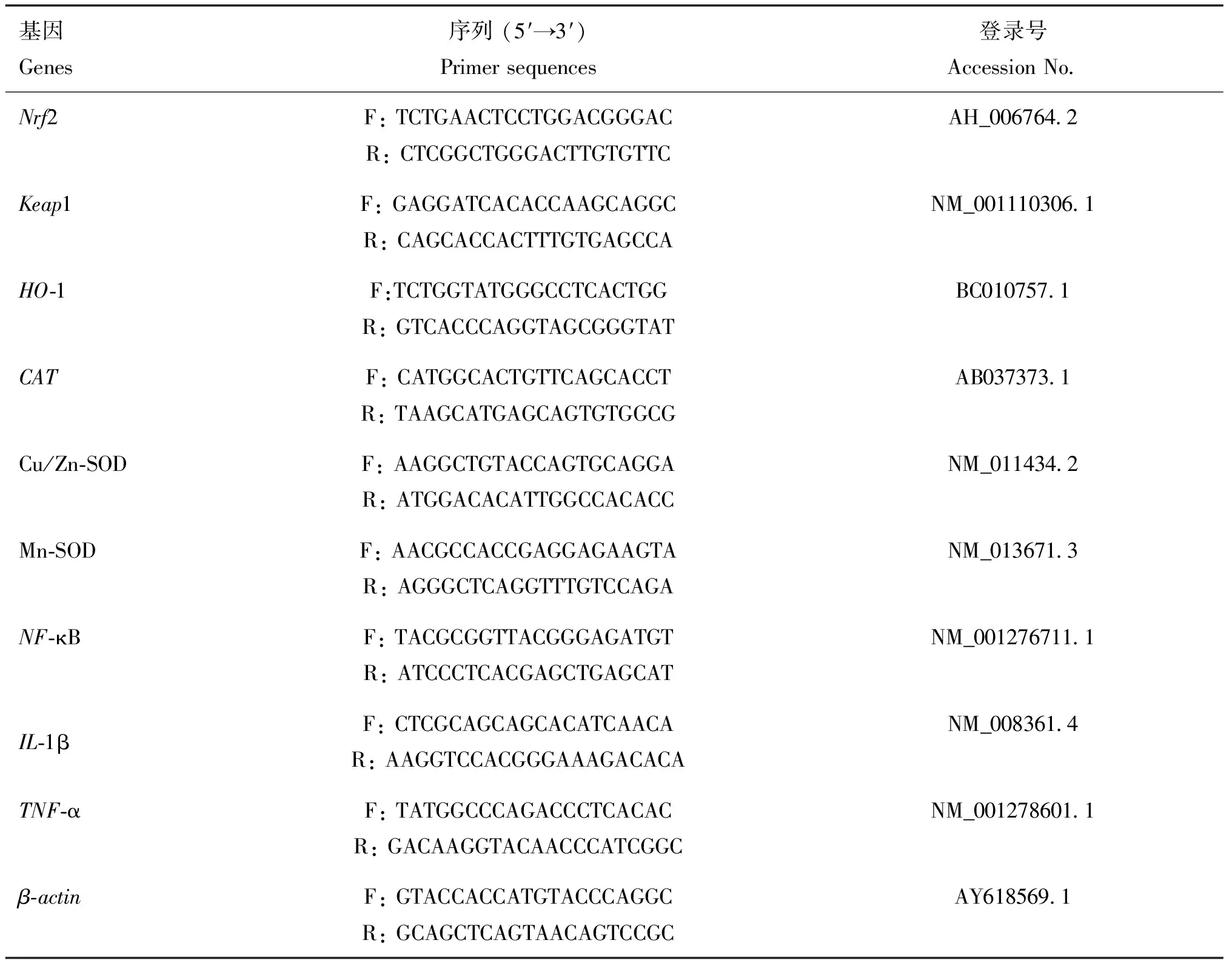
表1 引物序列信息
1.5 数据分析
2 结 果
2.1 铅诱导小鼠模型的建立
由图1所示,通过前期试验可知,铅处理组小鼠肝、肾组织中铅含量明显高于对照组(P>0.05),铅处理组均可使小鼠肝组织中ALT和AST活性显着升高(P<0.05),使小鼠肝、肾组织中MPO活性明显升高(P<0.05),且在试验期间,小鼠活动无异常,综上所述,说明小鼠模型建立成功。
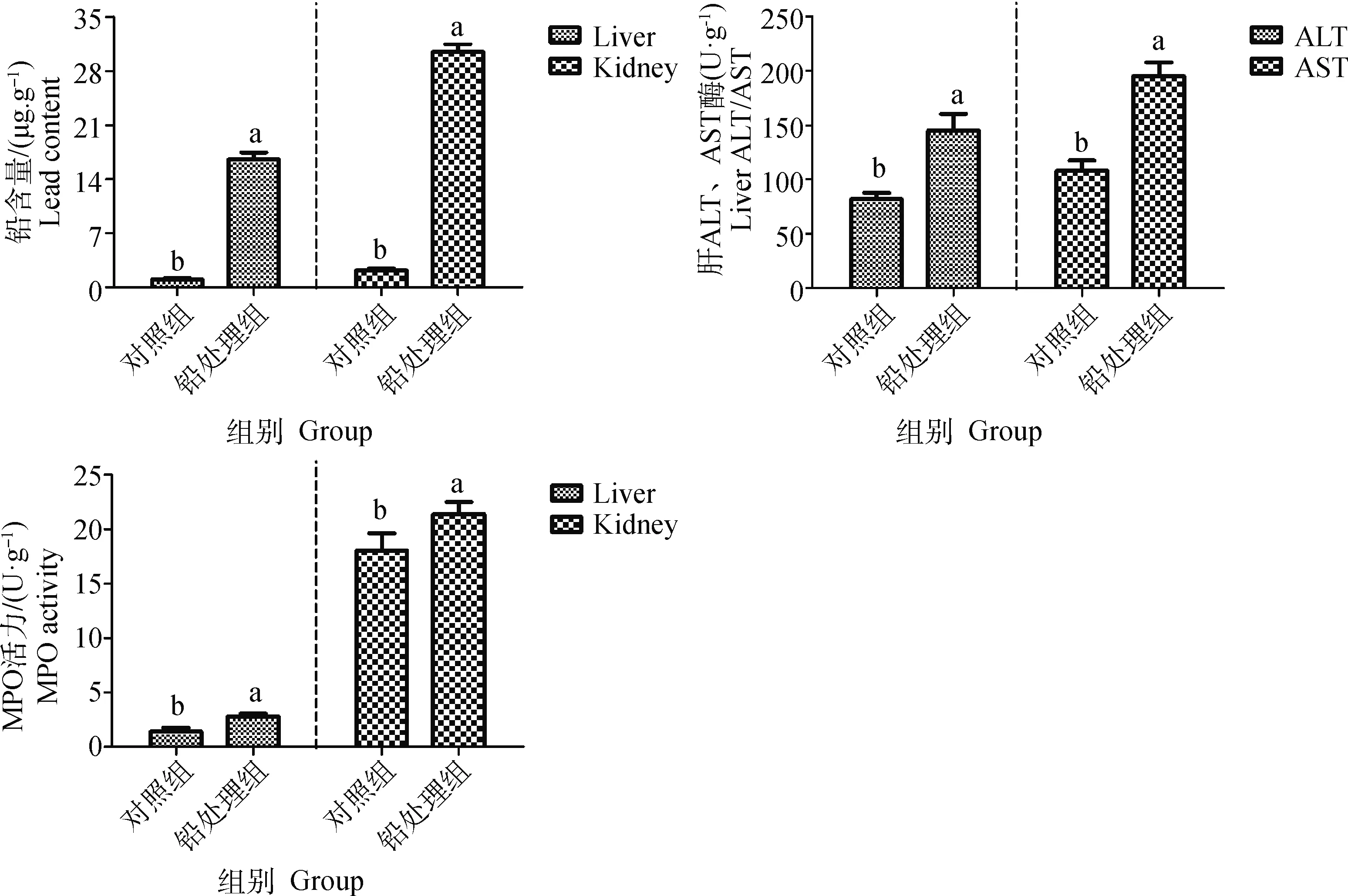
图1 铅诱导对小鼠肝、肾组织指标的影响
2.2 柴胡多糖对铅诱导小鼠体重的影响
由表2所示,各组小鼠体重增长对照组最快,铅处理组最慢,其中低、中、高剂量柴胡多糖与铅联合处理组均高于铅处理组,但差异不显着(P>0.05);铅处理组小鼠肝体比、肾体比增大,而柴胡多糖与铅联合处理后均使其下降,基本接近于对照组,但均差异不显着(P>0.05)。

表2 柴胡多糖对铅诱导小鼠体重及肝、肾系数的影响
2.3 柴胡多糖对铅诱导小鼠全血及组织中铅含量的影响
由表3所示,铅处理组小鼠全血、肝和肾组织中铅含量差异均高于对照组,具有统计学意义(P<0.05),说明铅诱导小鼠模型达到良好效果。与铅染毒组小鼠相比,低、中、高剂量柴胡多糖与铅联合处理组小鼠全血铅、肝铅和肾铅含量均有所降低,但铅的含量变化差异均不显着(P>0.05)。
表3 柴胡多糖对铅诱导小鼠血液及肝、肾组织中铅含量的影响
2.4 柴胡多糖对铅诱导小鼠组织抗氧化能力的影响
由图2所示,铅处理组SOD、GSH-Px及CAT活性显着降低与对照组相比(P<0.05),添加低、中、高剂量柴胡多糖组的SOD、GSH-Px及CAT活性逐渐升高,而铅处理组MDA含量高于对照组,添加柴胡多糖后MDA含量逐渐减低。其中高剂量组SOD、GSH-Px、CAT活性及MDA含量与对照组基本保持一致,无显着性差异(P>0.05)。
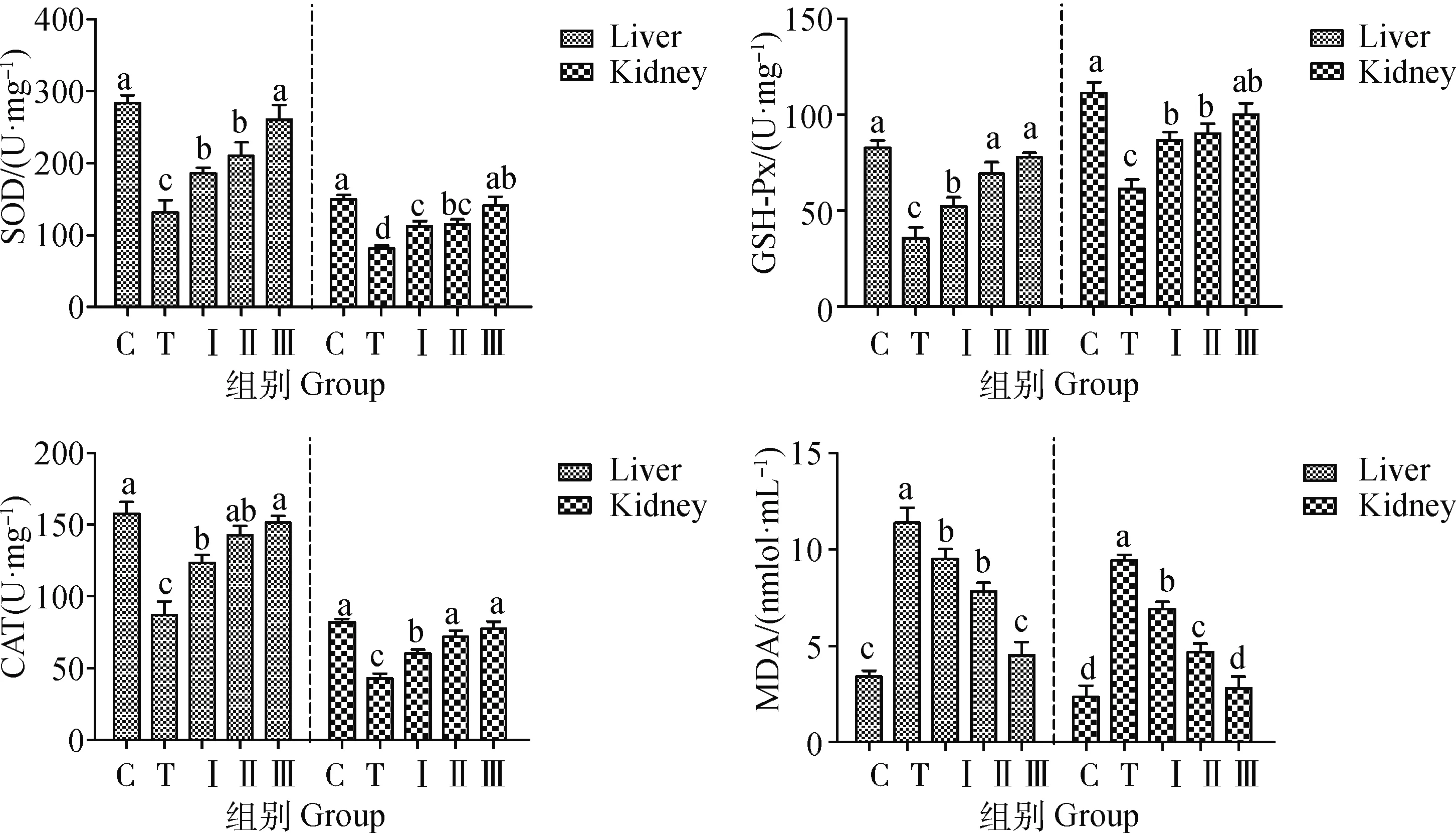
C.对照组;T.铅处理组;Ⅰ.联合处理Ⅰ组;Ⅱ.联合处理Ⅱ组; Ⅲ.联合处理Ⅲ组。数据表示为不同上标的值表示有显着性差异(P<0.05),下同
2.5 柴胡多糖对铅诱导小鼠血清和肝组织ALT和AST水平的影响
血清和肝组织中的ALT和AST水平反映了小鼠肝功能的变化。如图3所示,与对照组相比,铅处理组均引起血清和肝组织中ALT和AST活性显着升高(P<0.05)。采用低、中、高剂量的柴胡多糖灌胃后,血清和肝组织匀浆ALT和AST活力的增加显着减弱,其中高剂量柴胡多糖组与对照组均无显着差异(P>0.05)。
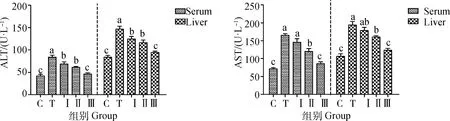
图3 柴胡多糖对铅诱导小鼠血清和肝ALT和AST活力的影响
2.6 柴胡多糖对铅诱导小鼠血清BUN、Scr含量的影响
如图4所示,与对照组相比,铅处理组小鼠血清BUN、ScrNF-κB、IL-1β和TNF-α明显升高(P<0.05)。与铅处理组相比,低、中、高剂量柴胡多糖组小鼠血清Scr、BUN含量显着降低,且柴胡多糖各组呈剂量依赖性(P<0.05)。
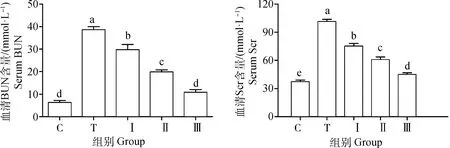
图4 柴胡多糖对铅诱导小鼠血清BUN、Scr含量的影响
2.7 柴胡多糖对铅诱导小鼠肝、肾组织中TNF-α、IL-6含量、MPO活性及炎症反应相关因子mRNA相对表达量的影响
如图5所示,与对照组相比,铅处理组显着提高了小鼠肝、肾中TNF-α、IL-6含量及MPO的活性,而低、中、高剂量柴胡多糖组灌胃小鼠后,TNF-α、IL-6、MPO活性均下降,与铅处理组相比,中、高剂量处理组效果显着(P<0.05),其中低剂量组基本与铅处理组相接近。
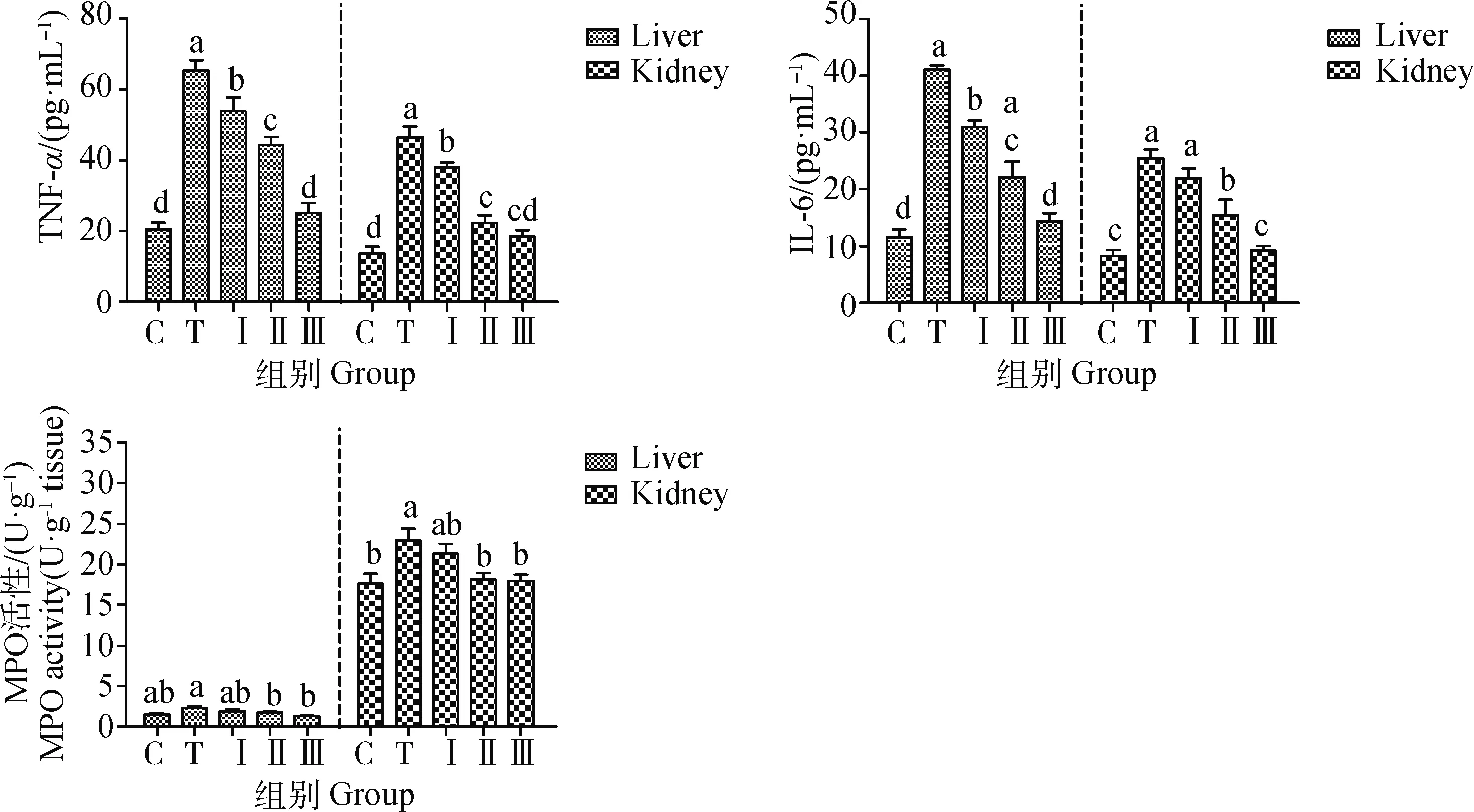
图5 柴胡多糖对铅诱导小鼠肝、肾组织中TNF-α、IL-6含量及MPO活性的影响
如图6所示,与对照组相比,铅处理组小鼠肝、肾组织中NF-κB、IL-1β和TNF-α mRNA表达量明显升高(P<0.05)。与铅处理组相比,柴胡多糖低、中、高剂量组均可显着降低NF-κB、IL-1β和TNF-α mRNA表达水平(P<0.05),其中柴胡多糖高剂量组中NF-κB和IL-1β mRNA表达量与对照组比较无显着性差异(P>0.05),而柴胡多糖高剂量组的效果优于柴胡多糖低、中剂量组。
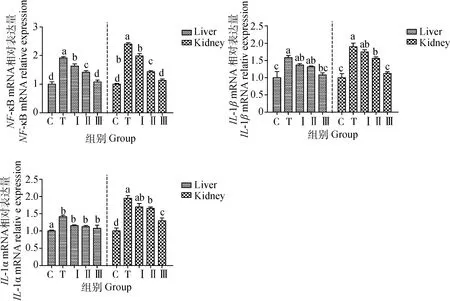
图6 柴胡多糖对小鼠肝、肾中NF-κB、IL-1β和TNF-α基因表达的影响
2.8 柴胡多糖对铅诱导小鼠肝、肾氧化损伤相关因子mRNA相对表达量的影响
如图7所示,与对照组相比,铅处理组小鼠肝、肾组织中Keap1 mRNA水平显着升高,Nrf2、HO-1、Cu/Zn-SOD、Mn-SOD、CATmRNA水平显着降低(P<0.05),而给小鼠灌胃低、中、高剂量柴胡多糖时,Nrf2、HO-1、Cu/Zn-SOD、Mn-SOD、CATmRNA水平得到了改善,逐渐上升,其中高剂量组效果最显着(P<0.05),与铅处理组相比,Keap1 mRNA水平显着降低,高剂量组与对照组无显着性差异(P>0.05)。
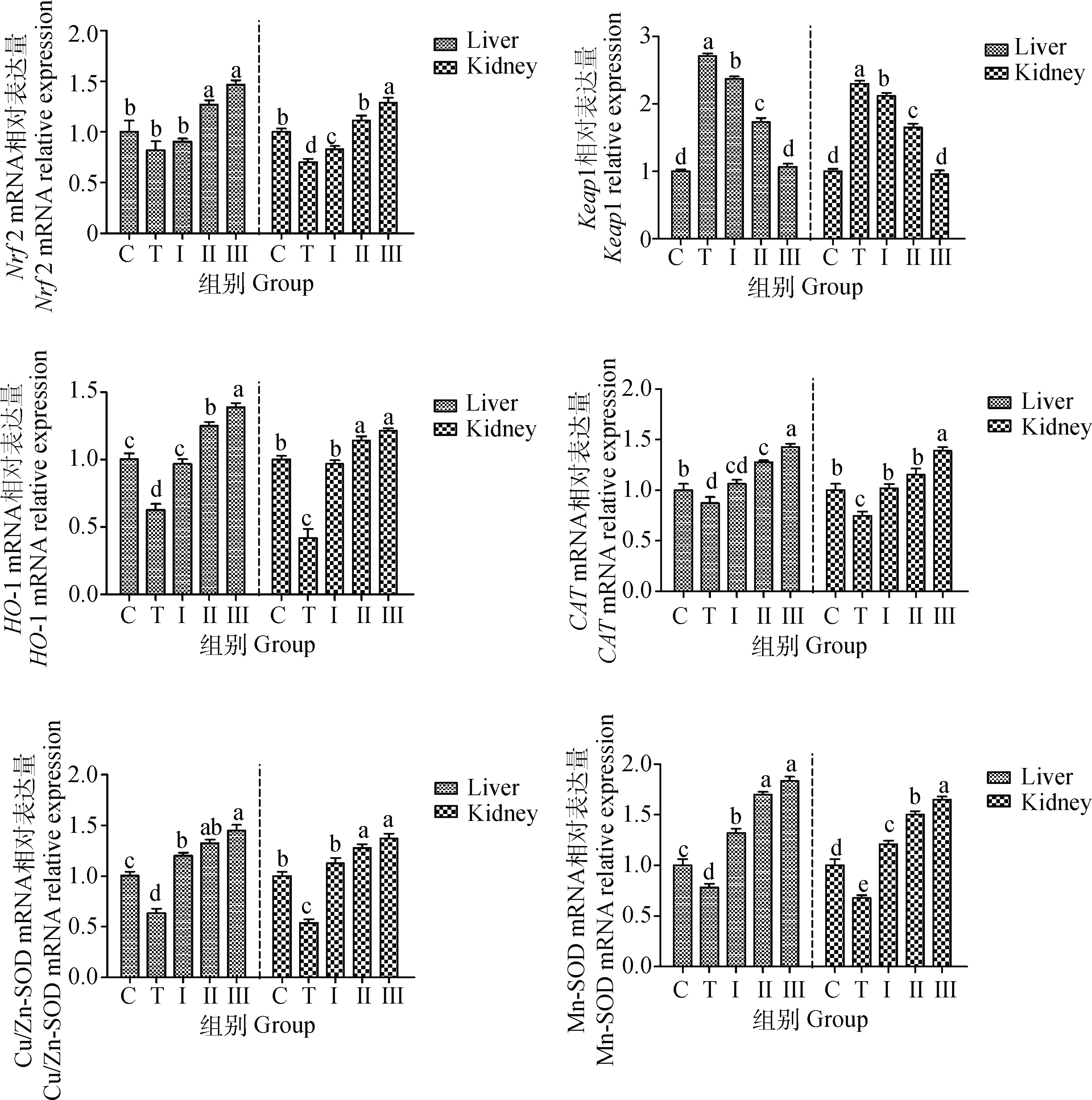
图7 柴胡多糖对铅诱导小鼠肝、肾组织中Nrf2、Keap1、HO-1、CAT、Cu/Zn-SOD和Mn-SOD基因表达的影响
3 讨 论
长期接触重金属与肝、肾及肺等脏器疾病的发病率增加有关,对生殖系统、神经系统和免疫系统等多种系统功能具有一定的破坏作用。其中铅作为一种毒性重金属[14],铅暴露可能会损害免疫反应,氧化应激、炎症反应、细胞凋亡等都与铅引起的肝、肾毒性有关,研究表明,铅暴露能够增加炎症和氧化应激水平,并诱导肝肾功能紊乱,最终将导致明显的肝肾功能损害[11]。本试验结果表明,柴胡多糖可抑制铅中毒小鼠体重的下降和脏器系数的升高与对照组相比,添加柴胡多糖使小鼠血液及组织中铅浓度略有降低。夏道宗等[3]采用低、中、高剂量的杭白菊总黄酮可拮抗铅中毒小鼠体重的下降和脏器系数的升高,使杭白菊总黄酮对小鼠血液及组织中排铅效果显着,且未造成锌的流失;周东月等[15]研究发现,与模型组比较,黄连多糖组大鼠体重显着增加,而肾系数明显减小;刘芳丽等[16]研究表明,铅诱导使小鼠肝、肾的脏器系数增大,给予小鼠灌胃白藜芦醇后均可使其下降,部分接近于正常水平,同时小鼠全血铅、肝铅和肾铅含量均有所降低,这与本研究结果基本保持一致。
氧化应激在铅毒性机制中发挥了重要作用,铅能使细胞活性氧增加,破坏机体抗氧化防御体系,改变抗氧化酶活性及脂质过氧化水平,从而导致细胞氧化损伤[17]。其中SOD、CAT、GSH-Px和MDA是评价机体氧化应激水平的主要指标,SOD具有清除自由基、对抗和阻断活性氧对细胞造成的伤害并及时修复受损细胞的功能[18];CAT可以迅速除去细胞的毒性代谢产物,从而对机体起到保护作用;GSH-Px具有维持细胞结构和功能完整性的作用,其主要通过促进过氧化氢的分解、降低过氧化氢水平而实现[19];DMA为脂质氧化物的最终产物,能够间接反应组织细胞的损伤程度[20]。本研究结果表明,铅中毒导致小鼠肝肾组织SOD、GSH-Px及CAT活性明显降低(P<0.05),而MDA含量高于对照组,给予柴胡多糖后使得小鼠肝肾组织SOD、GSH-Px及CAT活性显着提高,MDA含量降低,与铅处理组相比,差异均显着(P<0.05),说明铅中毒可引起小鼠过氧化损伤,柴胡多糖可以减轻铅中毒引起的氧化应激,提高小鼠机体的抗氧化能力。当MDA含量急剧升高时,小鼠体内的氧化/抗氧化平衡受到破坏,脂质过氧化加剧;而SOD、GSH-Px及CAT活性下降,说明铅在小鼠体内持续积累,使小鼠出现铅中毒,抑制了体内抗氧化酶的活性。常东等[11]发现南瓜多糖使小鼠血清和肝组织SOD活性、GSH-Px活力上升,MDA含量降低,与中毒模型组相比,差异有显着性(P<0.05);植物提取物杭白菊总黄酮可显着抑制铅中毒小鼠脑、肝和肾脂质过氧化,使其抗氧化酶的活性提高[3],均与本试验研究结果相符。
肝ALT和AST通常被用作肝细胞损伤的间接生化指标,是肝功能损害最重要的标志[21]。在本研究中,血清和肝组织中ALT和AST活性的显着增加,表明铅暴露导致了明显的肝损伤,同时采用低、中、高剂量的柴胡多糖显着降低了ALT和AST水平(P<0.05),进一步表明柴胡多糖发挥对铅诱导小鼠肝肾组织损伤的调节效应。肝功能测试表明,重金属诱导导致血清中肝酶(ALT、ASP和ALP)的活性显着升高,表明由于肝细胞的细胞膜可能受损而导致过度渗漏,这些生物标志物的血清水平被显着用作严重肝损害的指标。研究发现,富含槲皮素的小叶植物乙醇叶提取物可以改善铅、汞重金属诱导的大鼠氧化还原失衡[22];刘思思[23]研究发现,与铅处理组相比,低、高浓度葡萄籽原花青素可以显着降低铅处理组血液的ALT、AST活性;姜婧等[24]研究发现,与对照组相比,铅诱导大鼠醋酸铅组血清中ALT和AST活性显着升高,而醋酸铅+原花青素组可使血清中ALT和AST的活性显着降低(P<0.05),这均与本研究结果基本一致。测定血清中BUN含量可以判断肾小球的滤过功能。本研究表明柴胡多糖可使铅诱导小鼠血清Scr、BUN显着降低,且柴胡多糖低、中、高剂量组呈剂量依赖性(P<0.05)。谢晶等[25]研究表明,黄连多糖可显着降低糖尿病大鼠BUN、Scr水平及24 h尿蛋白(P<0.05),说明黄连多糖具有减轻糖尿病大鼠肾损伤的作用,该作用与抑制氧化应激及炎症反应有关;有证据表明,与模型组相比蒲公英根叶提取物各剂量组大鼠肾组织病理损伤减轻,血清Scr、BUN、TNF-α及IL-6水平等均降低,且蒲公英根叶提取物各组之间呈剂量依赖性(P<0.05),说明蒲公英根叶提取物可抑制炎症反应和氧化应激[15]。综上所述,与本研究结果基本相似。
MPO是一种具有强抗菌特性的限制酶,存在于骨髓来源的细胞如中性粒细胞的细胞质中,是组织炎症的可靠标记物[26]。在本研究中发现铅暴露使小鼠肝、肾组织MPO活性增强,而添加柴胡多糖能够显着降低由铅诱导引起的小鼠肝、肾组织MPO活性的明显增强,从而发挥柴胡多糖的抗炎作用。已有研究证实IL-6和TNF-α均为炎症反应的重要介质,在肝、肾损伤过程中,炎症细胞被激活,炎症因子被释放(TNF-α、IL-1β和IL-6),最终导致中性粒细胞在肝中的积累导致细胞因子表达增加[27]。TNF-α主要是单核细胞与T细胞产生,通过分泌效应作用于其他巨噬细胞,能激活炎症因子并参与细胞增殖、分化与凋亡过程[28]。IL-6可以通过体液免疫和细胞免疫功能介导宿主防御、炎症反应和组织损伤修复等多种生物学过程[29]。因此,降低炎症反应水平,有助于减轻重金属引起的肝肾损伤。本研究证实,柴胡多糖可以通过降低铅诱导小鼠肝、肾组织TNF-α、IL-6含量,从而抑制炎症递质,对缓减小鼠肝、肾损伤具有一定功效,其作用机制可能与其抗氧化作用有关。研究发现,柴胡多糖浓度为40、80 μg·mL-1时,显着降低了LPS诱导的巨噬细胞分泌促炎细胞因子TNF-α、IL-6、IL-1β及IL-12p40水平,说明柴胡多糖可提高某些促炎细胞因子的产生,结合柴胡多糖具有促进吞噬细菌的作用,说明在非炎症条件下柴胡多糖能够增强机体的免疫功能[8],这一结果与本文结论相类似。TNF-α可用作测试物质毒性的生物标志物,当机体暴露于重金属的环境污染物时,活化的NF-κB可促进促炎因子的基因转录和蛋白合成,从而引起炎性细胞因子如IL-1β、IL-6和IL-8的高表达,加速对细胞的毒性作用,最终导致器官功能障碍[20,30-31]。本研究发现,与对照组相比,染铅组小鼠肝、肾组织NF-κB、IL-1β和TNF-α mRNA表达显着增加,从而解释了铅介导炎症反应并最终导致肝肾组织损伤,而通过低、中、高剂量的柴胡多糖可不同程度的降低NF-κB、IL-1β和TNF-α mRNA水平,从而说明柴胡多糖可有效缓减炎症反应,使其小鼠肝、肾组织得到保护。
SOD主要包括Cu/Zn-SOD和Mn-SOD两种酶,其基因表达量变化有助于判断机体内氧化应激与抗氧能力状态[32]。本研究结果显示,铅处理组小鼠SOD含量降低,Cu/Zn-SOD、Mn-SOD及CAT的表达降低,因此,证明了铅可能通过干扰酶活性和增加氧化产物而诱导氧化应激,铅中毒降低肝的抗氧化功能可能是通过影响Keap1/Nrf2/HO-1途径的表达来实现的[33],而低、中、高剂量柴胡多糖处理组对小鼠肝、肾组织的Cu/Zn-SOD、Mn-SOD及CAT水平与铅处理组相反,表明柴胡多糖可增加铅中毒小鼠的清除氧自由基能力。柴胡多糖可以通过抑制氧化应激,调控机体自由基的代谢,从而实现对铅中毒小鼠的肾脏保护作用。已有研究证明抗氧化反应是通过Nrf2途径调节的,通常Nrf2通过Keap1依赖性泛素化和蛋白酶体降解保持较低水平,当发生氧化应激时,Nrf2可能会从Keap1定向降解中释放出来,从而导致Nrf2转运到细胞核中,并通过激活ARE依赖的基因表达,增加大量抗氧化和细胞保护蛋白(如HO-1)的含量[34-35]。在本研究中发现,当小鼠摄入有毒铅时,显着提高了小鼠肝肾组织中Keap1 mRNA水平,降低了Nrf2和HO-1 mRNA水平,但给铅中毒小鼠灌胃柴胡多糖使其表达水平基本恢复正常,这表明铅暴露会干扰Nrf2通路,抗氧化能力将受到抑制,然而柴胡多糖可有效抑制了铅的肝、肾组织毒性,导致Nrf2通路的激活,此外,铅通过改变炎性因子的基因表达引起肝、肾损伤,而柴胡多糖通过激活Keap1/Nrf2/HO-1途径并降低炎症程度来预防肝、肾损伤。铅暴露诱导小鼠肝肾组织中Nrf2信号通路的mRNA降低,而柴胡多糖可显着提高Nrf2信号通路的mRNA水平表达,抑制铅诱导的肝、肾损伤,进而减轻铅诱导肝、肾组织的免疫功能紊乱[8]。
4 结 论
低、中、高剂量柴胡多糖均对铅诱导小鼠的肝、肾损伤均具有一定的调节效应,其中柴胡多糖高剂量组对小鼠的组织损伤保护作用最显着,进而说明柴胡多糖可减轻铅诱导小鼠肝、肾损伤作用,提高小鼠机体抗氧化能力,缓减了铅诱导小鼠氧化应激及炎症反应。



