刘连超,王灵灵,张雨晴,李金辉,赵兴华,何 欣
(河北农业大学动物医学院,保定 071001)
氟苯尼考(florfenicol,FF,图1a)是甲砜霉素的氟化衍生物,是一种酰胺醇类动物专用广谱抗生素,其结晶粉末无臭味苦,呈白色或类白色[1]。FF抗菌范围广泛,对革兰阴性菌和阳性菌均有抑制作用,临床用于治疗牛、猪、鸡和水产动物的各种细菌感染性疾病[2-3]。但FF水溶性差,常温下在水中的溶解度仅为1.05~1.35 mg·mL-1,溶出度低,极大地限制了其临床应用[4-6]。固体分散体是以一种或几种高分子聚合物作为载体,将难溶性药物分散在其中形成的分散体系[7-8]。通过固体分散技术,制备无定形给药系统,可以有效提高难溶性药物的溶解度以及溶出速率[9]。制备固体分散体最常用的方法是喷雾干燥法(spray drying)和热熔挤出法(hot-melt extrusion)等。本研究基于溶剂-反溶剂原理,利用共沉淀技术制备氟苯尼考固体分散体,旨在制备出稳定的无定形氟苯尼考固体分散体,有效提高氟苯尼考的溶解度和生物利用度,扩大其临床应用。
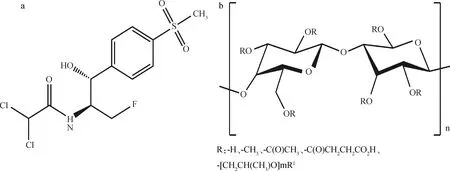
图1 FF(a)和HPMCAS(b)的结构式Fig.1 Structural formula of FF (a) and HPMCAS (b)
1 材料与方法
1.1 试验材料与动物
氟苯尼考对照品购自上海源叶生物科技有限公司;氟苯尼考原料药由保定冀中药业有限公司赠予;醋酸羟丙基甲基纤维素琥珀酸酯(hydroxypropyl methyl cellulose acetate succinate,HPMCAS-MF,图1b)由大连业建贸易有限公司赠予。
SPF级健康雄性SD大鼠,220~250 g,购自北京斯贝福生物技术有限公司[生产许可证号:SCXK(京)2019-0010],试验前禁食12 h,自由饮水。
1.2 氟苯尼考固体分散体(FF-MF ASD)的制备
将聚合物HPMCAS-MF配成0.1 g·mL-1的溶液,然后将FF和HPMCAS-MF按照5∶5的比例加入10 mL上述聚合物溶液中,充分溶解,混合后注入反溶剂中,充分沉淀后抽滤,沉淀物冷冻干燥48 h,研磨过80目筛备用。
1.3 固体分散体的表征
1.3.1 X射线衍射(XRD) 将FF、HPMCAS-MF和FF-MF ASD(FF∶HPMCAS-MF=5∶5)粉末样品过筛后进行测试。工作条件:扫描范围5~35°,电压40 KV,电流40 mA,步长0.02°,测试速度0.1 s·step-1,铜靶,入射线波长0.154 18 nm。
1.3.2 差示量热扫描(DSC)和热重分析(TGA) 称取适量粉末样品放入坩埚,通氮气,进行升温测试。工作条件:N2气流20 mL·min-1,TGA测试范围25~500 ℃,DSC测试范围0~200 ℃,升温速率10 ℃·min-1。
1.3.3 扫描电镜(SEM) 将FF、HPMCAS-MF和FF-MF ASD粉末样品粘到导电胶上,喷金后测试,观察样品形貌。
1.4 稳定性研究
精密称取200 mg FF-MF ASD于安瓿瓶中,放在(40±5) ℃和相对湿度(75±3)%的恒温恒湿箱中,并分别于0、7、14、30、60和90 d对该样品进行差示量热扫描和粉末X射线衍射。
1.5 体外溶出速率
精密称取FF原料药200 mg、FF-MF ASD(等同于200 mg的FF)过筛后进行体外溶出速率的测定,溶出介质为pH 6.8磷酸盐缓冲液,溶出介质体积为20 mL,温度为(37±0.5)℃,转速为250 r·min-1,分别于 0.5、1、2、5、10、20、30、60、90和120 min 时取样200 μL (随即补足等温度等量的溶出介质),用0.45 μm微孔滤膜过滤,测定吸光度,重复3次。
1.6 药动学
1.6.1 给药与采样 选取10只健康SD大鼠,适应性饲养1周,试验前12 h,禁食不禁水,随机分为2组,每组5只。选择0.1% CMC-Na水溶液作为悬浮剂,将FF和FF-MF ASD分别加入1 mL悬浮剂,并进行涡旋处理均匀分散备用。以20 mg·kg-1灌胃给予FF和FF-MF ASD(等同于20 mg·kg-1的FF)。给药后,用微量采血管分别于0.083、0.25、0.5、0.75、1、1.5、2、3、4、6、8、12和24 h时进行大鼠眼眶采血约0.5 mL,6 000 r·min-1离心10 min,取上层血浆于EP管中,-20 ℃备用。
1.6.2 血浆样品处理 血浆样品取100 μL,加入300 μL乙腈后,涡旋振荡2 min,以12 000 r·min-1离心10 min,上清液用0.22 μm有机滤头过滤,取200 μL处理好的样品用HPLC进行FF的含量检测。
1.6.3 高效液相色谱条件 色谱柱:SunFire®C18(4.6 mm×250 mm,5 μm);流动相:乙腈∶水= 60∶40; 流速:1 mL·min-1;柱温:37 ℃;进样量:20 μL;测定波长:224 nm。
2 结 果
2.1 氟苯尼考的X-射线衍射分析
FF、FF-MF ASD和HPMCAS-MF的XRD结果如图2所示。
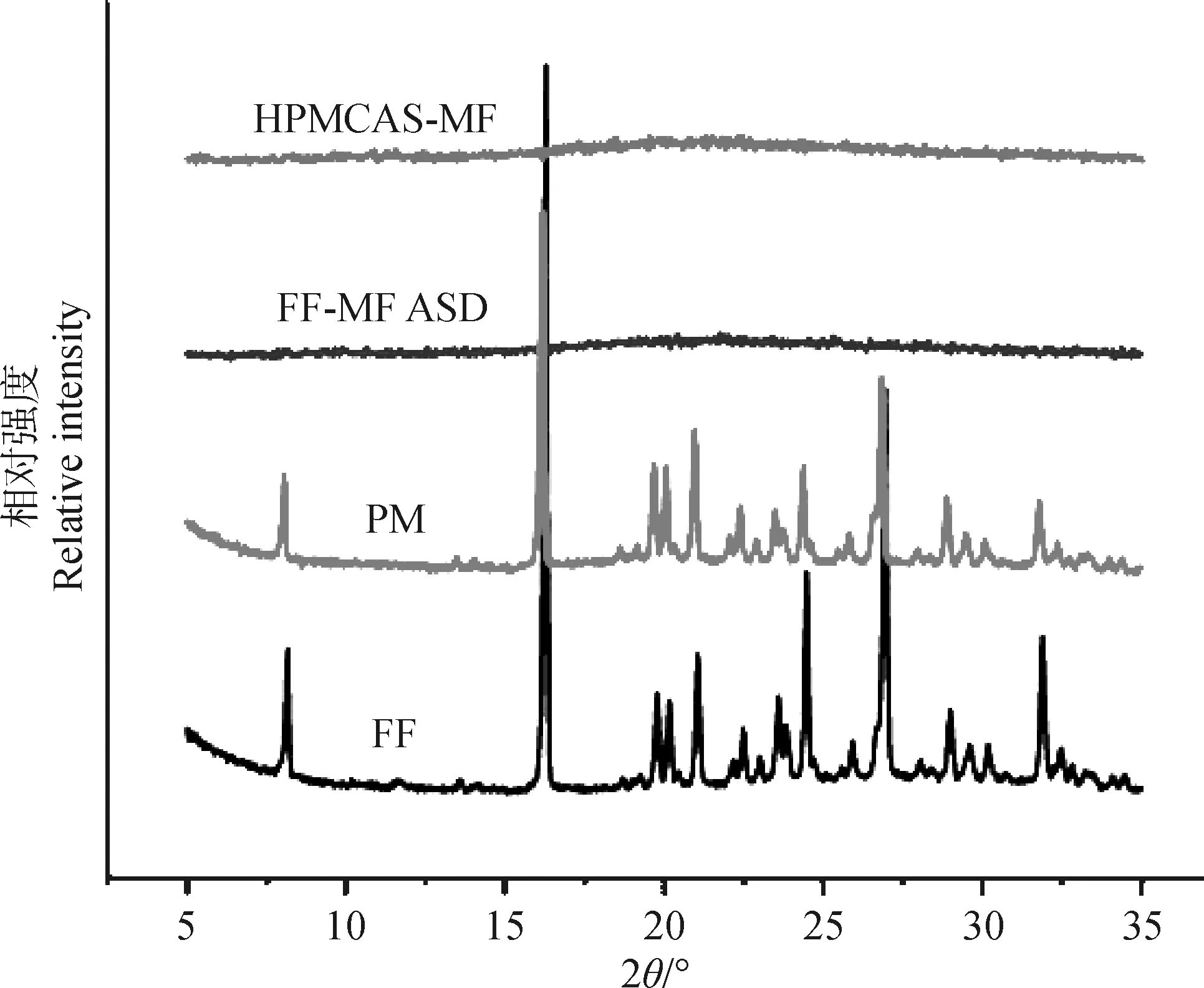
图2 FF、FF-MF ASD和HPMCAS-MF的XRD图Fig.2 XRD analysis of FF, FF-MF ASD and HPMCAS-MF
FF的X射线粉末衍射图中在衍射角度2θ在(8.0±0.2)、(16.2±0.2)、(23.5±0.2)、(24.4±0.2)、(26.9±0.2)、(38.6±0.2)°处均具有衍射峰,表明FF是一种高结晶度药物;HPMCAS-MF无明显衍射峰; FF-MF ASD未看到晶体衍射峰,表明FF以无定形态分散在HPMCAS-MF中,即在该比例下,聚合物HPMCAS-MF和药物FF形成了固体分散体。
2.2 氟苯尼考固体分散体的热分析
FF、FF-MF ASD和HPMCAS-MF的TGA结果如图3 a所示。由图可知FF、FF-MF ASD和HPMCAS-MF的分解温度均在220 ℃左右,而本研究所用共沉淀方法全程无需加热处理,这消除了热不稳定性问题。
FF、FF-MF ASD和HPMCAS-MF的DSC结果如图3 b所示。FF在154.96 ℃可见一尖锐吸收峰,此为FF的熔点温度,这与孟凡亮[10]报道一致;HPMCAS-MF在升温过程中没有吸热峰出现,说明其为非晶态,其玻璃化转变温度(glass transition temperature,Tg)在120 ℃左右;而FF-MF ASD中FF的晶体熔点峰完全消失,说明氟苯尼考与聚合物HPMCAS-MF以分子状态均匀混合且相容性良好,药物以无定形态存在,这与上述XRD结果相吻合。
2.3 氟苯尼考固体分散体的扫描电子显微镜观察结果
FF、FF-MF ASD和HPMCAS-MF的SEM结果如图4所示。FF为大小不一的块状晶体,表面光滑;HPMCAS-MF呈现不规则的颗粒状,形态饱满,立体感较强,呈现疏松多孔结构;FF-MF ASD中片状药物结构消失,无明显的晶体存在,呈疏松多孔形式,药物以无定形态高度分散于HPMCAS-MF的孔穴中。
2.4 氟苯尼考固体分散体的稳定性
FF-MF ASD在恒温恒湿环境中放置后不同时间取样后的XRD和DSC图谱如图5所示。通过XRD(图5 a)和DSC(图5 b)图谱可以看出FF-MF ASD在0、7、14、30、60和90 d内均无结晶峰和吸热峰出现,表明该ASD在3个月内性质稳定。
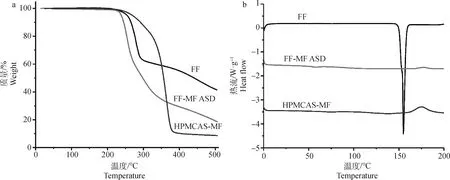
a. TG; b.DSC图3 FF、FF-MF ASD和HPMCAS-MF的热分析图(TG和DSC)Fig.3 Thermal analysis (TG and DSC) of FF, FF-MF ASD and HPMCAS-MF

a. FF, 5 000×; b. HPMCAS-MF, 5 000×; c. FF-MF ASD, 5 000×; d. FF-MF ASD, 20 000×图4 FF、FF-MF ASD和HPMCAS-MF的SEM图Fig.4 SEM analysis of FF, FF-MF ASD and HPMCAS-MF
2.5 体外溶出
FF和FF-MF ASD在37 ℃、pH 6.8磷酸盐缓冲溶液中的溶出结果如图6所示。FF和FF-MF ASD在2 h内均达到溶解平衡,FF-MF ASD的饱和溶解度为5.55 mg·mL-1,较FF原药(1.15 mg·mL-1)提高了4.8倍。20 min内FF-MF ASD的溶出速率明显增加,之后趋于稳定。可以看出制备出的氟苯尼考无定形固体分散体显着增加了氟苯尼考的的溶解度和溶解速度,且该ASD较稳定,能保持120 min 内溶解度无明显变化,说明聚合物的存在显着抑制了氟苯尼考的结晶过程。
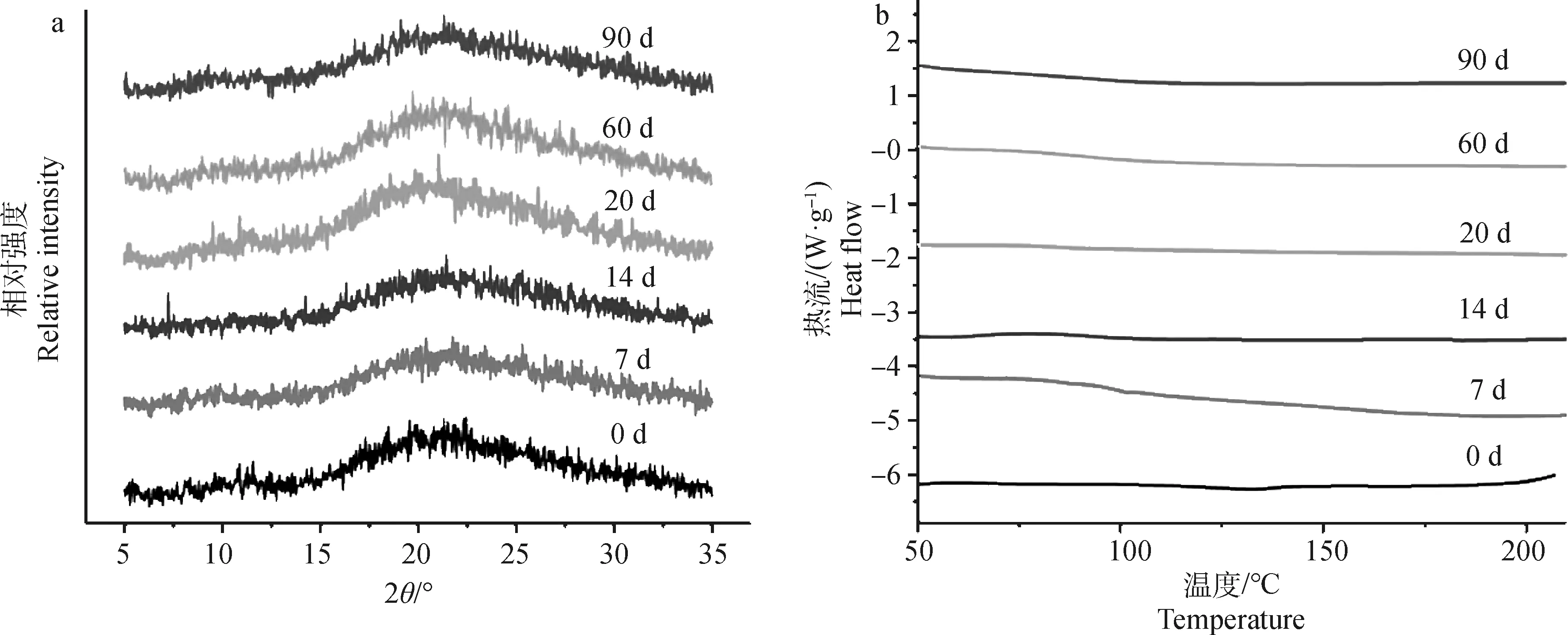
a. XRD; b.DSC图5 FF-MF ASD的XRD和DSC图谱Fig.5 XRD and DSC analysis of FF-MF ASD
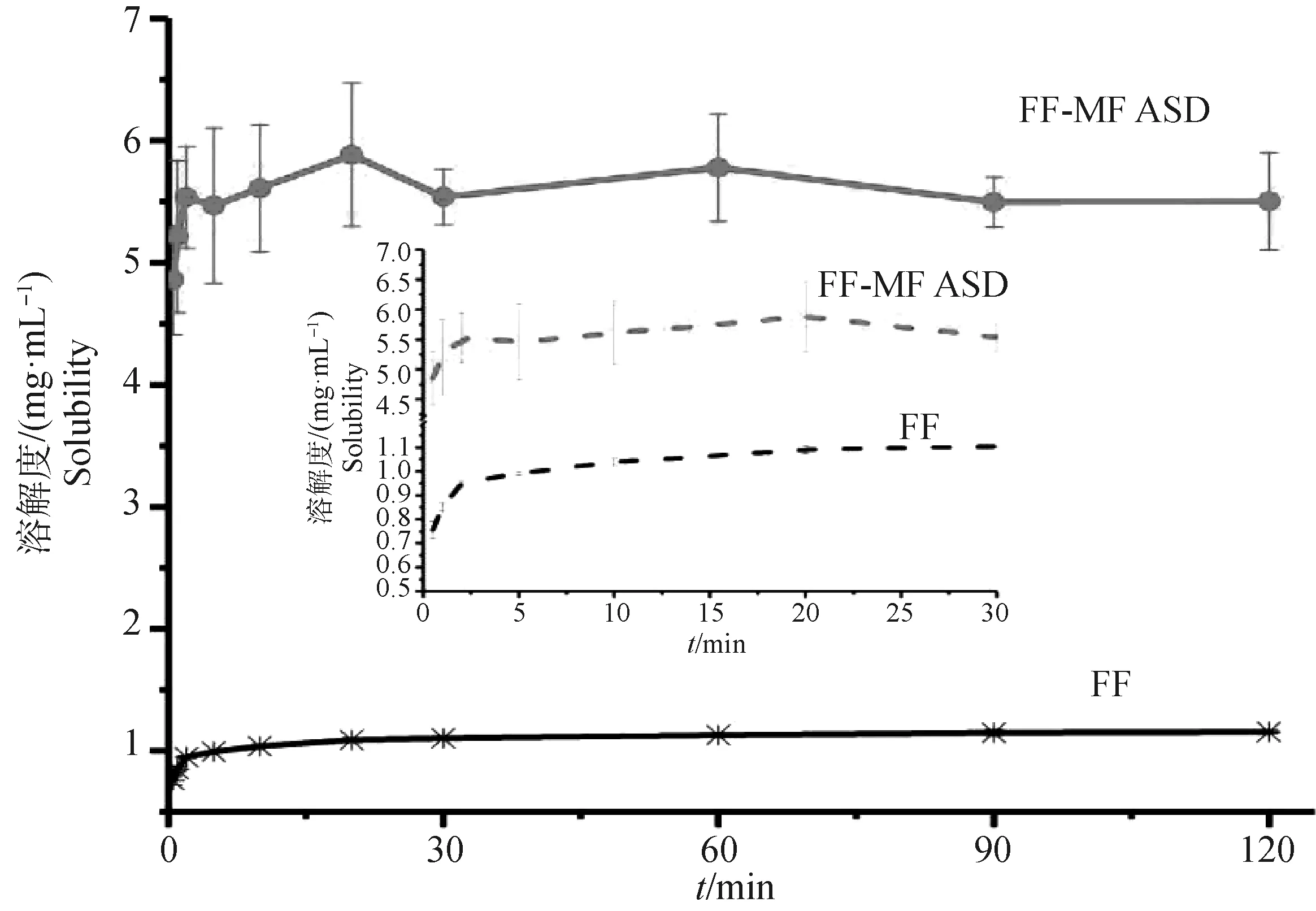
图6 FF和FF-MF ASD的体外溶出曲线Fig.6 The in vitro dissolution of FF and FF-MF ASD
2.6 药物代谢动力学
各给药组的平均血药浓度-时间曲线及参数如图7和表1所示。FF在大鼠体内吸收迅速,在1.1 h达到最大血药浓度,而FF-MF ASD的达峰时间极显着推迟,达2.8 h(P<0.01);FF-MF ASD的达峰浓度极显着高于FF原料药(P<0.01),是FF的1.69倍;FF原料药最大滞留时间为15.03 h,FF-MF ASD的MRT极显着缩短,仅为7.52 h(P<0.01);FF原料药和FF-MF ASD的半衰期差异不显着(P>0.05);FF原料药的AUC0~∞为29.84 (μg·h)·mL-1,FF-MF ASD的AUC0~∞显着提高为40.94 (μg·h)·mL-1(P<0.05),结果表明,制备的FF-MF ASD生物利用度比FF提高了37.2%。

图7 口服FF和FF-MF ASD在大鼠体内的血药浓度-时间曲线Fig.7 Concentration vs time curve of plasma drug in rats after oral administration of FF and FF-MF ASD

表1 大鼠口服FF和FF-MF ASD主要药动学参数比较
3 讨 论
HPMCAS-MF是近年来兴起的一种可用于固体分散体的理想载体,其Tg为120 ℃,在pH 6.0溶解,有较广泛的有机溶剂溶解性和较低的溶液黏度[11-13]。HPMCAS-MF既具有琥珀酰基,又含有多种疏水性取代基,pKa值约为5,因此导致其在pH≤4时电离率<10%,在pH≥5时电离率≥50%,并且HPMCAS在肠道pH下被电离,主要以胶体聚合物的形式存在于水溶液中,由于聚合物上取代基的疏水性,使不溶性药物分子与聚合物相互作用,在溶液中形成非晶药物/聚合物纳米结构[14],这些药物/聚合物纳米结构构成了一种高溶解度的非晶药物,可以迅速溶解,从而提供过饱和的药物浓度,达到增加药物溶解度、提高生物利用度的目的。HPMCAS-MF不仅可以作为润湿剂提高药物的可润湿性,而且在以其为载体的固体分散体中,由于黏度增大和络合作用还能抑制药物结晶,从而提高药物稳定性[15-16]。Sarabu等[17]研究了HPMCAS对硝苯地平药物无定形固体分散体的影响,结果表明HPMCAS可以明显增加药物的溶解度和溶出速率,溶解度较原料药提高了2.5倍,且能在40 ℃、75%湿度条件下在3个月内保持性质稳定,药物保持无定形态。Liang等[18]制备了姜黄素和HPMCAS的无定形固体分散体,溶解度提高了约8.4倍,显着地增强了姜黄素的溶出,提高了姜黄素的化学稳定性,且HPMCAS比聚乙烯吡咯烷酮PVPK30更能抑制姜黄素的降解。FF原料药本身是一种溶解度较低的药物,本研究选择HPMCAS-MF为载体制备FF-MF ASD,结果显示制备为固体分散体后使氟苯尼考的溶解度提高了4.8倍,其原因可能是聚合物的存在抑制了FF晶体的凝聚,抑制了FF的结晶,另外制备的FF-MF ASD呈疏松多孔状形态,导致药物的比表面积较大且与溶出介质的接触面积大大增加。
FF属于BCSⅡ类药物[19],口服后FF在体内的低溶解度大大限制了机体对药物的吸收,难以发挥其临床疗效。目前国内外已有大量提高药物溶解度的固体制剂的研究报道[20-22]。马可等[23]将氟苯尼考与β-环糊精按1∶1投料比制备出氟苯尼考-β-环糊精包合物,进行了体外溶出试验,其15 min溶出率为氟苯尼考的5倍,提高了氟苯尼考的水溶性,但该研究缺乏体内药动学试验,不能确定此包合物在动物体内的吸收代谢规律。娄雅婧[24]利用混悬法,制备出氟苯尼考-柠檬酸共晶,使氟苯尼考的溶解度提高了3.3倍,此方法通过氢键作用,不需要破坏共价键就能使氟苯尼考的溶解度提高。将氟苯尼考固体加热至熔点以上160~200 ℃使其熔化,再降温冷却至15~30 ℃,得到固态无定形氟苯尼考,使溶解度由1.05提高到1.30 mg·mL-1,并提高了其生物利用度[25]。曹航[26]使用改良溶剂反溶剂法制备出氟苯尼考微晶体,此方法以水为反溶剂,丙酮为溶剂,在4 ℃下,用HPMC修饰制备的微晶体较FF溶解度提高了1.5倍。氟苯尼考新固体制剂的开发虽然使其溶解度得到了一些改善,但仍不理想,研制高效氟苯尼考水溶性固体制剂仍是目前亟需解决的问题。
采用分子包合技术形成固体分散体可提高氟苯尼考的溶解度,改善氟苯尼考在动物体内的吸收,提高其生物利用度。固体分散体的常规制备方法包括热熔挤出法[27]、溶剂法[28-29]、熔融法[30]等。Xu等[31]利用热熔挤出技术制备出氟苯尼考固体分散体,其在酸性条件下制剂的释放率<10%,磷酸盐缓冲液条件下的释放率>80%,并且该制剂的相对生物利用度可达117.2%,其优点为具有肠溶性和缓释作用。闫浩松[32]通过熔融法与热熔挤出法制备出氟苯尼考固体分散体,使其溶解度提高了1.5倍,生物利用度提高11.88%,并且具有高效、速释、成本低的优点。但利用热熔挤出法制备固体分散体需通过物料输送、熔融、剪切、混合、熔体输送和挤出成型等多个单元的操作,在高温熔融和强剪切力的作用下,使多组分物料的粒径不断减小,从而提高药物的溶解度。另外由于热熔挤出法对药物的热稳定性和热塑性等要求较高,因此除具有适宜的物理化学性质和稳定性外,载体与药物必须具有良好的相容性,且载体的玻璃转变温度应低于药物的热降解温度[33]。熔融法制备固体分散体对温度和保留时间的要求较高,温度越高及保温时间越长所制得的颗粒其释放度相对越快,因此该方法只适用于热稳定性的药物和材料[34]。传统溶剂法需要先把药物和载体共同溶于有机溶剂中,再通过蒸去溶剂得到固体,此法需要消耗较多的有机溶剂,成本较高且污染环境[35];本研究采用共沉淀法制备了FF的固体分散体,使药物以无定形态均匀分散在聚合物HPMCAS-MF中,试验过程中无需高温操作和特殊设备,所需溶剂量很小,是一种成本低、环境友好的制备方法。Chow等[36]使用共沉淀法制备了姜黄素无定形固体分散体,并比较了不同溶剂对其粒径的影响,此方法制备的固体分散体不仅粒径小,而且包封率高、稳定性良好。
基于HPMCAS的载体特性,其在水、pH 1.2、pH 4.5的介质中,溶解度及溶出效果均较差,仅在pH 6.8磷酸盐缓冲液中的溶解度才具有明显的提高[37],而且pH 6.8接近于动物肠液的pH[38],更能反映生理条件下药物的溶解环境,本研究选用pH 6.8的磷酸盐缓冲溶液考察 FF-MF ASD的体外溶出性能,结果表明该固体分散体增加了药物的溶解度,而且有利于药物的溶出。之后探讨了大鼠口服氟苯尼考后的药物代谢动力学特征,而且较好的溶出促使氟苯尼考固体分散体在大鼠的口服生物利用度提高了37.2%。对于口服抗生素药物来说,溶出速度的快慢是决定药物吸收速率的决定性因素,因此推测可能是由于疏松多孔结构增加了药物颗粒的比表面积,使ASD在胃肠道的生物黏附作用得到了增强,并且能够增加细胞旁路吸收和摄取,使得药物粒子在胃肠道中的吸收时间延长,生物利用度得以提高。
4 结 论
利用共沉淀技术将FF和HPMCAS-MF制备成了稳定性良好的FF-MF ASD,该固体分散体可有效改善FF的溶解度和体外溶出速率,提高了难溶性药物FF的生物利用度,为扩大氟苯尼考的临床应用提供了支持。



