葛 优,郑 晶,蒲善秋,周 宇,黄翠锐,杨光友,谢 跃,何 冉,徐 璟,古小彬*
(1.四川农业大学动物医学院,成都 611130; 2. 中华人民共和国成都海关技术中心, 成都 610041)
兔痒螨病是绵羊痒螨兔亚种(Psoroptesovisvar.cuniculi)在兔外耳道皮肤表面寄生所引起的一种慢性、接触传染性皮肤病[1]。该病以外耳道出现卷纸样痂皮、剧痒、皮肤增厚和消瘦等为临床特征,导致饲料转化率下降,若不及时治疗可引起死亡,给兔养殖业造成重大经济危害[1-3]。及时准确地诊断出患病兔是兔痒螨病有效防控的基础,现生产中通过耳部结痂等临床症状及痂皮镜检出虫体或虫卵来对兔痒螨病进行诊断,但这种方法对亚临床感染病兔易漏检,造成该方法敏感性低[4]。兔经人工感染P.ovisvar.cuniculi后,兔血清抗体阳性的出现时间早于结痂临床症状出现时间,因此,可通过检测血清抗体筛出亚临床病例[5]。酶联免疫吸附试验(ELISA)是对血清抗体检测的方法之一,可同时对大量样本进行检测筛选,具有高敏感性、高特异性优点[6]。建立一种针对血清抗体检测的高度灵敏和特异的血清学检测方法需要筛选特异性强、敏感性高的抗原蛋白。
基质金属蛋白酶(matrix metalloproteinases, MMPs)是一种锌离子依赖的内源性蛋白酶家族,广泛参与胚胎发育、血管生成、组织稳态、伤口修复、炎症反应等多项重要生物学功能,在寄生虫感染中还可参与寄生虫入侵和免疫逃避等过程[7-9]。寄生虫来源的MMPs蛋白则可以作为诊断抗原,用于寄生虫疾病的诊断[10]。本课题组前期的转录组学分析发现,P.ovis中存在MMP2基因,但目前尚未见该基因的相关研究。因此,本研究拟分析绵羊痒螨兔亚种MMP2的虫体转录水平,并经原核表达获得重组MMP2蛋白,基于该重组蛋白建立测定P.ovisvar.cuniculi抗体的间接ELISA方法,并将该方法用于临床血清样品的检测。
1 材料与方法
1.1 螨虫的收集
从四川农业大学动物寄生虫病研究中心保种的痒螨病新西兰兔的耳部痂皮中分离虫体,待虫体爬出后镜检鉴定为P.ovisvar.cuniculi,收集混合各发育阶段的螨虫1份,以及雄虫、雌虫、幼虫和若虫虫体各1份[11]。混合各阶段的饱食和饥饿的螨虫各1份,具体收集方法参考文献[12]。
1.2 血清
建立方法所用血清:50份痒螨阳性血清采自经病原学检测呈阳性的兔群;54份痒螨阴性血清采自无痒螨病史的兔场,且无任何临床病症的兔群。
交叉反应血清:15份柔嫩艾美耳球虫阳性血清采自经漂浮法检测呈阳性的兔群;11份疥螨阳性血清采自经病原学检测为阳性的兔群。
田间血清:田间检测血清共86份,于2020年3月,从成都金堂某兔场采集,该养殖场具有痒螨病流行病史,采集血清的兔经痒螨病的病原学检测有9只为阳性,77只为阴性。
1.3 主要试剂
微量RNA提取试剂盒购自北京艾德莱生物科技有限公司;琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒均购自天根生化科技(北京)有限公司; Real Time PCR EasyTM-SYBR Green I试剂盒和反转录试剂盒购自成都福际生物技术有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自Sigma公司;蛋白质预染Marker(20~250 ku)购自Bio-Rad公司;HRP(辣根过氧化物酶)标记的羊抗兔IgG购自Abclonal公司。
1.4 MMP2序列分析
从P.ovisvar.cuniculi三代转录组数据(未发表)中筛选出MMP2完整基因序列,利用在线分析预测网站预测其编码蛋白的信号肽(https://services.healthtech.dtu.dk/Services.PhP?SignalP)及跨膜结构[TMHMM Server, v. 2.0 (dtu.dk)];根据NCBI 在线Blast工具查询到螨类MMP2同源基因,利用软件DNAMAN和Jalview比较他们的氨基酸序列相似性;用InterPro(http://www.ebi.ac.uk/interpro/)预测蛋白结构域和功能位点。
1.5 虫体MMP2相对转录水平的测定
取出“1.1”中收集的雌虫、雄虫、若虫、幼虫以及饱食和饥饿的虫体,经试剂盒提取总RNA和合成cDNA第一链。qPCR扩增MMP2的引物:5′-ATCTCCCACAAACGGGCGAAATC-3′(F1),5′-TTCGACATCAGGCACACCACAA-3′(R1),引物由上海生工生物工程有限公司合成。根据qPCR染料说明书设置反应体系和应用程序,结果以2-△△ct计算虫体的MMP2相对转录水平。
1.6 MMP2基因扩增引物设计及合成
参照P.ovisvar.cuniculi三代转录组数据中MMP2序列,设计和合成引物,引物序列:5′-CAGGATCCCCAATGATGATTTTGGTTGATTATA- ATTCAG-3′(F2,下划线为BamHⅠ酶切位点),5′-TCGAAGCTTTTATCCAGCTTTCGCCGAT-3′(R2,下划线为Hind Ⅲ 酶切位点),由上海生工生物工程有限公司合成引物。
1.7 重组表达质粒pET-32a(+)-MMP2 的构建
用微量RNA提取试剂盒提取“1.1”中收集的混合发育阶段的螨虫总RNA, 合成cDNA。以cDNA 为模板,使用引物F2 和 R2进行PCR 扩增,反应条件:94 ℃ 5 min; 94 ℃ 45 s,58 ℃ 45 s,72 ℃ 30 s, 35个循环;72 ℃延伸10 min。将产物切胶回收并纯化,插入pMD-19T(Simple),提取质粒经BamHⅠ和Hind Ⅲ酶切后,插入pET-32a(+)后转入DH5α感受态细胞,经菌落PCR和双酶切鉴定为阳性的质粒送上海生工生物工程有限公司测序,将测序正确的重组表达载体命名为pET-32a(+)-MMP2。
1.8 重组MMP2蛋白的表达、纯化与免疫印迹(Western blot)
将pET-32a (+)和pET-32a (+)-MMP2质粒分别转入BL21(DE3)感受态细胞后,经LB液体培养基培养,将菌液涂布于含AMP抗性的LB平板于37 ℃过夜培养,挑取单菌落于含AMP抗性的LB液体培养基中培养至菌液OD600 nm值达到0.6~0.8时,加入100 μmol·L-1IPTG 18 ℃ 180 r·min-124 h,收集菌液,4 ℃ 7 000 r·min-110 min,沉淀用30 mL Tris-HCl(pH6.8)重悬,于冰浴中超声破碎,4 ℃ 10 000 r·min-110 min,收集上清,超声破碎后的沉淀物分别用2、4、8 mol·L-1尿素溶液溶解,4 ℃ 10 000 r·min-110 min收集上清。将每一步收集的上清进行SDS-PAGE检测,判断蛋白是否呈可溶性表达。将上述处理的蛋白经镍柱(Bio-ScaleTMMini NuviaTMIMAC Cartridges)纯化,将纯化后的蛋白进行SDS-PAGE后转印到醋酸纤维膜(PDVF膜),经5%脱脂奶粉室温封闭2 h,加入痒螨病兔阳性血清或健康兔阴性血清(1∶200稀释)4 ℃过夜,以Goat Anti Rabbit IgG-HRP(1∶3 000)室温孵育2 h,二氨基联苯胺(DAB)显色。
1.9 间接ELISA方法的建立
1.9.1 方阵滴定法确定包被抗原和血清的最佳工作浓度 将重组MMP2蛋白用包被液(pH 9.6,碳酸盐缓冲液)按2×倍稀释比从每孔74.88 μg·mL-1稀释到1.17 μg·mL-1,将稀释后蛋白以每孔100 μL加入96孔板,4 ℃包被过夜;PBST(pH7.4)洗涤3次, 每次5 min;加入150 μL 5%脱脂奶粉,37 ℃ 2 h; PBST洗涤3次,每次5 min;痒螨阳性血清和痒螨阴性血清用PBS缓冲液按1∶20、1∶40、1∶80、1∶160、1∶320和1∶640稀释,每孔100 μL,37 ℃ 1 h; PBST洗涤3次,每次5 min;每孔加入PBS稀释的Goat Anti Rabbit IgG-HRP(1∶ 3 000)100 μL,37 ℃ 1 h;PBST洗涤4次,每次5 min;加入100 μL邻苯二胺底物缓冲液,37 ℃ 15 min,加入2 mol·L-1浓硫酸100 μL终止反应,酶标仪测定OD450 nm值。计算P/N值, P/N最大时对应的值即为抗原最佳包被浓度和最佳血清稀释度。
1.9.2 临界值(cut-off值)、敏感性和特异性的计算 用上述已优化的iELISA方法检测50份痒螨兔阳性血清、54份痒螨兔阴性血清、15份柔嫩艾美耳球虫兔阳性血清和11份疥螨兔阳性血清。将得到的数据计算临界值、敏感性和特异性。约登指数越大,真阳性率(敏感性)和假阳性率(1-特异性)差异最大化,此时所对应的临界值具有最好的指示效果[13]。根据确定的临界值判定血清样本的阴阳性,最终计算特异性和敏感性[14]。特异性=真阴性数/(真阴性数+假阳性数)×100%,敏感性=真阳性数/(真阳性数+假阴性数)×100%。
1.9.3 受试者工作曲线(ROC曲线)分析 利用MedCalc软件绘制ROC曲线[15]并进行统计学分析,从而评价所建iELISA方法的稳定性和准确性。
1.9.4 重复性试验 取6份痒螨病兔阳性血清,分别用同一批次和3个不同批次包被的酶标板在相同条件下进行检测,每个血清样本做3个重复,根据读数结果分别判定批内和批间重复性。
1.10 与传统病原学检测的对比
使用上述建立的iELISA方法对“1.2”中的86份临床兔血清样本进行检测,将检测结果与病原学检测结果进行对比。
2 结 果
2.1 PocMMP2的序列分析
PocMMP2基因序列开放阅读框(ORF)长1 656 bp,编码长551个氨基酸的多肽,无信号肽,有一个跨膜结构域(氨基酸位数为7—29)。功能结构预测发现PocMMP2含半胱氨酸开关基序PRCGVPDV的前肽区、含锌的催化结构域(ZnMc-MMP, 150—303)和血红素样结构域(hemopexin-like dom, 349—540)(图1)。PsoMMP2与其他3种螨虫的同源基因氨基酸序列相似性为51.78%~63.65%(图1)。

Dermatophagoides pteronyssinus (GenBank No.: XP_027203761.1), Euroglyphus maynei (GenBank No.: OTF75656.1), Sarcoptes scabiei (GenBank No.: KPM05303.1)。图中方框圈出的序列代表MMP2保守的半胱氨酸开关基序;序列标识在序列之间以黑色/灰色背景突出显示,越保守,颜色越深Dermatophagoides pteronyssinus (GenBank No.: XP_027203761.1), Euroglyphus maynei (GenBank No.: OTF75656.1), Sarcoptes scabiei (GenBank No.: KPM05303.1). The sequence circled in the figure represents the conservative cysteine-switch motif of MMP2; sequence identity is highlighted with a black/grey background, between sequences, and the more conservative, the darker the color图1 螨类MMP2同源基因多序列比Fig.1 Multiple sequence alignment of mite MMP2 homologous genes
2.2 虫体MMP2相对转录水平测定
MMP2在螨虫的4个发育阶段均有表达,相对转录水平:雄虫>幼虫>雌虫>若虫,其中,若虫的转录水平显着低于其他3个发育阶段(P<0.05或P<0.01,图2A)。饥饿虫体的相对转录水平显着高于饱食虫体(P<0.05,图2B)。
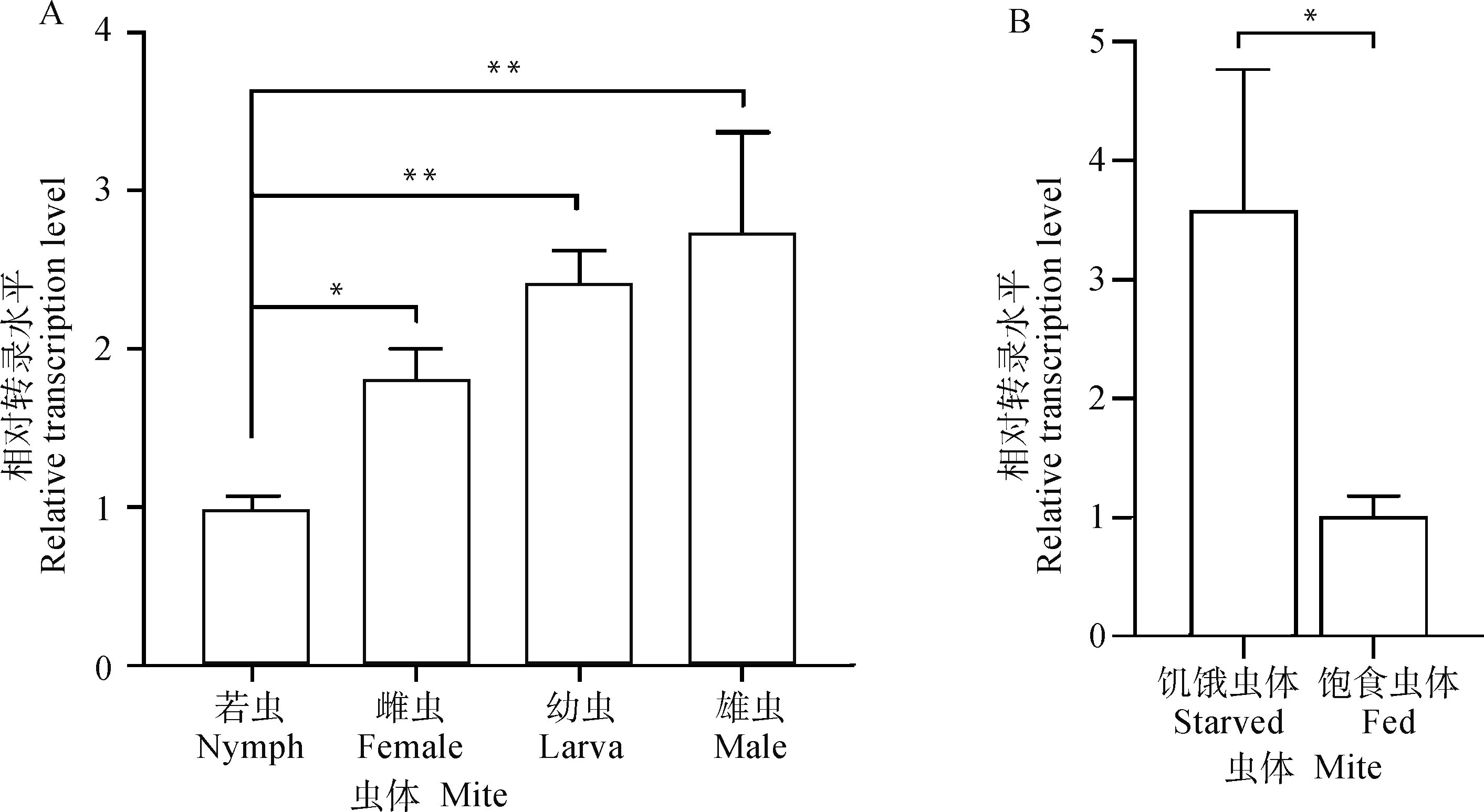
A. 不同发育阶段;B. 饥饿/饱食状态。*. P<0.05;**. P<0.01A. Different developmental stages; B. The state of “fed” or “starved”. *. P<0.05;**. P<0.01图2 虫体MMP2相对转录水平Fig.2 The relative transcription level of MMP2 of Psoroptes ovis var. cuniculi
2.3 rPocMMP2的表达及纯化
插入pET-32a (+)载体后的MMP2经双酶切,获得约1 656 bp片段,重组质粒经测序鉴定正确,说明成功构建pET-32a(+)-MMP2重组质粒(图3)。经IPTG诱导后的重组菌获得与预期大小一致的72 ku目的蛋白条带,且目的蛋白主要以包涵体的形式存在,经镍柱纯化获得单一的目的蛋白条带(图4)。重组MMP2蛋白可与痒螨病兔阳性血清相识别,在约72 ku处出现特异性条带,表明其具有较好的免疫反应性;与阴性兔血清无反应条带(图4)。
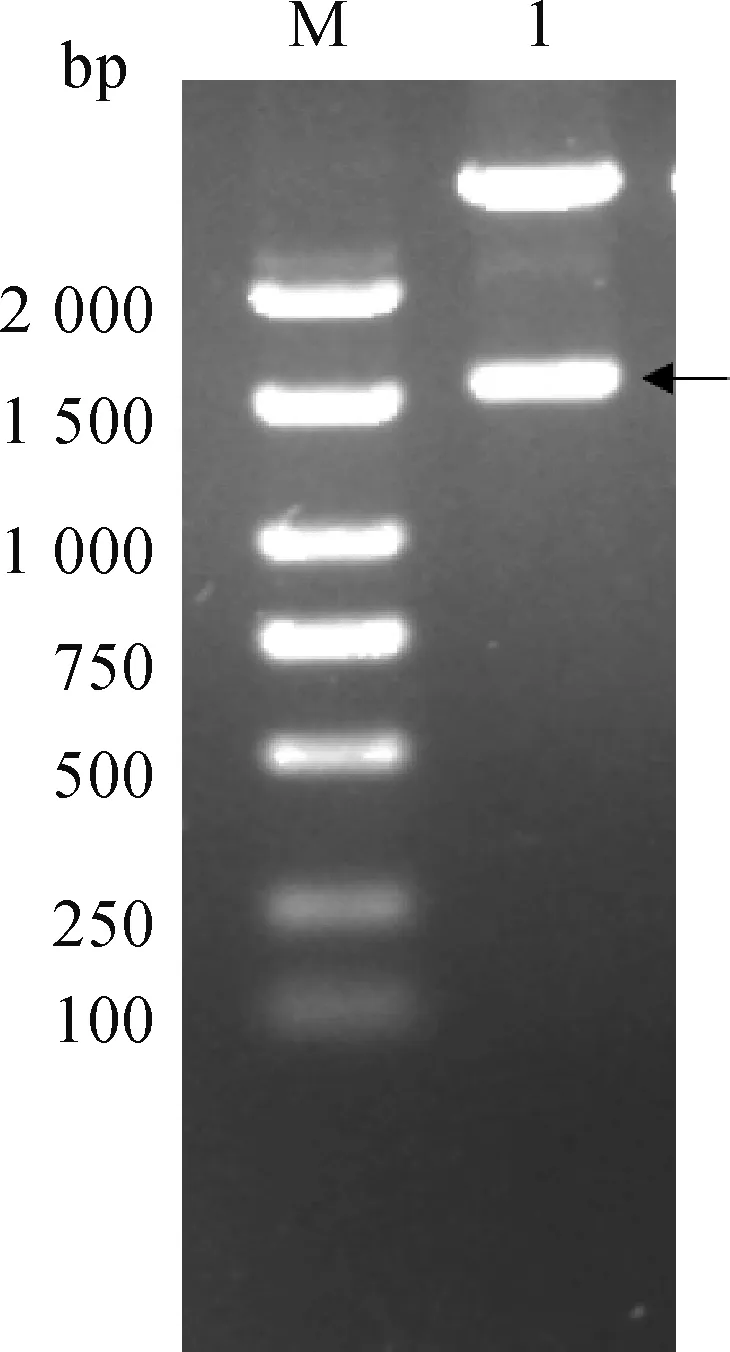
M. DNA相对分子质量标准;1. pET-32a(+)-MPP2酶切片段M. DNA marker; 1. Digested fragments of pEF-32a(+)-MPP2图3 pET-32a(+)-MMP2双酶切鉴定Fig.3 Identification of recombinant plasmid pET-32a (+)-MMP2 digested with Hind Ⅲ and BamHⅠ
2.4 间接ELISA检测方法的建立
2.4.1 抗原最佳包被浓度和血清最佳稀释度的确定 痒螨病兔阳性血清OD450 nm值/阴性血清OD450 nm值(P/N)最高时,其对应的rMMP2最佳包被浓度为 2.34 μg·mL-1,血清最佳稀释度为1∶40。
2.4.2 临界值(cut-off值)、特异性、敏感性和曲线下面积(AUC)的确定 用“2.4.1” 得到的iELISA反应条件检测50份痒螨病兔阳性血清、54份兔阴性血清、11份疥螨病兔阳性血清和15份柔嫩艾美耳球虫兔阳性血清获得OD450 nm值(图5)。利用MedCalc软件绘制计算得到最大约登指数为0.693,此时对应的临界值(cut-off值)为0.223,计算出敏感性和特异性分别为86.0%和83.3%,AUC为0.876(95% CI:0.806~0.946)(图6)。
2.4.3 重复性试验 采用同一批和3个不同批次rPocMMP2包被的酶标板,分别对6份痒螨兔阳性血清进行检测,得到的批内、批间变异系数平均值分别为3.28%和2.51%,均小于10%。结果说明rPocMMP2-iELISA重复性较好。
2.4.4 临床检测 rPocMMP2-iELISA对有痒螨病流行病史的86份临床兔血清样本(图7)进行检测。结果显示,9份病原学检测呈阳性的兔血清样本全部呈现血清学阳性,77份病原学检测呈阴性的兔血清样本中有55份呈血清学阳性。计算获得病原学阳性率为10.47%(9/86),血清阳性率为74.42%(64/86)。可见rPocMMP2-iELISA方法较传统病原学方法能检出更多的亚临床感染病兔。
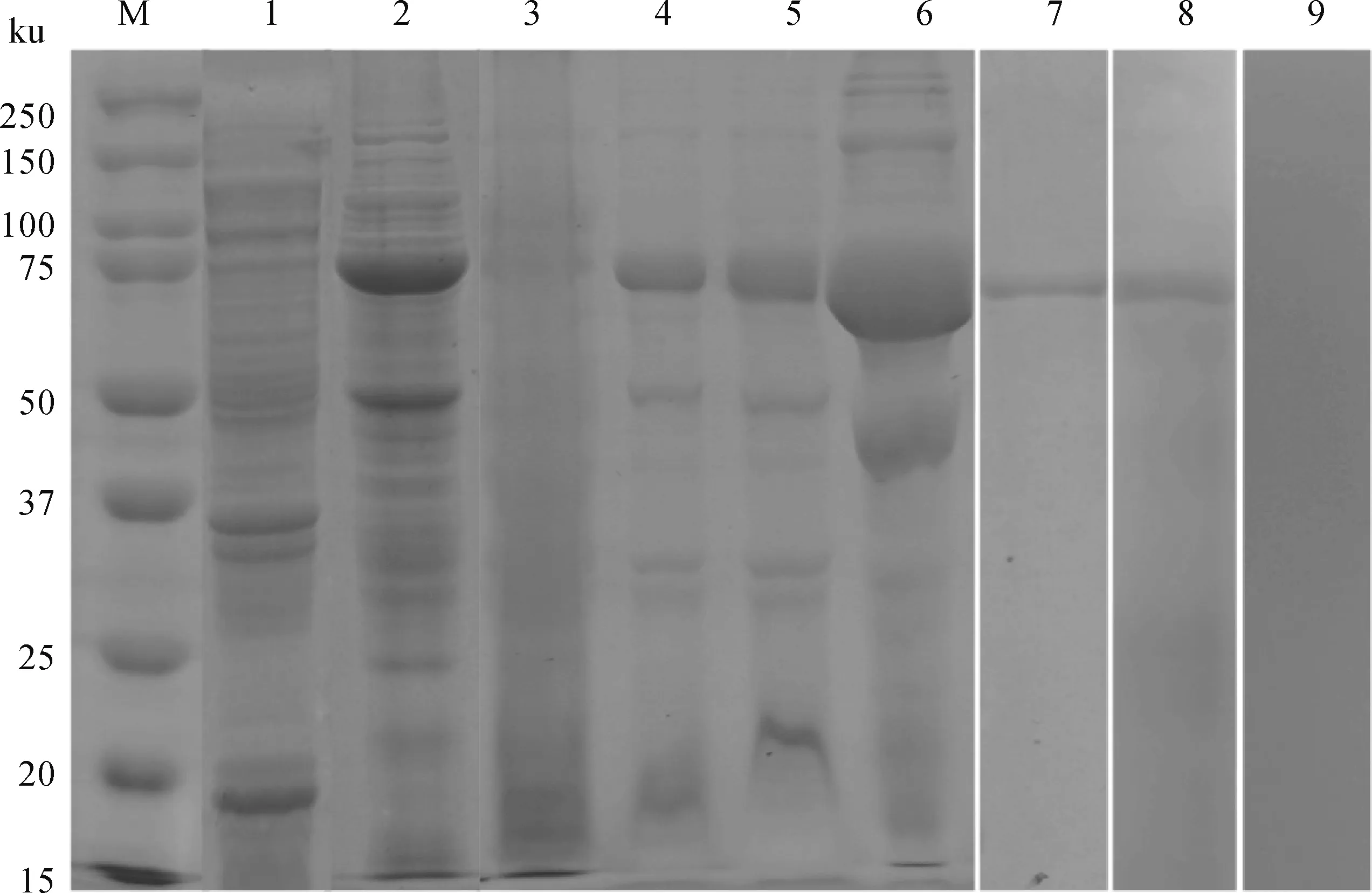
M. 蛋白质相对分子质量标准;1. pET-32(a)空载蛋白;2. 诱导的rPocMMP2;3. rPocMMP2超声裂解上清液;4~6. rPocMMP2超声裂解沉淀分别用2、4、8 mol·L-1尿素处理;7. 纯化的rPocMMP2;8. rPocMMP2+痒螨兔阳性血清;9. rPocMMP2+痒螨兔阴性血清M. Protein marker; 1. Proteins of E. coli expressing pET32a (+); 2. Recombinant proteins of Escherichia coli expressing pET32a (+)-MMP2 induced by the reagent IPTG; 3. The supernatant of sonicated rPocMMP2; 4-6. Inclusion body of rPocMMP2 dissolved in 2, 4, 8 mol·L-1urea, respectively; 7. Purified rPocMMP2; 8. Purified rPocMMP2 immunoblotted with P. ovis var. cuniculi-positive serum from rabbits with psoroptic mange; 9. Purified rPocMMP2 immunoblotted with P. ovis var. cuniculi-negative serum图4 rPocMMP2蛋白表达、纯化及免疫印迹Fig.4 Expression, purification and Western blot of recombinant MMP2 protein of Psoroptes ovis var. cuniculi
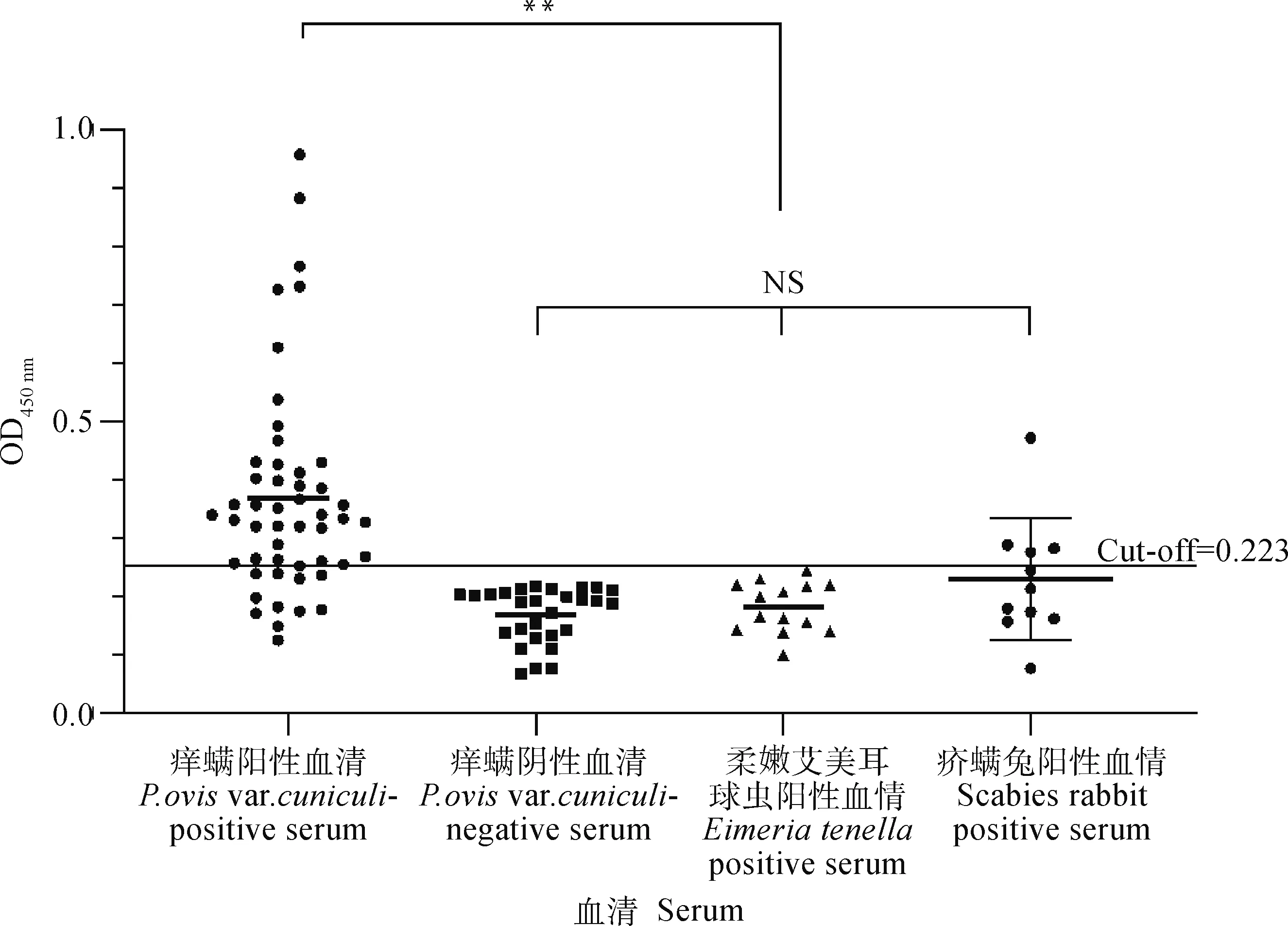
细水平线代表阳/阴性截断值,即cut-off=0.223The thin horizontal line represents the positive/negative cut-off value, cut-off=0.223图5 rPocMMP2-iELISA检测兔痒螨阴/阳性血清、交叉反应血清结果Fig.5 The result of rPocMMP2-iELISA detecting rabbit negative/positive serum and cross-reactive serum
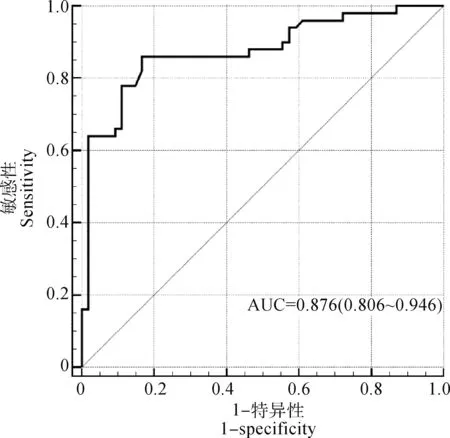
AUC代表曲线下面积AUC stands for area under the curve图6 rPocMMP2-iELISA 的ROC曲线Fig.6 ROC curve of rPocMMP2-iELISA
3 讨 论
本研究获得的绵羊痒螨兔亚种MMP基因的催化区有3个Ⅱ型纤连蛋白重复序列,表明其具有明胶酶的典型结构[16],根据MMPs的分类标准[10],笔者将其归类为MMP2。PocMMP2转录水平分析发现,在P.ovisvar.cuniculi4个发育阶段(雌虫、雄虫、若虫和幼虫)均有表达,推测MMP2在P.ovisvar.cuniculi发育生理过程中具有重要作用;与饱食螨虫相比,饥饿螨虫MMP2转录水平显着升高,推测MMP2可能有助于螨虫找到寄主或取食地点或启动取食行为[12],亦可能与降解宿主皮肤胶原有助于螨虫入侵宿主皮肤表皮层有关[17]。
目前,中国家兔饲养量占全球饲养总量的40%以上,而我国23个省/市/区兔群中痒螨病感染率达7.98%~15.7%[18], 患病兔出现生产性能下降,饲料成本增加,严重者甚至导致死亡,给兔养殖业造成重大经济损失[19-20]。该病通过健康兔与患兔或被虫体污染的物品及饲养人员的衣物等直接接触而感染;兔经实验室一次性人工感染50~100只螨虫后,约4周才能出现明显的结痂临床症状,而在养殖过程中兔经接触途径的自然感染需要更长的时间方可出现明显结痂等临床症状,因此,在感染早期兔往往呈现亚临床感染[5,21-22]。而作为“金标准”的结痂中检测到虫体或虫卵的病原学检测方法无法将这部分亚临床感染的痒螨病兔检出,而成为重要的隐性传染源。研究证实,ELISA方法已被用于多种寄生虫病的血清学检测[23-24],因此,ELISA方法有望作为兔痒螨病的首选血清学诊断方法。目前,已报道有多种重组蛋白用于兔痒螨病的血清学诊断。基于重组肌钙蛋白C建立的Dot-ELISA方法具有95.3%(81/85)的敏感性,但其易与疥螨阳性血清产生交叉反应(10/12)[25];重组精氨酸激酶的iELISA(rPocAK-iELISA)具有94.4%的敏感性和88.2%的特异性,且对兔痒螨病具有早期诊断作用[26];陈宇航等[27]比较了两种重组丝氨酸蛋白酶抑制剂(Psoc 27和PsoSP2)的iELISA方法,发现rPsoc 27-iELISA具有更好的诊断效应,其敏感性和特异性分别为96.0%和90.91%。本研究建立的rPocMMP2-iELISA获得了较好的敏感性(86.0%)和特异性(83.3%),进一步分析计算获得AUC为0.876(0.8
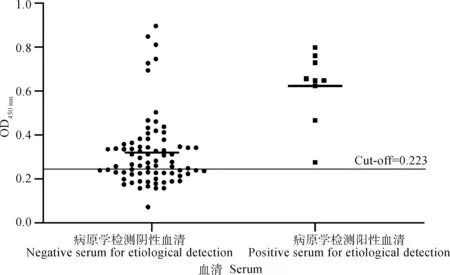
细水平线代表阳/阴性截断值,即cut-off=0.223The thin horizontal line represents the positive/negative cut-off value, cut-off=0.223图7 rPocMMP2-iELISA与传统病原学方法的临床检测Fig.7 Clinical detection of rPocMMP2-iELISA and etiological detection
4 结 论
PocMMP2在P.ovisvar.cuniculi雌虫、雄虫、若虫和幼虫阶段均有表达,且在饥饿虫体的转录水平显着高于饱食虫体;基于rPocMMP2建立的iELISA有良好的敏感性、特异性和较高的重复性,可用于兔痒螨病的血清抗体检测。



