韩亚雯,赖贞霖,张梦美,赵慧英,刘腾飞*
(1.西北农林科技大学动物医学院,杨凌 712100;2.惠农区动物疾病预防控制中心,石嘴山 753600)
奶山羊作为重要的奶畜之一,近几年倍受重视,产业发展形势良好,已成为地方畜牧经济的支柱产业。然而,由于良种繁育体系缺乏、选育工作滞后等因素,我国部分地区奶山羊个体小、产奶量低、泌乳期短,严重制约了该产业的健康发展[1]。当前,要充分发挥我国现有少数高产优质奶山羊品种在改造低产奶山羊中的作用,就必须借助人工授精的方法,而作为其核心环节的精液保存就成为加速我国奶山羊品种改良和培育的关键技术[2]。
精液保存分为冷冻保存和液态保存,冷冻保存能够实现精液的长期保存,但冻融过程会引起精子生理生化指标异常、受精能力和存活率下降,降低繁殖成功率[3]。液态保存是在非冷冻的液态条件下实现的,不仅工艺操作简便、利于运输,更重要的是能减少冻融过程对精子的损伤,是精液保存较为理想的方式[4]。但是,液态保存时间短,精子活力下降迅速,极大限制了该技术的发展和推广,因此迫切需要探明影响液态保存效果的关键因素[5]。大量研究表明,精子结构损伤是影响精子液态保存质量的重要因素[6-7]。电子显微镜技术已被广泛用于精子形态学研究,到目前为止,已报道人[8]、犬[9]和羊[10]等精子冷冻保存过程中的超微结构损伤,但鲜有报道涉及液态保存中奶山羊精子超微结构变化。
本研究采集关中奶山羊精液并进行4 ℃液态保存,利用伊红染色检测精子活率变化,扫描电子显微镜(scanning electron microscope,SEM)和透射电子显微镜(transmission electron microscope,TEM)观察精子超微结构改变,研究结果为阐明影响奶山羊精子液态保存质量的相关机制提供形态学依据。
1 材料与方法
1.1 主要试剂及仪器设备
1.1.1 主要试剂 Tris、果糖、柠檬酸、青霉素、链霉素购自杭州弗德生物公司;常规生化试剂购自上海碧云天生物技术有限公司。
1.1.2 主要仪器 自动荧光显微镜(LECIA DM6B)、场发射SEM(Nano SEM-450)、临界点干燥仪(EM CPD300)、TEM(TECNAI G2 SPIRIT BIO)、徕卡修块机(EM TRIM2)、超薄切片机(EM UC7)。
1.2 试验方法
1.2.1 奶山羊精液采集 选取6只2~3岁、繁殖性能良好、健康的雄性关中奶山羊(陕西省千阳县种羊场),采用假阴道法收集新鲜精液,精子浓度大于3×109个·mL-1、精子活力在90%以上的精液用于试验。
1.2.2 精液稀释与4 ℃液态保存 合格精液用37 ℃稀释液(Tris:36.3 mg·mL-1;果糖:5.0 mg·mL-1;柠檬酸:19.9 mg·mL-1;蛋黄:100 mL·L-1;青霉素:50 IU·mL-1;链霉素:1 mg·mL-1)稀释至3×108个·mL-1,缓慢降温至4 ℃,并开始计算保存时间。每隔24 h收集精液样品,以精子活率>50%计为有效液态保存期。
1.2.3 伊红染色检测精子活率 各组精液样品稀释至3×106个·mL-1,每组设置5个生物学重复。精液样品和伊红染色液以1∶1比例混合均匀,LECIA DM6B显微镜观察。
1.2.4 SEM和TEM观察精子超微结构 基于伊红染色结果,选取0、48、96 h精液样品在SEM和TEM下观察超微结构,每组设置3个生物学重复。精液样品用PBS缓冲液洗涤3次,2.5%戊二醛4 ℃固定24 h。乙醇梯度脱水后临界点干燥仪干燥3 h、粘台、喷金和上样,场发射SEM观察。1%锇酸固定1.5 h,精子经乙醇梯度脱水并用白胶浸润,渗透包埋。采用超薄切片机切片,2%醋酸双氧铀和柠檬酸铅避光处理10 min,TEM观察。
1.3 统计分析
试验数据以“平均值±标准误(Mean±SEM)”表示,使用SPSS 20.0软件进行分析,通过单因素方差分析检验数据差异性,以P<0.05为差异显着性判断标准。
2 结 果
2.1 4 ℃液态保存中奶山羊精子活率变化
伊红染色检测4 ℃液态保存中奶山羊精子活率,结果显示:随着保存时间延长,精子活率逐渐降低(图1)。0 h精子活率为95.4%;与0 h相比,保存至24 h后,精子活率均显着降低(P<0.05),144 h的精子活率小于50%。基于以上结果,收集0、48、96 h精液样品进行后续超微结构研究。

A~G.分别为0、24、48、72、96、120和144 h精子染色图;H.精子活率,柱上不同字母表示差异显着(P<0.05)
2.2 SEM观察4 ℃液态保存中奶山羊精子超微结构变化
SEM观察4 ℃液态保存至0、48、96 h奶山羊精子超微结构(图2)。0 h时,精子头、颈、尾部形态结构正常,头部为扁卵圆形,由细胞核和顶体组成,顶体完整,边界清晰光滑,尾部(中段、主段、末端)结构完好(图2A);保存至48 h,部分精子出现畸形,表现为精子窄头(图2B),尾部断裂卷曲(图2C),结构损伤精子为34.7%(图2G);保存至96 h,精子顶体破损(图2D),尾部主段断裂(图2E),尾部中段线粒体鞘肿胀(图2F),结构损伤精子大于60%(图2G)。
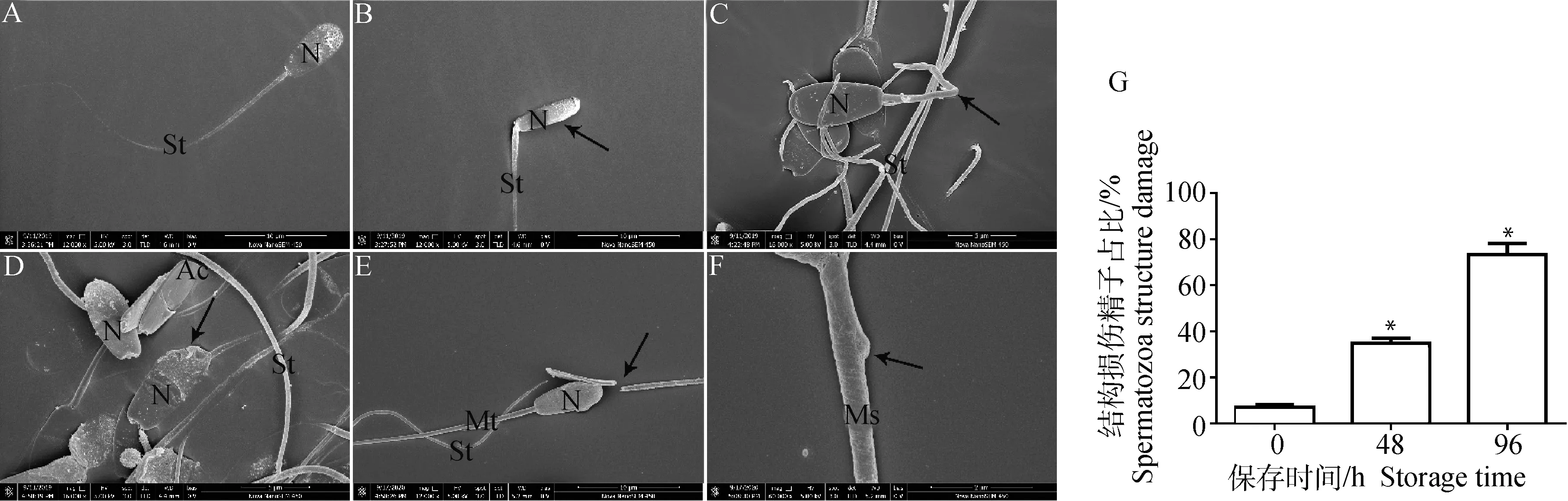
A.0 h,形态正常精子,比例尺=10 μm;B.48 h精子形态,箭头指向窄头,比例尺=10 μm;C.48 h精子形态,箭头指向尾部断裂卷曲,比例尺=5 μm;D.96 h精子形态,箭头指向顶体破损,比例尺=5 μm;E.96 h精子形态,箭头指向主段断裂,比例尺=10 μm;F.96 h精子形态,箭头指向线粒体鞘肿胀,比例尺=2 μm;G.结构损伤精子所占比例,* P<0.05与0 h对比。N.核,Ac.顶体,St.精子尾部,Ms.线粒体鞘。下同
2.3 TEM观察4 ℃液态保存中奶山羊精子超微结构变化
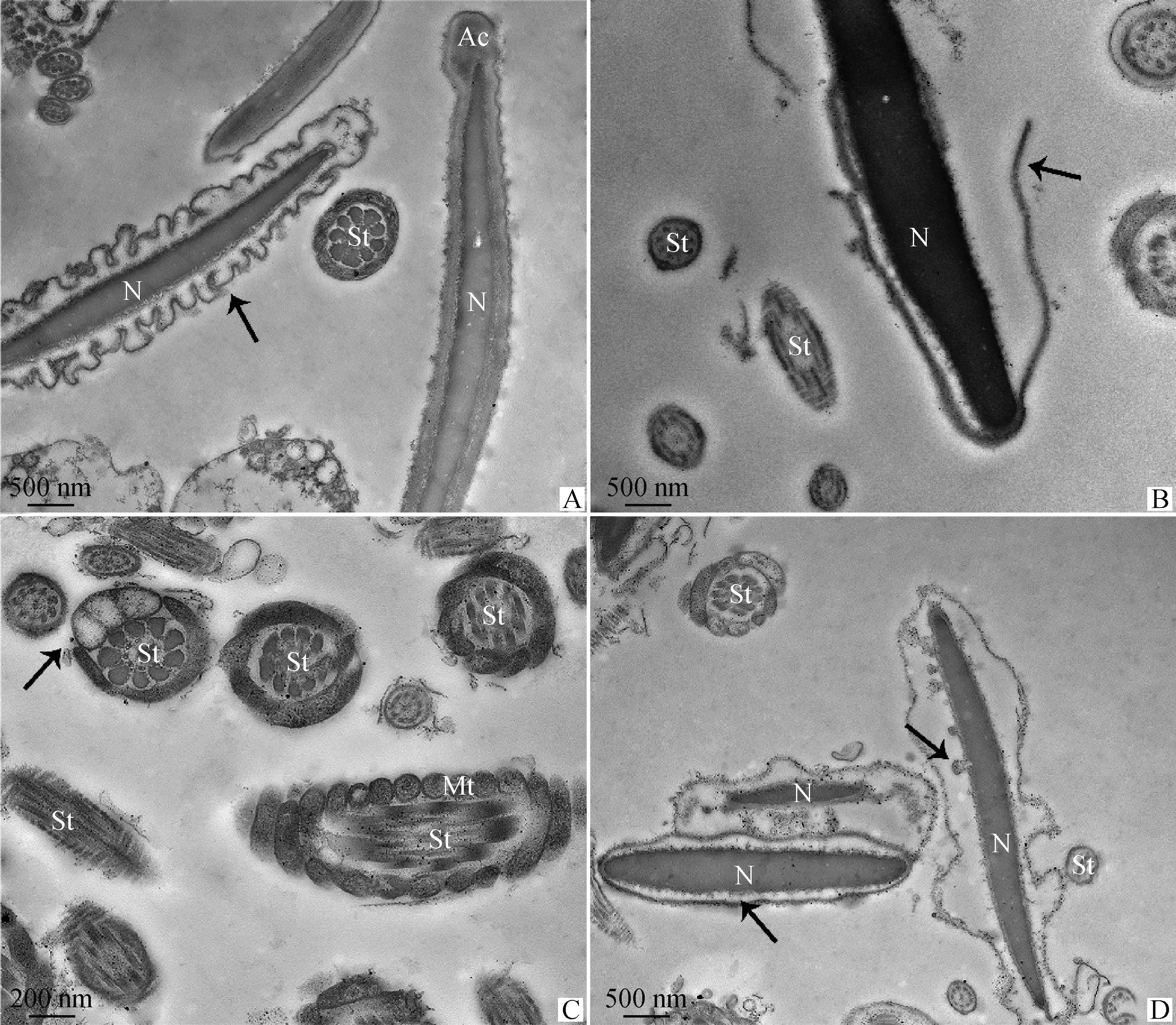
TEM观察4 ℃液态保存中奶山羊精子超微结构变化(图3~5)。0 h时奶山羊精子形态结构正常(图3),头部质膜完整光滑,顶体内膜与核膜紧密结合,核染色质电子密度均匀(图3A、3B)。精子尾部结构完好,中段线粒体鞘结构完整,包裹的轴丝清晰可见,外包质膜,线粒体排列规则、分布均匀、形态大小正常(图3C)。保存至48 h,结构损伤精子所占比例为41.3%(图6),部分精子核膜膨胀折叠呈花环状(图4A),质膜破损(图4B),核表面形成针状突起(图4D),线粒体肿胀、形态大小不一(图4C)。保存至96 h,60.7%精子出现结构损伤(图6),部分精子表现为核电子密度减低并崩解碎裂(图5A、5B),核畸形(图5D),线粒体缺失、排列混乱或位置异常(图5B、5C)。部分精子出现典型凋亡形态特征,如:核表面形成针状突起(图4D),核周出现囊性空泡和凋亡小体(图4D、5D)。

A.0 h,形态正常精子;B~C.0 h,形态正常精子
A.48 h精子形态,箭头指向核膜膨胀折叠;B.48 h精子形态,箭头指向质膜破损;C.48 h精子形态,箭头指向线粒体肿胀;D.48 h精子形态,箭头指向核表面针状突起,囊性空泡和凋亡小体
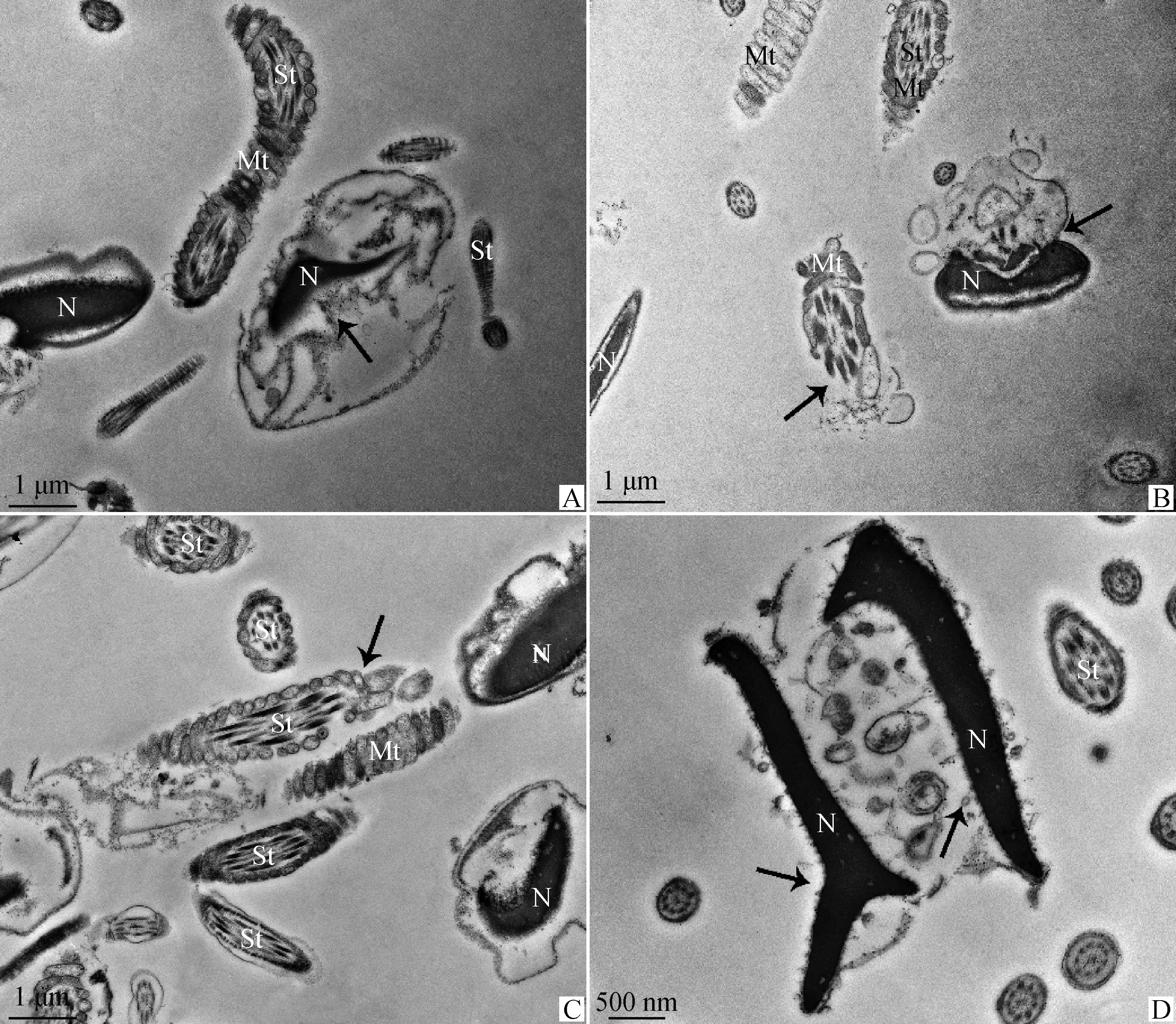
A.96 h精子形态,箭头指向核崩解碎裂;B.96 h精子形态,箭头指向核崩解碎裂,线粒体缺失,排列混乱;C.96 h精子形态,箭头指向线粒体缺失,排列混乱;D.96 h精子形态,箭头指向核畸形,囊性空泡和凋亡小体

*P<0.05与0 h对比
3 讨 论
精液保存是加速奶山羊良种扩繁的关键技术,4 ℃液态保存精液可避免冻融过程对精子造成的损伤,同时抑制精子代谢速率,可有效提高精子存活率和体外受精能力。目前,国内采用人工授精技术的山羊养殖场应用的精液主要以液态保存为主[11]。本试验采用4 ℃液态保存关中奶山羊精子,发现其活率呈时间依赖性逐渐下降,保存至第6天时活率已小于50%,表明4 ℃液态保存下奶山羊精子活率下降快,保存时间较短。
精子结构完整性是评估精液质量的重要指标之一[12]。本研究通过电子显微镜观察4 ℃液态保存中奶山羊精子超微结构变化,奶山羊正常精子结构与之前报道的绵羊、山羊精子形态结构一致[13-14]。4 ℃液态保存条件下,大量精子出现质膜不完整、顶体破损,尤其是头部质膜明显损伤。质膜和顶体是精子结构的重要组成部分,对精子受精过程至关重要。研究表明,精子获能和顶体反应过程中质膜损伤会造成精子活率和受精能力下降,进而导致奶山羊受胎率降低[15]。顶体完整性是评价精子质量的另一个重要指标,是成功受精的先决条件[11]。精子顶体破损导致顶体内容物丧失,进而影响精子获能、顶体反应和受精能力[16]。同时,本研究发现精子线粒体结构损伤明显。线粒体作为精子能量代谢的调控中心,是精子运动的能量来源。线粒体结构损伤不仅影响精子尾部运动和受精过程的能量供给,而且会降低精子活率[17],导致精子质量下降,影响液态保存效果。值得注意的是,部分精子出现典型凋亡形态特征。凋亡是细胞自主的程序化死亡过程,是生殖细胞死亡的主要方式之一[18]。大量研究表明,人[19]、兔[20]和绵羊[21]等精子在保存过程中会发生凋亡,凋亡是影响精液保存质量的一项关键生理机制。由此可见,4 ℃液态保存中奶山羊精子发生凋亡,其可能是影响液态保存效果的关键因素之一。综上所述,4 ℃液态保存中奶山羊精子活率显着下降,同时伴随着明显的结构损伤,部分精子出现典型的凋亡形态特征,以上形态学研究结果为后续深入研究奶山羊精子液态保存奠定形态学基础。
4 结 论
4 ℃液态保存过程中,大量精子出现结构损伤,部分精子具有典型的凋亡形态特征,同时精子活率逐渐降低,提示液态保存中奶山羊精子结构损伤导致活率下降。



