杨 洋,谢黎卿,胡 沛,高丽旭,袁 祥,李 攀,彭远义,李能章
(西南大学动物医学院,重庆 400715)
多杀性巴氏杆菌是一种革兰阴性短小杆菌,自1880年巴斯德首次从患病的禽体内分离鉴定以来,发现该菌能感染几乎所有家禽、家畜及多种野生动物,引起如牛出血性败血症、猪肺疫、禽霍乱和兔巴氏杆菌病等多种动物疾病,每年给养殖业带来了巨大的经济损失。该菌也可感染人,主要通过犬猫抓咬的伤口感染,危害健康。多杀性巴氏杆菌可作为共生菌,常定植于动物口腔及鼻咽等部位,在各种应激或其他病原感染条件下大量增殖,进而侵染组织脏器引发各种疾病。
多杀性巴氏杆菌可分为5种荚膜血清型(A、B、D、E和F)和16种LPS血清型,不同血清型导致的疾病特点及病理变化差异显着,各血清型间交叉免疫保护性差。当前,商品化多杀性巴氏杆菌疫苗主要针对的是牛出血性败血症、猪肺疫、禽霍乱及兔巴氏杆菌病等单一血清型感染类疾病,各疫苗间交叉保护性弱,缺乏针对多种血清型的通用型疫苗。目前,针对多杀性巴氏杆菌交叉免疫保护性疫苗的研究,主要集中在单一抗原筛选方面。
Homchampa等发现,基因缺失能增强部分A型多杀性巴氏杆菌菌株的交叉免疫保护性,Boyce和Adler也发现,与基因缺失,均可导致B型多杀性巴氏杆菌荚膜缺失,毒力减弱及相关免疫保护特性变化。以上研究表明,多杀性巴氏杆菌某些基因的缺失能赋予缺失株交叉免疫保护特性。荚膜是多杀性巴氏杆菌重要毒力因子,与多杀性巴氏杆菌的宿主特异性、致病性、免疫保护性及感染导致的发病类型密切相关。已报道多个基因参与调控多杀性巴氏杆菌荚膜产生,但不同基因调控的荚膜缺失赋予菌株的免疫特性有很大的差异。目前研究发现的基因缺失菌株,其交叉免疫保护性并不强。本研究选择了与A型多杀性巴氏杆菌荚膜多糖合成有关的基因,通过构建缺失株及回补株,探讨该基因对多杀性巴氏杆菌的荚膜产生、生物膜形成、生长繁殖及毒力的影响,以及该基因的缺失对菌株交叉免疫保护性的影响,以期进一步为多杀性巴氏杆菌致病机制及疫苗研究奠定基础。
1 材料与方法
1.1 实验动物、菌株及质粒
雌性昆明小鼠(6~8周龄,体重20~22 g)购自恩斯维尔实验动物中心,饲养及试验方式受西南大学实验动物伦理审查委员会监督(Permit Number: IACUC-20200803-01)。牛源A型多杀性巴氏杆菌(PmCQ1、PmCQ2、PmCQ4、PmCQ5)、牛源F型多杀性巴氏杆菌(PmF)、禽源A型多杀性巴氏杆菌(PmQ)及兔源A型多杀性巴氏杆菌(PmR)均由西南大学动物医学院预防兽医学实验室分离并暂存;牛源B型多杀性巴氏杆菌(PmB,CVCC470)及猪源A型多杀性巴氏杆菌(PmP,CVCC1662)均购自中国兽医药品监察所兽医微生物菌种保藏中心;DH5α 和BL21(DE3) 感受态细胞购自北京博迈德生物技术有限公司。用于基因缺失的质粒pUC19oriKan为实验室前期构建保藏,质粒pMc-Express由四川农业大学曹三杰教授馈赠。
1.2 主要试剂
马丁氏肉汤培养基、脑心浸液肉汤培养基、LB肉汤培养基购自青岛海博生物技术有限公司;抗生素(卡那霉素、氨苄青霉素、氯霉素)、Stains all粉末(7423-31-6)、结晶紫(548-62-9)及吐温20均购自上海生工生物工程股份有限公司;细菌基因组提取试剂盒(DP302-02)及反转录试剂盒(KR118-02)购自天根生物科技有限公司;限制性核酸内切酶(I、I、H I 及d III)购自TaKaRa;In-FusionHD Cloning Kit (PT5162-1)购自Clontech;弗氏完全及不完全佐剂购自Sigma公司;羊抗鼠IgG-HRP、TNF-α、IFN-γ、IL-1β、IL-6、IL-12p40和IL-17A ELISA检测试剂盒购自Thermo Scientific公司;0.4%台盼蓝染液、TritonX-100购自Solarbio;15 A VG矿物油乳化剂为重庆澳龙生物制品有限公司赠送;TMB显色液(3,3′,5,5′-四甲基联苯胺)购自Beyotime公司;细胞RNA提取试剂盒(RE-03111)购自福际生物技术有限公司;细菌RNA提取试剂盒(TR214-50)购自天漠生物。
1.3 基因缺失株及其回补株的构建
本研究选择野生株PmCQ2进行基因缺失株的构建。缺失株构建采用同源重组方法,具体方法参考Tatum等的研究。同源重组质粒采用实验室前期构建的多杀性巴氏杆菌基因缺失温敏型载体pUC19oriKan,通过温度筛选阳性克隆,最终构建无抗性Marker缺失株。构建缺失株及回补株所用引物见表1。取-80 ℃ 保藏的PmCQ2划线接种马丁固体平板,37 ℃ 倒置培养24 h,挑取3~4个菌落接种5 mL马丁液体培养基,37 ℃、200 r·min震荡培养8 h,离心收集菌体,提取基因组DNA备用。以基因组DNA为模板,分别以上、下游同源臂5′ARM-F/5′ARM-R和3′ARM-F/3′ARM-R引物扩增上、下游同源臂DNA片段。以纯化的上、下游同源臂DNA片段为模板,采用5′ARM-F和3′ARM-R引物继续进行PCR扩增,获取上下游同源臂融合DNA片段,与经H I和d III双酶切线性化的pUC19oriKan载体连接,连接产物转化DH5α 感受态细胞,涂布含抗生素的LB平板(Kanamycin, 50 μg·mL)过夜培养,筛选获得同源臂融合DNA片段重组载体。重组质粒经电转PmCQ2后,涂布含100 μg·mLKan马丁氏肉汤培养基上,PCR初步筛选基因缺失菌株 Δ,进而采用qPCR及Western blot 方法,从转录和蛋白水平检测 Δ中有无基因的转录表达,对验证正确的缺失菌株,连续在无抗生素的马丁肉汤培养基中传代30次,保证Kan抗性消除和遗传稳定性。构建回补株时以pMc-Express质粒为模板,采用引物-F/R扩增出基因表达盒,与H I和d III双酶切线性化的pUC19oriKan载体连接,获得重组质粒pUC19oriKan-,经I和I双酶切回收骨架载体,获不含基因的线性载体pUC19oriKan-d备用。以PmCQ2基因组DNA为模板,采用com-F/R引物扩增出完整基因片段,纯化后连接到pUC19oriKan-d,转化DH5α 感受态细胞,筛选获得重组质粒pUC19oriKan-com,其后电转化 Δ感受态细胞,筛选获回补菌株C-,qPCR及Western blot方法检测基因的转录表达。连续传代30次保证其遗传稳定性。

表1 基因缺失株和回补株构建所需引物Table 1 Primers used for the construction of mutant and complementary strains
1.4 Anti-HyaD多克隆抗体的制备
制备HyaD多克隆抗体,通过Western blot方法,以此验证基因缺失株及回补株中有无HyaD表达。制备方法简单来说,以PmCQ2基因组DNA为模板,采用wb-F/R引物扩增基因缺失部分的一个片段,扩增产物连接到pET32a(+),转化DH5α感受态细胞,筛选获得的重组质粒继续转化.BL21(DE3) 感受态细胞,阳性克隆按照实验室前期方法进行蛋白诱导表达和纯化。纯化的重组蛋白与弗氏完全佐剂按照1∶1比例充分乳化混合,重组蛋白终浓度为0.5 μg·μL。小鼠背部皮下多点免疫(100 μL乳化液·只),首免后14 d加强免疫1次,重组蛋白免疫量与首免一致,但佐剂为弗氏不完全佐剂;二免后14 d 尾静脉采血,分离血清备用。
1.5 生长曲线测定
取-80 ℃ 保藏的PmCQ2、Δ、C-分别划线接种马丁固体平板,37 ℃ 倒置培养24 h,挑取3~4个菌落接种5 mL马丁液体培养基,37 ℃、220 r·min震荡培养10 h。菌液稀释平板计数后,采用马丁氏肉汤培养基稀释各菌株培养液含菌量至2×10CFU·mL,其后按1∶100接种量转接5 mL新鲜马丁氏肉汤培养基,37 ℃、220 r·min震荡培养,每隔2 h取样测定OD值,取8个时间点,绘制生长曲线。试验每次设3个生物重复,重复3次。
1.6 荚膜多糖含量测定
荚膜多糖测定方法参照Chung等的研究。分别取1 mL PmCQ2、Δ及C-对数生长期培养液,13 000 r·min离心10 min,去上清,菌体用PBS 洗涤2次,其后用1 mL PBS重悬菌体,42 ℃处理1 h(处理前后分别取5 μL进行平板计数),菌悬液13 000 r·min离心10 min,取100 μL上清液,加入900 μL荚膜染色液(0.2 mg·mL的stains all粉末、50%甲酰胺和0.6%冰醋酸)振荡混匀,同时配制透明质酸标准曲线溶液样品(0、0.5、1、2、3、4、5 μg·(100 μL)透明质酸分别加入900 μL荚膜染色液),采用酶标仪测定OD值,根据标准曲线计算各菌株细胞荚膜含量。试验每次设5个生物重复,重复3次。
1.7 生物膜测定
生物膜测定参考Jin等的研究方法。取平板计数后的PmCQ2、Δ及C-对数生长期培养液,用脑心浸液肉汤(BHI)培养基稀释至菌含量为1×10CFU·mL,取稀释菌液至48孔细胞培养板(400 μL·孔),阴性对照为400 μL BHI肉汤培养基,混匀置37 ℃ 恒温培养48 h。去培养液,PBS(200 μL·孔)轻柔清洗2次,室温干燥,每孔加入200 μL甲醇室温固定1 h,PBS轻柔清洗3次,室温干燥,加入1 %结晶紫(200 μL·孔),37 ℃ 染色30 min,PBS轻柔清洗3次,室温晾干,最后加入33% 冰醋酸溶液(200 μL·孔),37 ℃ 溶解30 min,采用酶标仪测定OD值。试验每次设5个生物重复,重复3次。
1.8 半数致死量(LD50)测定
取马丁肉汤培养至对数生长期的Δ和C-平板计数后,按Δ(1.7×10、1.7×10、1.7×10、1.7×10、1.7×10CFU)和C-(3.4×10、3.4×10、3.4×10、3.4×10、3.4×10CFU)各5个梯度的菌,分别采用肌肉途径攻毒小鼠(=10),连续观察1周。当小鼠濒临死亡时(精神沉郁、闭眼、食欲断绝、外界刺激反应弱等),实施安乐死,统计小鼠死亡数,采用bliss法计算半数致死量。
1.9 脏器细菌定殖和病理分析
分别取2.0×10CFU对数生长期PmCQ2、Δ及C-,左后腿肌肉途径感染小鼠(=6)。攻毒后8、24 h分别取6只小鼠安乐死,采集肺、肝和脾称量、匀浆、稀释涂马丁固体平板,检测其含菌量。采集小鼠感染24 h肺,多聚甲醛固定后送里来佳诺生物科技有限公司做病理切片,HE染色分析。
1.10 细胞感染试验
本细胞试验主要分析野生株PmCQ2、Δ及 C-对小鼠腹腔巨噬细胞的黏附、抗吞噬及促炎能力的差异。方法参照实验室前期研究。无菌采集小鼠腹腔巨噬细胞,制备成细胞悬液后按照1∶4的比例与0.4%的台盼蓝混合,细胞计数板计数后铺于48孔细胞板(2×10细胞·孔),置37 ℃、5% CO培养箱中,贴壁2 h后,去未贴壁细胞,添加新细胞培养液,取对数生长期PmCQ2、Δ及 C-经马丁肉汤平板计数后,按1 MOI(multiplicity of infection)感染细胞,感染8 h后,去培养液,PBS清洗3次。每个菌取一半感染孔,分别加入100 μg·mL环丙沙星(500 μL·孔)处理30 min(杀死细胞外的菌,包括黏附菌),PBS洗涤3次;另一半感染孔不加抗生素处理。其后,所有感染孔,每孔加入500 μL含0.1% TritonX-100的PBS溶液,充分裂解细胞,释放出细胞中被吞噬细菌。取细胞裂解液分别进行平板菌落计数,测定各菌黏附的菌数及被细胞吞噬的菌数。试验每次设5个生物重复,重复3次。
取6孔细胞板,每孔接种2×10个巨噬细胞,贴壁2 h后,分别感染1 MOI对数生长期PmCQ2、Δ及C-,感染8 h后,收集培养液,4 ℃、13 000 r·min离心10 min,取上清液,采用ELISA检测试剂盒,分别检测上清中TNF-α、IL-1β、IL-6、IL-12p40和IL-17A等炎性因子。与此同时,收集各菌感染的巨噬细胞,提取总RNA,采用qRT-PCR方法,分别测定各菌感染的巨噬细胞中-、-1β、-6、-12p40和-17A等基因的转录情况。
1.11 HyaD调控相关基因表达分析
为分析HyaD参与调控其他基因表达情况,在此调查了其对菌株荚膜及生物膜产生、LPS合成及转运、铁转运相关及保护性抗原等相关基因表达的影响。分别取PmCQ2、Δ及C-菌株对数生长期培养液,4 ℃、13 200 r·min离心2 min,收集菌体,采用细菌RNA提取试剂盒提取总RNA,反转录合成cDNA。相关检测基因及引物见表2,qRT-PCR方法检测各基因的表达。试验设5个生物重复。
表2 qRT-PCR检测基因所需引物Table 2 Primers required for gene detection by qRT-PCR
1.12 灭活苗的制备
灭活菌苗制备方法参考试验前期研究。取PmCQ2株和Δ株种子液,按 1% 分别接种马丁肉汤培养基,37 ℃、220 r·min恒温震荡培养12 h,对培养后的PmCQ2株和Δ株菌液,分别进行纯粹性检验和活菌计数后浓缩,浓缩后分别加入终浓度为0.15% 的甲醛溶液,37 ℃ 静置灭活24 h,期间每隔3 h适当振荡使其充分灭活,其后,两种菌各取100 μL处理液,分别涂布于马丁固体培养基上,于37 ℃ 培养24 h 进行灭活检验。灭活检验合格后,将菌液和PBS分别与15 A VG矿物油佐剂按照4∶1体积比混合均匀,分别制成灭活菌苗和PBS乳化剂,使PmCQ2株和Δ株终浓度均为5×10CFU·mL。每种灭活苗各取100 μL涂布在马丁固体平板上,于37 ℃ 培养24 h 进行无活菌检验。另选取6只小鼠,分别背部皮下接种100 μL灭活苗进行疫苗安全性评价。检验合格疫苗4 ℃ 保存备用。
1.13 疫苗交叉保护性测定
取雌性昆明小鼠(6~8周龄,体重20~22 g)270只,随机分为27组,每组10只。按照表3进行疫苗免疫及攻毒分组。其中PmCQ2(1-9)、Δ(1-9)和PBS emulsifier(1-9)各为9个组。小鼠背部皮下多点注射疫苗,共免疫2次,首免后第14天进行加强免疫。首免第21天,分别以3.6×10CFU PmCQ1(LD=3.8×10CFU)、3.2×10CFU PmCQ2 (LD=3.43×10CFU)、4.6×10CFU PmCQ4(LD=2.1×10CFU)、2.9×10CFU PmCQ5 (LD=4.5×10CFU)、1.2×10CFU PmB (LD=5.0×10CFU)、4.4×10CFU PmF(LD=1.0×10CFU)、10 CFU PmQ (LD≈1 CFU)、10 CFU PmP (LD≈1 CFU)、2.2×10CFU PmR (LD=1.0×10CFU)等9株菌肌肉攻毒,攻毒后每天观察2次,记录小鼠临床症状,濒临死亡实施安乐死,记录小鼠死亡数量,连续记录1周。疫苗保护率按以下公式计算:保护率(%)=(对照组死亡率-免疫组死亡率)/对照组死亡率×100。
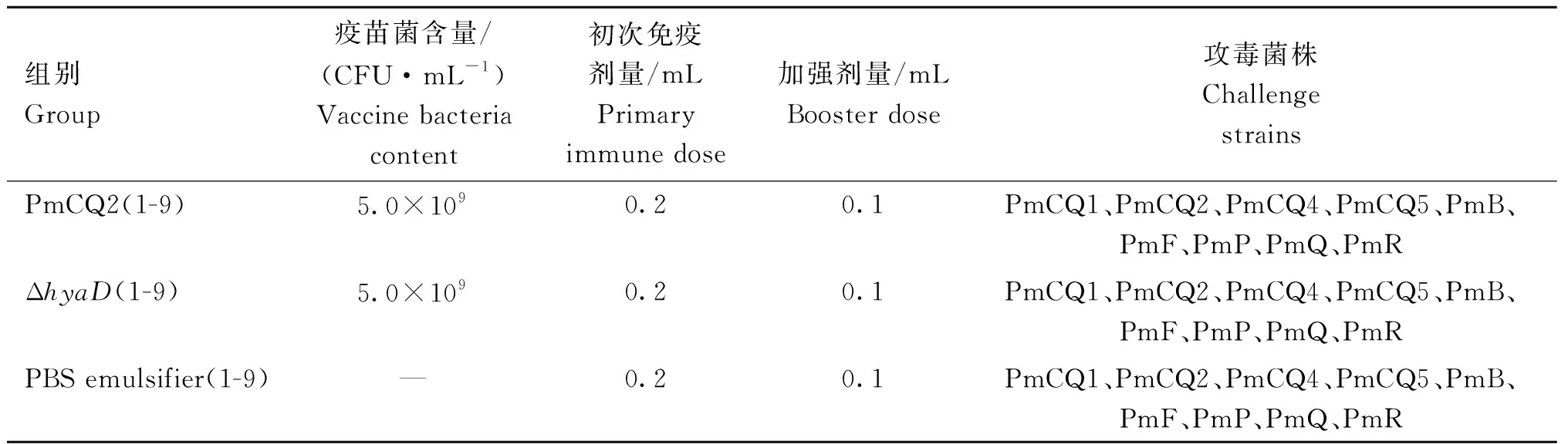
表3 免疫分组和攻毒设计Table 3 Immunization grouping and challenge design
1.14 抗体效价分析
参照“1.13”小鼠免疫分组,共设定2个疫苗免疫组(PmCQ2及Δ)及1个PBS乳化剂免疫对照组和1个未免疫的空白对照组,每组6只小鼠,免疫方式及剂量参见表3,初免21 d尾静脉采血,分离血清,ELISA方法检测疫苗免疫各组特异性抗体水平(包被抗原分别为PmCQ1、PmCQ2、PmCQ4、PmCQ5、PmB、PmF、PmP、PmQ和PmR全菌蛋白)。
1.15 免疫后攻毒,肺病理变化分析
参照“1.13”小鼠免疫分组,设定2个疫苗免疫大组,PmCQ2(1-10)及Δ(1-10),每种疫苗分为10个小组,每小组3只小鼠,免疫方式及剂量参见表3,初免第21天,其中9组分别感染PmCQ1、PmCQ2、PmCQ4、PmCQ5、PmB、PmF、PmP、PmQ、PmR等9种菌,感染剂量参照“1.13”,余下1组作未感染组对照。感染12 h后,所有小鼠实施安乐死,取肺组织送里来佳诺生物科技有限公司制做病理切片,HE染色分析。
1.16 数据统计分析
采用Graphpad Prism 6软件进行试验数据分析处理,检验分析,>0.05为无显着差异;<0.05、<0.01、<0.001、<0.000 1为差异显着。
2 结 果
2.1 hyaD基因缺失株构建及其生物学特性
基因编码UDP-GlcNAc转移酶,根据NCBI GenBank数据库中多杀性巴氏杆菌基因组数据分析,基因主要存在于A型和F型多杀性巴氏杆菌,1株B型多杀性巴氏杆菌中发现存在该基因,D和E型多杀性巴氏杆菌中未发现。A型多杀性巴氏杆菌中,、、等基因簇参与了荚膜多糖的合成转运,但参与的具体作用仍不清楚。本研究选择了一株已基因组测序的牛源A型多杀性巴氏杆菌CQ2菌株进行基因缺失,其基因全长2 919 bp,编码972aa,根据氨基酸序列,分析预测其结构域位置,选择缺失该基因的部分结构域(核酸序列区段:288~490 bp)。其上、下游同源臂扩增引物及缺失株验证引物的设计位置如示意图所示(图1A)。上、下游同源臂融合连接到载体pUC19oriKan,转化野生株PmCQ2感受态细胞,筛选获得缺失株Δ,进而构建含完整基因的回补株质粒,转化Δ感受态细胞,筛选获得基因回补株C-。比较PmCQ2、Δ及C-,采用不同引物对进行PCR扩增,从基因水平验证了所构建的Δ及C-的准确性,Δ中缺失了基因的部分片段,回补株中存在完整的基因(图1B),其后提取菌株RNA,采用qRT-PCR方法检测各菌株中的转录本情况,结果发现,仅Δ中无转录本(图1C),进一步从蛋白水平检测也发现仅缺失株中无HyaD蛋白表达(图1D),即从基因水平、转录水平和蛋白水平等3个方面验证了所构建的Δ及C-的准确性。体外传代30次后,Δ及C-遗传性质稳定。采用马丁氏肉汤培养,Δ接种后4~8 h,生长明显快于PmCQ2和C-,其后各菌株生长趋于一致(图1E)。在马丁氏肉汤平板上生长24 h后,Δ的菌落明显小于PmCQ2的菌落,C-的菌落大小介于二者之间(图1F)。Δ的生长菌落虽然变小,但其本身的生长速度与野生株并无显着差异(图1E),这可能与其细胞的荚膜多糖含量有关,经测定发现,Δ的荚膜多糖含量显着低于PmCQ2和C-(图1G)。A型多杀性巴氏杆菌一般具有较厚的荚膜,在液体中不易离心沉降,而Δ因其荚膜多糖产生量降低,细胞因此变得极易离心和沉降(图1H)。Petruzzi等发现,A型多杀性巴氏杆菌的荚膜多糖产生与其生物膜产生趋势相反,荚膜多糖会抑制生物膜形成,荚膜多糖产生降低会促进生物膜的形成。测定Δ生物膜产生情况,结果发现其产生量显着高于PmCQ2和C-(图1I),其荚膜多糖与生物膜的产生也是呈相反趋势,与Petruzzi等研究结果一致。
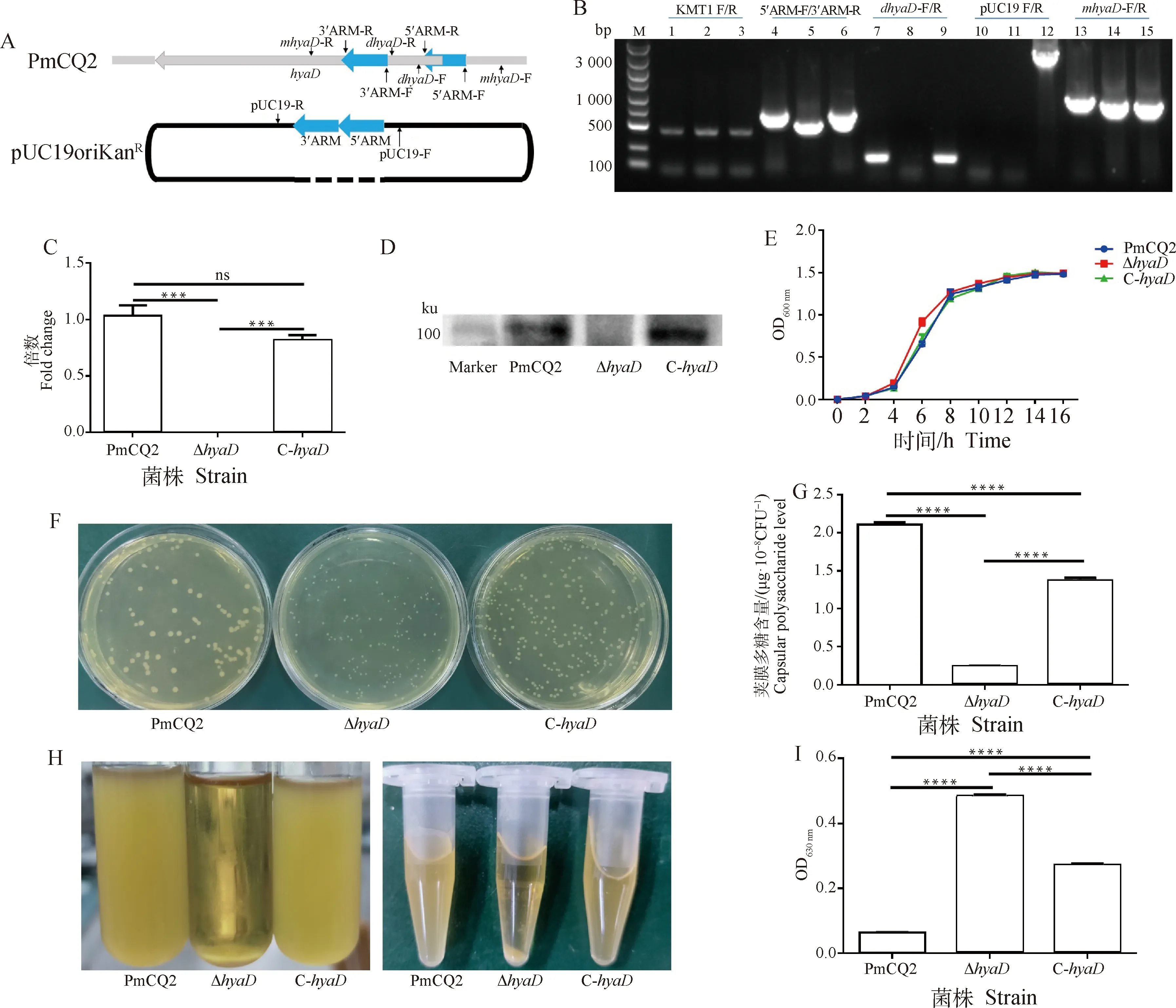
A. 同源臂扩增及缺失株验证引物设计示意图;B. 野生株(PmCQ2)、缺失株(ΔhyaD)及回补株(C-hyaD)的PCR验证,M. DNA marker;泳道1、4、7、10、13. PmCQ2;泳道2、5、8、11、14. ΔhyaD;泳道3、6、9、12、15. C-hyaD;C. hyaD 基因转录情况检测;D. HyaD蛋白表达情况检测;E. 生长曲线;F. 菌落形态;G. 荚膜多糖含量测定;H. 菌体静置沉降及离心状态;I. 生物膜含量测定。ns. 不显着(P>0.05),*. P <0.05,**. P <0.01,***. P <0.001,****. P <0.000 1。下同A. Schematic diagram of primers for homologous arm amplification and mutant verification; B. PCR confirmation of wild type(PmCQ2), mutant(ΔhyaD) and complementary strains(C-hyaD), M. DNA marker; Lane 1,4,7,10,13. PmCQ2 strain; Lane 2,5,8,11,14. hyaD mutant; Lane 3,6,9,12,15. C-hyaD; C. hyaD transcripts detected by qRT-PCR; D. HyaD protein detected by Western blot; E. Growth curve; F. Colony morphology; G. Capsular polysaccharide production; H. The status of bacterial cells sedimentation and centrifugation; I. Biofilm production. ns. No significant difference (P>0.05), *. P <0.05,**. P <0.01,***. P <0.001,****. P <0.000 1. The same as below图1 hyaD基因缺失株及回补株的构建及其生物学特性测定Fig.1 Construction and characterization of hyaD mutant and complementary strain C-hyaD
2.2 hyaD基因缺失致使PmCQ2毒力下调
为探究基因缺失对多杀性巴氏杆菌PmCQ2毒力的影响,分别以2.0×10CFU的 PmCQ2、Δ和C-肌肉途径攻毒小鼠,野生株PmCQ2感染小鼠在3 d内全部死亡,而Δ株感染小鼠 7 d内仅死亡1只,而C-感染小鼠在7 d以内全部死亡,死亡时间较PmCQ2滞后(图2A)。感染后8和24 h,分别测定各菌株在脏器中的定殖量。感染相同剂量和相同时间条件下,野生株PmCQ2在各脏器中的定殖量最高,C-次之,Δ定殖量最低,各菌株间差异显着,并随感染时间延长各菌株定殖量有所升高(图2B、2C),测定各菌株感染24 h导致的小鼠肺部病理损伤发现,Δ引起肺病理损伤最轻(图2D~F)。
A.生存曲线;B、C.脏器中细菌定殖测定; D~F.PmCQ2、ΔhyaD和C-hyaD感染小鼠肺组织HE染色(400×)A. Survival rates; B,C. Bacterial loads in infected mice organs; D-F. HE staining of lung of mouse infected with PmCQ2, ΔhyaD and C-hyaD, respectively (400×)图2 PmCQ2、ΔhyaD及C-hyaD致病性比较分析Fig.2 Pathogenicity analysis of wild-type PmCQ2, hyaD mutant and C-hyaD
测定Δ和C-肌肉感染小鼠的半数致死量,Δ的LD为2.30×10CFU,约为野生株PmCQ2半数致死量(LD=3.43×10CFU)的6 700倍,而C-的LD为1.43×10CFU,约为PmCQ2的4倍(表4),基因的回补,基本恢复了Δ菌株相关毒力,表明Δ毒力降低的确是受到了HyaD调控。

表4 ΔhyaD和C-hyaD 菌株半数致死量测定Table 4 Median lethal dose (LD50) of hyaD mutant and C-hyaD strain CFU
2.3 hyaD基因缺失促进细胞黏附吞噬及相关炎性因子的产生
前面试验已经证实,基因缺失会导致菌株荚膜含量降低及相关毒力显着下降。荚膜能促进病原抗细胞吞噬能力,前期有研究发现,多杀性巴氏杆菌荚膜的缺失会促进细菌的细胞黏附能力,那么Δ感染细胞的情况如何?本试验选用了小鼠腹腔巨噬细胞进行测试。采用同一剂量的PmCQ2、Δ和C-分别感染巨噬细胞,发现Δ更易黏附于巨噬细胞表面(图3A),并且被吞噬的数量显着高于PmCQ2和C-(图3B),C-黏附和被吞噬的数量介于PmCQ2和Δ之间(图3A、3B),结果进一步证实多杀性巴氏杆菌荚膜缺失会促进细菌的细胞黏附能力。进一步测定各菌株诱导巨噬细胞炎性因子产生情况,结果发现,与野生株PmCQ2和回补株C-比较,在RNA转录和蛋白分泌水平,缺失株Δ能显着促进巨噬细胞-、-1β、-6、-12p40和-17A炎性基因的转录(图3C~G)和TNF-α、IL-1β、IL-6、IL-12p40和IL-17A炎性因子的分泌(图3H~L),该结果表明,菌体黏附和被吞噬的越多,宿主细胞的相关炎性因子产生越高。有趣的是,PmCQ2与C-诱导炎性基因的转录本无显着差异,然而在其炎性因子分泌水平方面却差异显着(图3C~L),这可能与转录本(半衰期短)是一个短时间累积结果,而分泌出的蛋白因子(半衰期长)是一个较长时间累积结果有关。
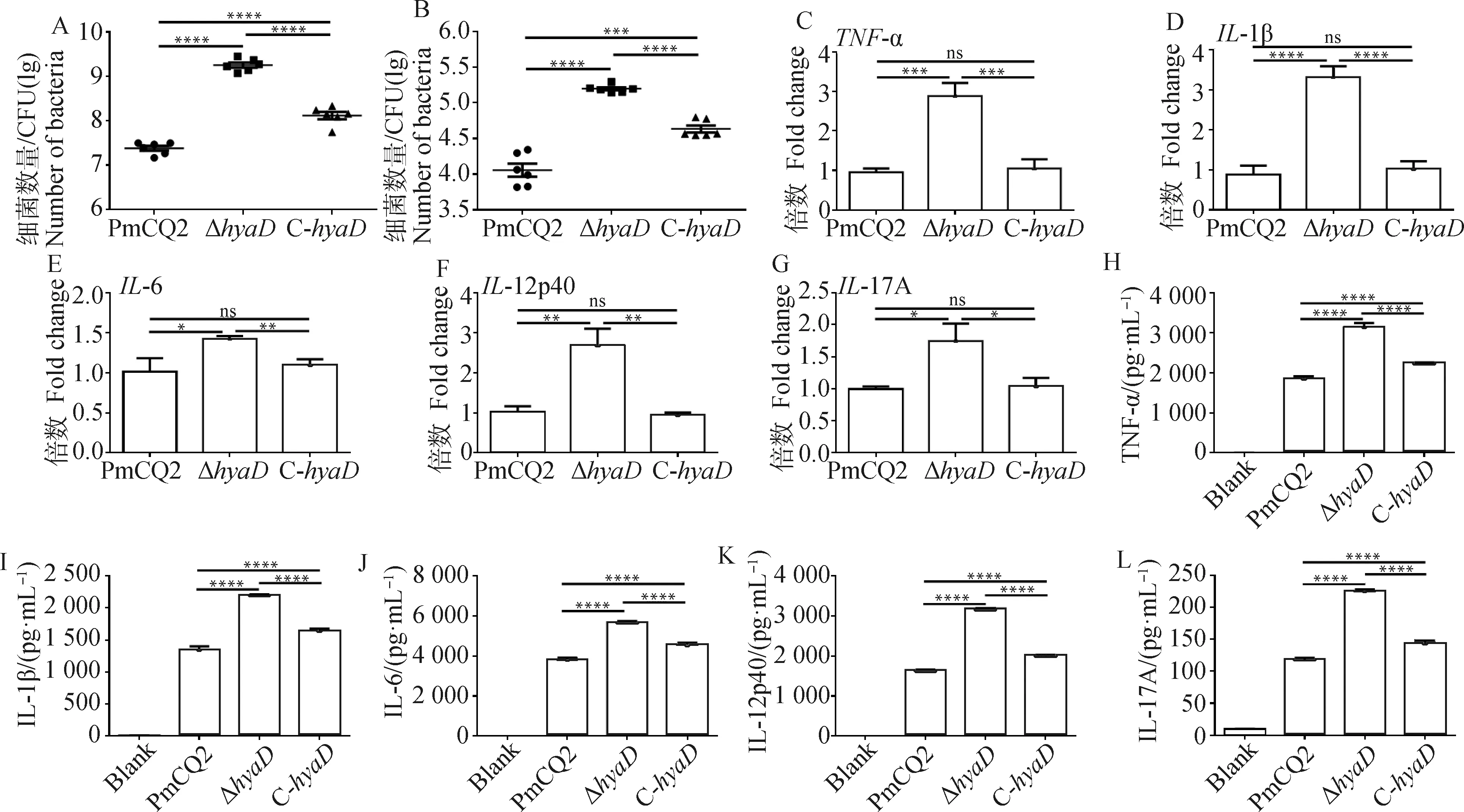
A. 黏附巨噬细胞的细菌数量测定;B. 巨噬细胞吞噬的细菌数量测定;C~G. 感染巨噬细胞炎症相关基因表达情况;H~L. 感染巨噬细胞炎性因子分泌情况A. The number of bacteria attached to macrophages; B. The number of bacteria in macrophages; C-G. The expression of inflammatory genes in macrophages infected with 1MOI of PmCQ2, hyaD mutant and C-hyaD, respectively; H-L. Inflammatory factors secretion of macrophages infected with 1MOI of PmCQ2, hyaD mutant and C-hyaD, respectively图3 巨噬细胞感染分析Fig.3 In vitro macrophage infection analysis
2.4 hyaD基因缺失对菌株其他基因表达的影响
基于Δ相关生物学特性变化,选择分析了与荚膜多糖合成转运、生物膜合成、铁转运、LPS合成转运、毒力、保护性抗原等相关基因的表达差异。与PmCQ2和C-相比,Δ荚膜合成相关的、、、等基因显着下调(图4A~D),与生物膜合成相关的、基因表达显着上调(图4E、F),与铁转运相关的、基因表达显着下调(图4G、4H),而与LPS合成与转运相关的、、、基因表达呈显着下调(图4I~L),与菌株毒力有关的0442、4基因表达也显着下调(图4M、4N)。考虑到多杀性巴氏杆菌外膜蛋白与交叉保护性密切关系,分析比较了野生株与缺失株部分外膜蛋白基因的表达差异,结果发现,缺失株中大量外膜蛋白基因如、、、、、、、、、、、、、、、、、2等基因的表达显着上调(图4O),包括已证实具有交叉免疫保护性的外膜蛋白如OmpH、PlpE等,这预示着Δ可能具有交叉保护特性。
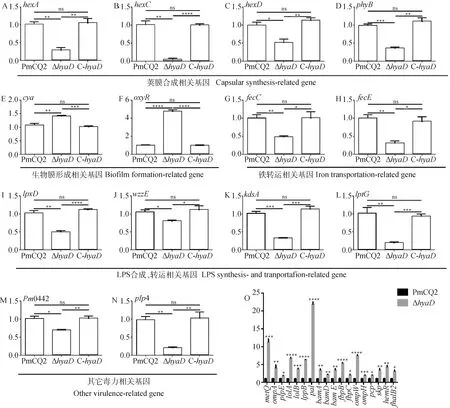
A~D. 荚膜合成相关基因转录表达情况;E、F. 生物膜形成相关基因转录表达情况;G、H. 铁转运相关基因转录表达情况;I~L. LPS合成、转运相关基因转录表达情况;M、N. 毒力相关基因Pm0442和plp4转录表达情况;O. 外膜蛋白相关基因转录表达情况A-D. The expression of capsular synthesis-related genes; E, F. The expression of biofilm formation-related genes; G, H. The expression of iron transportation-related genes; I-L. The expression of LPS synthesis- and transportation-related genes; M, N. The expression of virulence-associated genes Pm0442 and plp4; O. The expression of outer membrane protein genes图4 hyaD基因缺失调控相关基因转录表达分析Fig.4 ΔhyaD influence other gene expression using qRT-PCR
2.5 hyaD基因缺失促进菌株交叉保护特性
依据前面试验结果,基因缺失导致了多杀性巴氏杆菌荚膜多糖含量及外膜蛋白显着变化,特别是与免疫保护性相关的一些蛋白表达显着上升,预示着菌株可能具有了新的免疫保护特性。为检测缺失株的免疫保护特性,分别制备了野生株PmCQ2和不同缺失株Δ灭活菌苗,比较二者对不同血清型和不同动物源多杀性巴氏杆菌的免疫保护性差异。以制备好的PmCQ2株和Δ株灭活疫苗分别免疫小鼠,观察免疫小鼠精神状态、食欲良好,背部皮下无明显肿块。免疫后21 d,尾静脉采血,分离血清,以不同菌株细胞全蛋白作为包被抗原,ELISA检测各血清中针对各菌株的特异性抗体水平。Δ株免疫小鼠血清中整体抗体水平(图5A)均高于PmCQ2株免疫小鼠(图5B),抗牛源A型和B型多杀性巴氏杆菌的抗体水平显着高于抗牛源F型和其他动物源多杀性巴氏杆菌的抗体水平(图5A、5B),由此可以看出疫苗株与各野生菌株间其交叉免疫抗原量的多少。
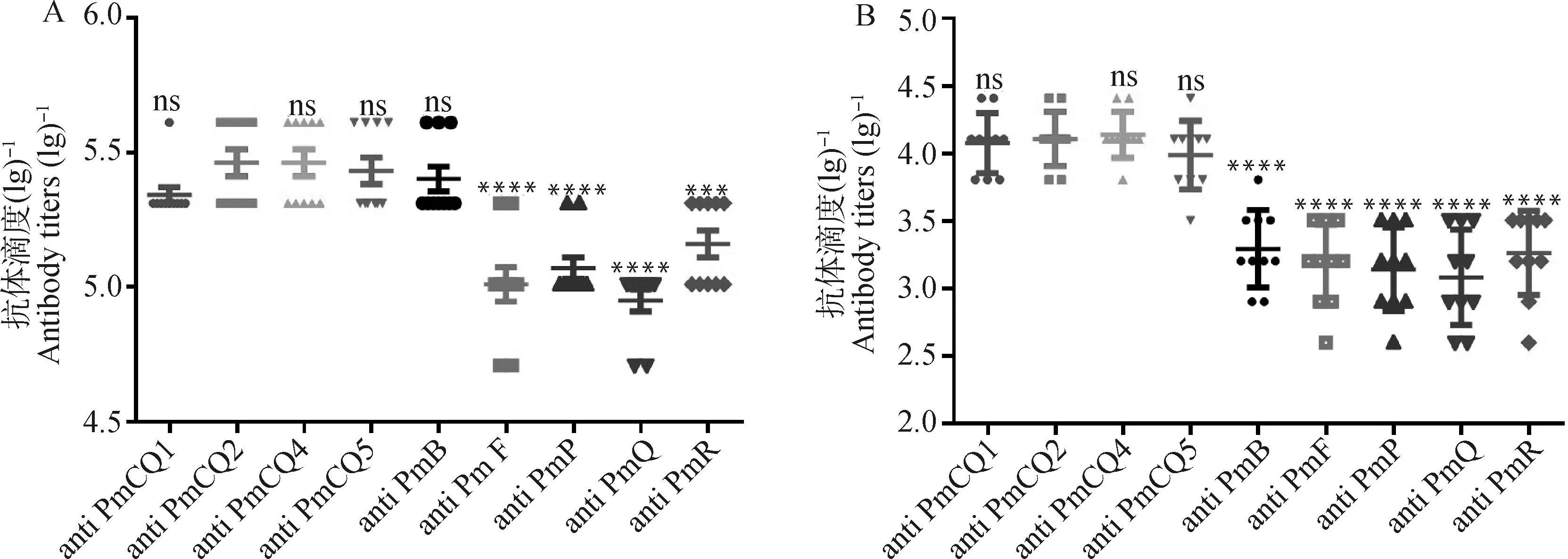
A. ΔhyaD株免疫小鼠抗体效价;B. PmCQ2株免疫小鼠抗体效价A. Antibody titers of mice immunized with hyaD mutant inactivated vaccine; B. Antibody titers of mice immunized with PmCQ2 inactivated vaccine图5 免疫小鼠抗体产生情况Fig.5 Antibody generation of immunized mice
免疫小鼠经尾静脉采血后,肌肉途径分别攻毒不同血清型和不同动物源多杀性巴氏杆菌菌株,Δ株灭活疫苗对牛源A型多杀性巴氏杆菌(PmCQ1、PmCQ2、PmCQ4、PmCQ5)和牛源B型多杀性巴氏杆菌PmB的免疫保护率达100%(图6A~E),对牛源F型多杀性巴氏杆菌PmF的保护率也达80%(图6F),对猪源A型多杀性巴氏杆菌PmP、禽源A型多杀性巴氏杆菌PmQ和兔源A型多杀性巴氏杆菌PmR的保护率也分别达100%、100%和90%(图6G~I);而PmCQ2株灭活苗除对牛源A型多杀性巴氏杆菌(PmCQ1、PmCQ2、PmCQ4、PmCQ5)的免疫保护率达80%以上(图6A~D),对牛源B型和F型多杀性巴氏杆菌的交叉免疫保护性弱,低于30%(图6E、6F),对兔源、禽源和猪源多杀性巴氏杆菌无交叉免疫保护作用(图6G~I)。以上研究结果表明,基因缺失调控了菌株相关基因表达的改变,赋予了菌株新的交叉免疫保护特性。
A~I. 小鼠肌肉途径免疫PmCQ2 和ΔhyaD疫苗,对照组注射PBS,免疫后第21天, 肌肉途径分别感染PmCQ1(A)、PmCQ2(B)、PmCQ4(C)、PmCQ5(D)、PmB(E)、PmF(F)、PmP(G)、PmQ (H)和PmR(I),记录小鼠存活率,绘制各菌株感染小鼠生存曲线图A-I. Mice were immunized with inactivated PmCQ2 and inactivated hyaD mutant, and injected with PBS as controls, and then challenged with PmCQ1(A), PmCQ2(B), PmCQ4(C), PmCQ5(D), PmB(E), PmF(F), PmP(G), PmQ(H) and PmR(I) at day 21 after primary immunization, respectively, record the survival mice number for the protective rate calculation图6 疫苗交叉免疫保护性测定Fig.6 Cross-protection of inactivated PmCQ2 and inactivated hyaD mutant
为进一步比较Δ株与野生株PmCQ2灭活苗的免疫保护效果差异,分析疫苗免疫后感染的肺组织病理损伤后发现,Δ株免疫小鼠,在攻毒12 h后肺无明显或轻微病理损伤(图7),而未免疫小鼠和野生株PmCQ2免疫小鼠的肺病理损伤较为严重,肺泡上皮细胞不同程度脱落,肺间质内较多炎性细胞浸润(图7),表明Δ疫苗能显着减轻毒株感染对脏器的损伤。PmCQ2灭活苗虽对野生株PmCQ2攻击有100 % 免疫保护作用,但在受攻击早期,免疫小鼠脏器还是会受到一定损伤,这种损伤程度可能与攻毒剂量与个体的保护性抗体水平有关。
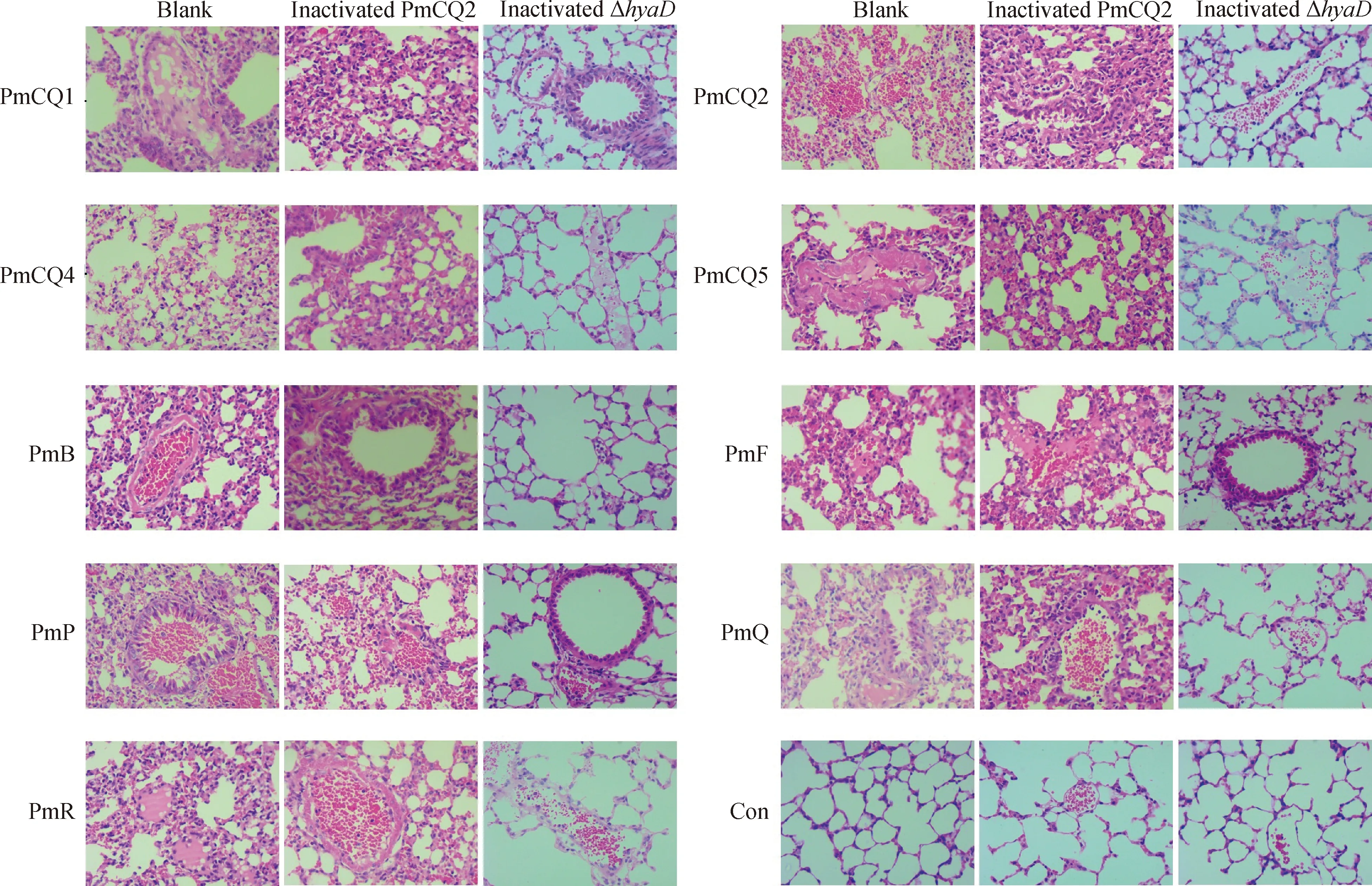
小鼠免疫PmCQ2 和ΔhyaD疫苗后第21天,与未免疫小鼠一起,分别感染PmCQ1、PmCQ2、PmCQ4、PmCQ5、PmB、PmF、PmP、PmQ和PmR,感染后12 h,取肺组织HE染色Mice were immunized with inactivated PmCQ2 and inactivated hyaD mutant, and then challenged with PmCQ1, PmCQ2, PmCQ4, PmCQ5, PmB, PmF, PmP, PmQ and PmR at day 21 after primary immunization, the lungs were collected at 12 h post infection for the HE staining图7 小鼠肺组织病理损伤分析(400×)Fig.7 Histopathological lesion analysis of mice lung (400×)
3 讨 论
多杀性巴氏杆菌能引起多种动物疾病,包括禽霍乱、猪萎缩性鼻炎、蹄类动物出血性败血症、牛羊地方性肺炎、兔鼻炎以及人类的伤口脓肿和脑膜炎(比较罕见)。根据NCBI基因组数据库中多杀性巴氏杆菌及相关文献报道,在5种荚膜血清型多杀性巴氏杆菌中,A型多杀性巴氏杆菌几乎能感染所有可感染多杀性巴氏杆菌的动物,可导致禽霍乱、肺炎、鼻炎、伤口脓肿等疾病,其临床分离率最高;其次是B型和F型,B型常见感染猪、牛、羊,主要导致出血性败血症,F型常见感染兔和禽,偶有感染猪、牛的临床株,有时从猫、狗口腔中也能分离出;D型主要感染猪和兔,E型可感染猪、牛、羊、骆驼等,主要导致动物出血性败血症,但D型和E型的临床分离率相对较低。除按荚膜分型外,多杀性巴氏杆菌根据其菌体LPS进行分型,还可分为16种血清型,由此可以看出多杀性巴氏杆菌血清型的多样性。不同血清型和不同动物来源的多杀性巴氏杆菌菌株致病性差异较大,相互交叉免疫保护性弱,这为多杀性巴氏杆菌疫苗的研究带来了困难。目前,仅有的几种多杀性巴氏杆菌商品化疫苗,也仅对同源血清型毒株感染提供有限的免疫保护作用。如何有效控制不同血清型和不同动物源多杀性巴氏杆菌的感染,抗生素治疗似乎是可无差别针对不同血清型多杀性巴氏杆菌的,但随着抗生素的大量使用,出现了越来越多的耐药性多杀性巴氏杆菌菌株,这为该病原的防控带来了新的问题。因此,对于多杀性巴氏杆菌易感动物群体,疫苗预防仍是有效的主要防控手段。
多杀性巴氏杆菌虽有多种血清型,但基因组比较分析发现,多杀性巴氏杆菌2 000多个基因中,各血清型间绝大多数基因相同或同源性高,PlpB、PlpE、PmCQ2_2 g0128、OmpH、Omp87等交叉保护性抗原的发现,进一步证实各血清型菌株间存在交叉免疫保护性抗原,但通常单一抗原其交叉免疫保护作用有限。Homchampa等通过缺失多杀性巴氏杆菌P-1059株(血清型A:3)的基因获得的缺失株能够保护血清型A:1和A:4 菌株的感染,这为多杀性巴氏杆菌疫苗研究展示了新的方向。通过基因缺失的方式改变细胞的相应基因表达调控,促使相关交叉免疫保护性抗原的表达上调等,可能起到交叉免疫保护效果,但关键是确定哪些基因缺失能改变菌株免疫保护特性。本课题组前期研究中,PmCQ2菌株0979及0442基因缺失株均未发现交叉免疫保护特性。即便同一基因缺失,不同菌株其交叉保护特性也可能不同,如多杀性巴氏杆菌X-73株(血清型A:1)的基因缺失株就没有交叉保护特性,本研究中,PmCQ2菌株基因缺失株的交叉保护作用,不仅体现在针对同源荚膜A型菌株,还针对同源荚膜B型和F型菌株及异源A型菌株,这与所报道的基因缺失株仅针对同源A型菌株保护不同,PmCQ2株基因缺失株表现出更强的交叉免疫保护特性。PmCQ2菌株基因缺失所表现出的交叉免疫保护特性,是否在其他菌株中同样存在,这需进一步研究,但也可能与基因一样,基因缺失赋予不同菌株不同的免疫保护特性。
自然选择致使菌株具有各自的独特性,包括其致病性、生长繁殖、抗逆性及免疫保护等,细胞组成结构的差异与其独特性密切相关。从免疫保护角度来看,同一菌株,不同培养条件,其免疫保护性可能会出现显着差异,采用限铁性培养基培养,多杀性巴氏杆菌菌株的免疫保护性会显着增强,不同培养条件导致的细胞组成成分表达差异是其关键原因。基因缺失,改变了细菌原有基因表达模式,部分性状会随之改变。多杀性巴氏杆菌PmCQ2 菌株基因的缺失,导致了部分荚膜合成转运基因及毒力相关基因表达下调,同时也导致了菌株众多外膜蛋白基因(、、、、、、、、、、、、、、、、、2等)的表达显着上调,相关基因表达的变化,致使菌株在荚膜、毒力、菌落形态及免疫保护性等性状方面发生了显着变化。那么荚膜缺失是否与Δ的交叉免疫保护特性有关呢?在本研究中,答案是肯定的。但是否缺失了荚膜的菌株都会表现出交叉保护特性呢?情况却未必。荚膜位于细胞最外层,具有抗逆抗吞噬作用,是病原非常重要的毒力因子,Boyce和Adler发现,多杀性巴氏杆菌荚膜缺失会导致菌株毒力显着下调,也可赋予菌株较强的免疫保护特性,但不同基因导致的荚膜缺失,各菌株却表现出了不同的免疫保护特性,与基因缺失均可导致B型多杀性巴氏杆菌的荚膜缺失,但其缺失株免疫保护特性却出现显着差异。基因的缺失导致菌株荚膜缺失,赋予了菌株较强的交叉免疫保护特性,而同样是野生株PmCQ2,其0442基因缺失也导致菌株荚膜的缺失,却并没有赋予菌株交叉保护特性,同样,实验室分离的一株因基因的点突变导致的荚膜天然缺失的多杀性巴氏杆菌PmCQ6株,其交叉保护性也较弱。由此可以看出,多杀性巴氏杆菌荚膜缺失与菌株免疫保护特性并无必然相关性,同时,荚膜多糖的大量存在,也可能会限制相关保护性抗原的免疫作用。Δ中如PlpB、PlpE、OmpH和OmpW等与免疫保护相关的外膜蛋白表达上调及荚膜多糖含量的减少,可能是其具有较强交叉免疫保护作用的关键。
4 结 论
本试验通过构建牛源A型多杀性巴氏杆菌CQ2株(PmCQ2)荚膜合成基因缺失株Δ和其回补株C-,初步证实了基因能够调控PmCQ2株的荚膜生成、生物膜形成、生长繁殖及毒力等生物性状,基因的缺失赋予了菌株较强的交叉免疫保护特性,为多杀性巴氏杆菌通用型疫苗研究提供了参考依据。



