门凯凯,刘佳隆,郭亚格,何 雷,贾艳艳,余祖华
(河南科技大学动物疫病与公共卫生重点实验室 洛阳市活载体生物材料与动物疫病防控重点实验室,洛阳 471023)
新城疫(Newcastle disease, ND)作为一种临床上常见的家禽传染性疾病,是一种以呼吸道、消化道黏膜出血为典型病理特征的高度传染性病毒病,主要侵袭家鸡,也可感染其它家禽和野生禽类,是当今全球范围内最重要的家禽传染病之一,禽一旦感染新城疫病毒,极易被大肠杆菌、沙门菌等其它病原菌感染,进而降低蛋鸡产蛋量,增加育成鸡死亡率[1-3]。目前在临床禽病中,致病性大肠杆菌和沙门菌带来的疾病仍然很多,给养殖户造成很多的困扰,造成了经济损失,尤其当其它病原(如新城疫病毒)感染后容易并发或继发细菌性疾病,会造成更大的经济损失[4-5]。转化生长因子β(transforming growth factor-β,TGF-β)是一种分泌性、炎症性的多功能细胞因子,在抗微生物感染及机体免疫调控中发挥着重要作用[6-7]。转化生长因子β1(TGF-β1)是转化生长因子家族中的一个重要成员,TGF-β1蛋白包括1个精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartic acid, RGD)基序和4个高度保守的同源性内部重复结构域,RGD基序作为一个配体可以与细胞表面的整合素受体结合,介导细胞的黏附和迁移[8-10],TGF-β1编码的细胞外基质蛋白与细菌黏附素等结合介导细菌黏附细胞[11]。细菌黏附是一种普遍存在的生物现象,是细菌致病的先决条件,也是细菌寄生活动的基础和感染致病的前提[12-13]。那么家禽感染NDV后并发或继发大肠杆菌、鸡白痢沙门菌等细菌病与鸡TGF-β1表达有怎样的关联,鸡TGF-β1在致病性大肠杆菌和鸡白痢沙门菌感染家禽中具有怎样的作用需要进一步研究。因此,本研究在检测NDV感染DF1细胞后鸡TGF-β1的表达量的基础上,构建鸡TGF-β1的重组过表达载体和干扰表达载体,将其转染DF1细胞以调节鸡TGF-β1的表达量,然后检测鸡TGF-β1对致病性大肠杆菌和鸡白痢沙门菌黏附DF1细胞的影响,为进一步研究鸡TGF-β1在临床病毒感染继发细菌性疾病中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞、菌(毒)株与质粒 DF1细胞,大肠杆菌DH5α、致病性大肠杆菌(CVCC1527)和鸡白痢沙门菌(C79-13)、鸡新城疫病毒(La Sota株),pUC57、pG1.2、pDC316-mCMV-ZsGreen载体质粒均由河南科技大学动物疫病与公共卫生实验室保存。
1.1.2 试剂 质粒提取试剂盒购于北京天根生化科技有限公司;限制性内切酶BsaI(RO535V)、SacI(ER1135)分别购于NEB和Thermo Scientific,NheI(D6489)和Hind III(1615)分别购于Beyotime和TaKaRa,反转录试剂盒(RR047A)、SYBRGreenMasterMix(RR420)购于TaKaRa公司;Lipofectamine2000转染试剂和Opti-MEM培养基均购于美国Invitrogen公司;TRIzol试剂购于GenStar公司;鸡TGF-β1 ELISA试剂盒购于瑞信生物公司。
1.2 方法
1.2.1 DF1细胞的培养与NDV感染 DF1细胞培养于含10%胎牛血清的DMEM培养基中,于37 ℃、5% CO2培养箱中培养。将生长状态良好的DF1细胞,以每孔1×105个细胞数接种于24孔板内,37 ℃、5% CO2条件下培养,待细胞长成单层后进行NDV感染试验。NDV感染试验分为2组,即NDV感染组和空白组。用PBS清洗细胞2遍,按5 MOI·孔-1将NDV感染DF1细胞,置于细胞培养箱中1 h后更换为含2% FBS的DMEM培养基维持培养至48 h,收集细胞样品,4 000 r·min-1离心10 min,再收集上清备用。
1.2.2 鸡TGF-β1基因重组过表达载体的构建 本研究通过GenBank鸡TGF-β1(NM-001318456.1)序列和载体pDC316-mCMV-ZsGreen多克隆位点,设计、合成两端分别含有限制性酶切位点NheI和Hind III的鸡TGF-β1片段,并将合成片段克隆入pUC57载体构建克隆载体pUC57-chickenTGF-β1,然后用NheI和Hind III双酶切pUC57-chickenTGF-β1,回收大小约1 200 bp的鸡TGF-β1条带,将其与经NheI+Hind III酶切pDC316-mCMV-ZsGreen质粒后回收的大片段连接,转化感受态细胞DH5α,涂布于含氨苄(Amp+)抗性的LB固体平板上,置于37 ℃恒温培养箱12~16 h。挑取阳性单菌落接种于含Amp+抗性的LB培养液中,37 ℃恒温摇床培养过夜,提取质粒进行双酶切鉴定,并将酶切正确的质粒送往生工生物工程(上海)股份有限公司进行序列测定。
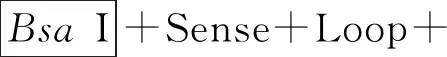
1.2.4 鸡TGF-β1重组表达载体转染DF1细胞 按照“1.2.1”步骤培养和处理细胞,然后进行转染试验。共分成3组,即空白组、鸡TGF-β1重组过表达质粒(pDC316-mCMV-ZsGreen-chickenTGF-β1)组和重组干扰表达(pG1.2-chickenTGF-β1)组,每组3个重复。具体方法如下:于转染前2 h将细胞培养液换成无血清的DMEM培养基。用100 μL的opti-MEM培养基稀释质粒,室温静置5 min,以质粒∶Lipofectamine2000转染试剂=1 μg∶2 μL的比例配制opti-MEM培养基-脂质体复合物100 μL,混匀后室温静置5 min。将两液混合均匀静置20 min后加入DF1细胞内轻轻混匀。6 h后换入正常培养基培养48 h后,收集各组细胞和培养液,4 000 r·min-1离心10 min,分别收集上清和细胞沉淀备用。
1.2.5 鸡TGF-β1 mRNA表达量检测 以TRIzol法提取转染后48 h的各组细胞总RNA,用逆转录试剂盒将其反转录成cDNA,以SYBR Green Master Mix进行实时荧光定量PCR,以GAPDH为内参,2-ΔΔCt法计算各组TGF-β1 mRNA相对表达量。
1.2.6 鸡TGF-β1胞外蛋白的表达量检测 采用鸡TGF-β1 ELISA试剂盒检测NDV感染和鸡TGF-β1重组表达质粒转染后48 h收集的各组细胞培养上清中鸡TGF-β1胞外蛋白的表达量。按照试剂盒说明书进行试验操作,然后在酶标仪上读取吸光度(OD值)。以标准品浓度为纵坐标,对应的吸光度(OD值)为横坐标,利用计算机Excel表格软件,采用四参数Logistic曲线拟合(4-pl),创建标准曲线方程,通过样本的吸光度(OD值),利用方程计算样品的浓度值。
1.2.7 细菌对DF1细胞的黏附检测 按照“1.2.1”步骤培养和处理细胞,按照“1.2.4”步骤进行质粒转染,质粒转染细胞后48 h,在倒置荧光显微镜下观察,并用内参GAPDH对DF1细胞进行定量,确定各组细胞在数量上无显着差异,然后进行细菌黏附试验。取处于对数生长期致病性大肠杆菌和鸡白痢沙门菌3 000 r·min-1离心5 min,弃去上清,收集细菌,加入一定量无菌PBS重悬,按照MOI=100∶1(细菌∶细胞)的比值将菌液加入到细胞中,1 000 r·min-1离心5 min后置于CO2培养箱孵育2 h。孵育2 h后收集上清,并用无菌PBS清洗孔板中的细胞3次,收集清洗液,将上清和清洗液混合离心,用1 mL的无菌PBS重悬收集未黏附的细菌至无菌EP管中。加入1 mL的无菌PBS,用细胞刮将细胞重悬,收集黏附的细菌至无菌EP管中。将未黏附的细菌和黏附的细菌重悬液分别振荡混匀,连续10倍倍比稀释后,涂布于LB固体琼脂平板上,采用平板菌落计数法对细菌计数;将回收的两菌16S rDNA扩增基因产物作为标准品,根据两菌的16S rDNA序列设计特异性引物,将两菌标准品梯度稀释后取相当于1×108、1×107、1×106、1×105、1×104CFU·mL-1细菌的DNA样品作为标准模板,用荧光实时定量PCR法制作标准曲线,对黏附和未黏附的大肠杆菌和鸡白痢沙门菌进行定量。试验重复3次,计算细菌对细胞的黏附率。
2 结 果
2.1 NDV感染对DF1细胞鸡TGF-β1表达的影响
NDV感染DF1细胞后48 h用鸡TGF-β1 ELISA试剂盒检测各组细胞TGF-β1胞外蛋白表达量。结果显示,与空白组相比,NDV感染组DF1细胞鸡TGF-β1胞外蛋白表达量显着升高(P<0.05,图1)。
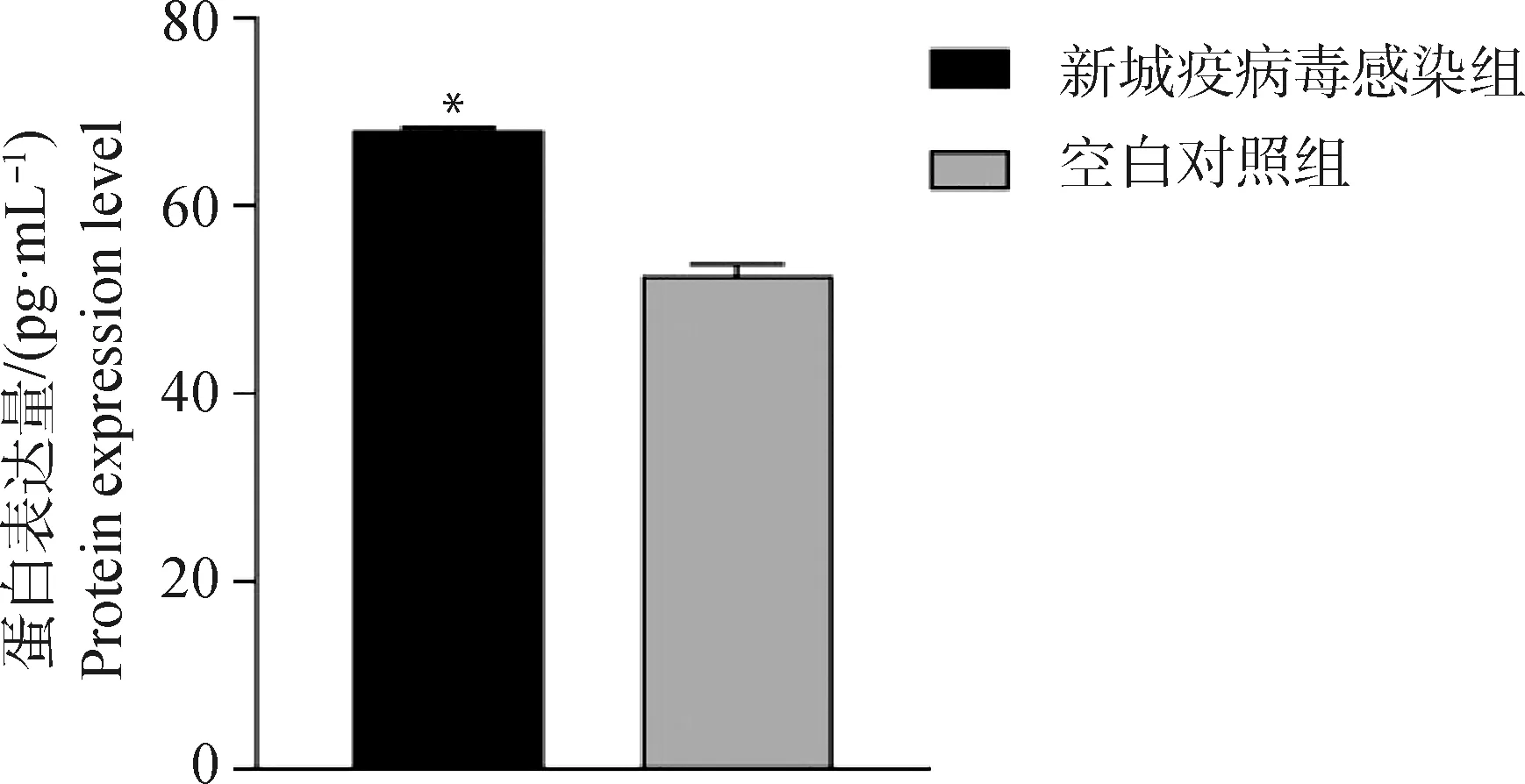
*. 表示差异显着(P<0.05),下同
2.2 鸡TGF-β1重组过表达载体的鉴定
构建的重组过表达质粒pDC316-mCMV-ZsGreen-chickenTGF-β1经NheI+Hind III双酶切后出现大小分别为5 800和1 200 bp两条带(图2)。阳性质粒测序结果显示,插入片段长度为1 197 bp,序列比对结果与鸡TGF-β1序列完全匹配。结果表明,目的片段以正确方向插入表达载体pDC316-mCMV-ZsGreen中,成功构建了表达载体pDC316-mCMV-ZsGreen-chickenTGF-β1。
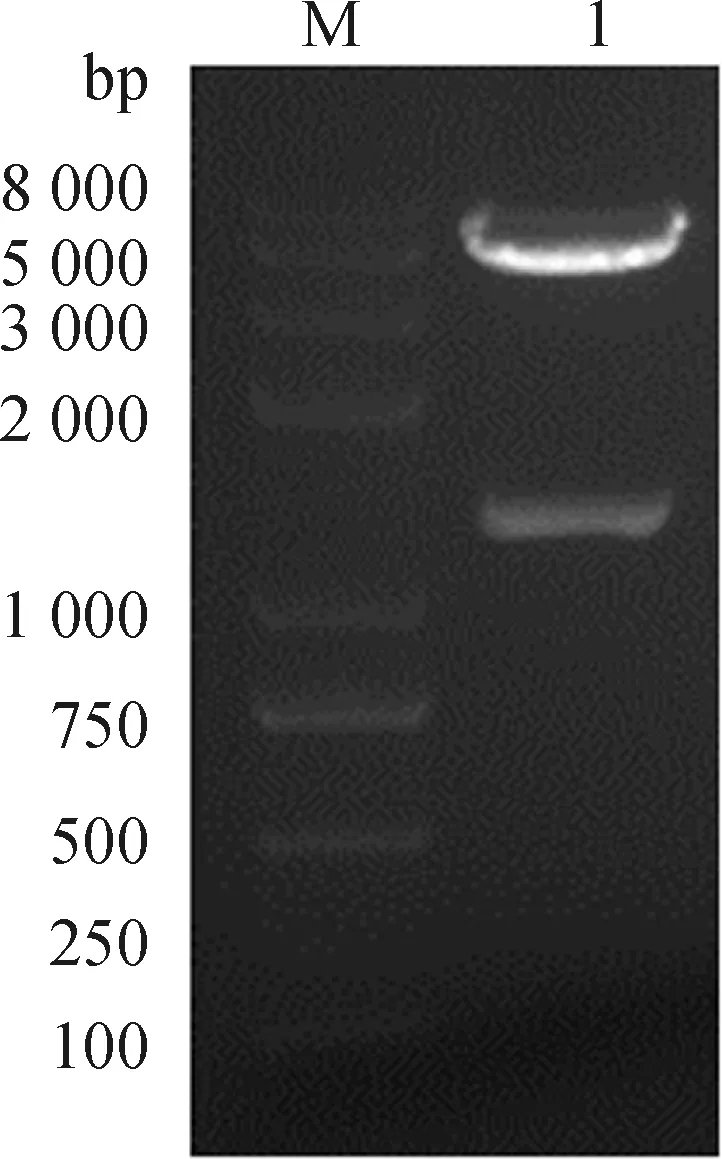
M. Trans2K plus marker; 1. pDC316-mCMV-ZsGreen-chicken TGF-β1双酶切产物
2.3 鸡TGF-β1重组干扰表达载体的鉴定
根据pG1.2载体序列,在设计鸡TGF-β1干扰表达片段时引入一个SacⅠ的酶切位点,因pG1.2载体本身有一个SacⅠ的酶切位点,因此,提取的阳性重组质粒能被SacⅠ酶切出一条约600 bp条带时,表明退火片段成功连接到pG1.2载体里。电泳结果显示,挑取的阳性重组质粒经SacⅠ酶切后,可获得一条大小约600 bp的片段(图3),且序列比对结果与插入序列完全匹配。结果表明,目的片段以正确方向插入载体PG1.2,成功构建了干扰表达载体pG1.2-chickenTGF-β1。
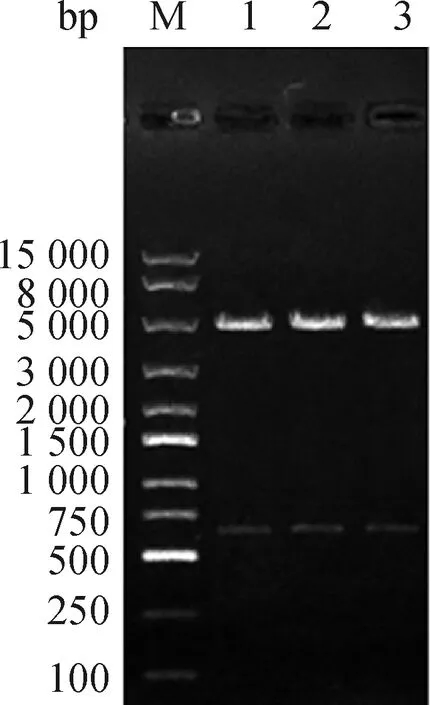
M.DL15000 marker; 1、2、3. pG1.2-chicken TGF-β1双酶切产物
2.4 转染重组表达质粒对DF1细胞的鸡TGF-β1表达的影响
将重组过表达载体pDC316-mCMV-ZsGreen-chickenTGF-β1和干扰表达载体pG1.2-TGF-β1 shRNA转染DF1细胞后48 h,在倒置荧光显微镜下可以观察到荧光信号(图4),分别用荧光定量PCR和鸡TGF-β1 ELISA试剂盒检测各组细胞TGF-β1 mRNA表达量和胞外蛋白表达量。结果显示,与空白组相比,pG1.2-TGF-β1 shRNA组细胞TGF-β1 mRNA表达量显着下降(P<0.01),而pDC316-mCMV-ZsGreen-chickenTGF-β1组细胞TGF-β1 mRNA表达量显着升高(P<0.01);pG1.2-TGF-β1 shRNA组细胞TGF-β1胞外蛋白表达量显着下降(P<0.01),而pDC316-mCMV-ZsGreen-chickenTGF-β1组细胞TGF-β1胞外蛋白表达量显着升高(P<0.01,图5)。
A. pDC316-mCMV-ZsGreen-chicken TGF-β1转染的DF1细胞;B. pG1.2-TGF-β1 shRNA转染的DF1细胞;C. 未转染的DF1细胞对照
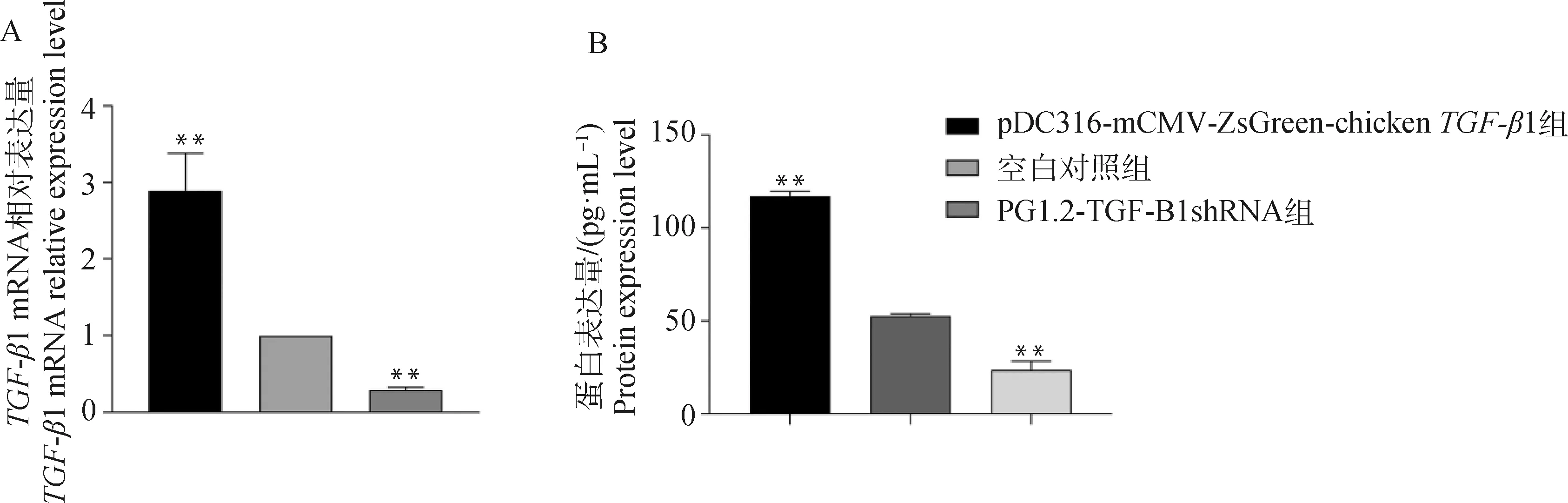
A. DF1细胞TGF-β1 mRNA的相对表达量;B. DF1细胞TGF-β1胞外蛋白的表达量。**. 表示差异显着(P<0.01),下同
2.5 鸡TGF-β1的表达对致病性大肠杆菌和鸡白痢沙门菌黏附DF1细胞的影响
用鸡TGF-β1重组表达载体转染DF1细胞后48 h对各组细胞进行定量,与空白对照组细胞相比,pDC316-mCMV-ZsGreen-chickenTGF-β1转染组和pG1.2-TGF-β1 shRNA-1转染组细胞在细胞数量上无差异(P>0.05,图6)。涂板计数法和定量分析法计算致病性大肠杆菌和鸡白痢沙门菌对DF1细胞的黏附率,检测结果显示,与空白组相比,致病性大肠杆菌和鸡白痢沙门菌对pDC316-mCMV-ZsGreen-chickenTGF-β1转染组DF1细胞的黏附率显着增高(P<0.01),对pG1.2-TGF-β1 shRNA-1转染组DF1细胞的黏附率显着降低(P<0.01,图7)。

图6 鸡TGF-β1重组质粒转染DF1细胞后48 h细胞数量分析
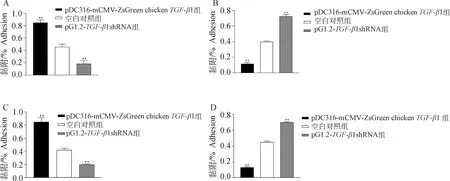
A.致病性大肠杆菌对DF1细胞的黏附;B.未黏附的致病性大肠杆菌;C.鸡白痢沙门菌对DF1细胞的黏附;D.未黏附的鸡白痢沙门菌
3 讨 论
随着畜牧业的快速发展,家禽的养殖产业也在不断进步,且已经获得了较为明显的经济效益。在养殖过程中,家禽疾病是影响家禽饲养场经济效益的主要原因,同时给基层兽医的工作带来了一定的挑战[14-15]。有研究表明,威胁家禽养殖行业的疾病有80余种,其中传染性疾病占比最大,约为75%,传染性疾病对养禽业之所以危害大,是因为其通常并发或继发于其它疾病,导致病情复杂,且治疗困难[16-17]。临床混合感染是当前禽病流行的主要趋势,一些鸡场经常发生以新城疫为主,混合感染大肠杆菌病和鸡白痢沙门菌等细菌性疾病,而且混合感染的病例越来越多,出现病毒+细菌或细菌+细菌的传染病,成为养禽业一大隐患[18-21]。近年来,随着疫苗的使用和环境的改变,混合感染的比例逐渐升高,对养殖业造成的损失逐渐攀升。因此,探究混合感染发生发展的机制能为临床混合感染提供有效的帮助。新城疫病毒感染机体,侵害机体免疫系统,使禽对细菌性疾病的易感性提高;或相互作用,让各自的致病力增强,给临床防控和治疗造成很大的阻力,这可能是引发目前我国部分地区鸡群多种疾病暴发,使养禽业的疫病更加复杂和严重的主要原因之一。探索新城疫和细菌性疾病混合感染的机制,对临床混合感染的防治具有重要意义。在本研究中,通过检测NDV感染DF1细胞后鸡TGF-β1胞外蛋白量,发现与未感染组相比,NDV感染组DF1细胞的TGF-β1胞外蛋白表达量显着增加,表明NDV感染可导致鸡TGF-β1胞外蛋白表达量显着增高,这为进一步探索鸡TGF-β1表达量的变化对细菌疾病发生的影响奠定了基础。
RNA干扰技术可介导细胞内序列特异的靶基因表达沉默,产生相应的功能表型缺失的现象[22-23],为研究鸡TGF-β1的功能以及在临床禽病中的调控机制,本研究结合RNA干扰技术和基因重组技术,以鸡TGF-β1为靶目标,分别成功构建了pG1.2-TGF-β1 shRNA干扰表达质粒和pDC316-mCMV-ZsGreen-chickenTGF-β1过表达质粒,为进一步实现调控DF1细胞中鸡TGF-β1表达奠定了基础。将构建成功的重组表达载体质粒转染DF1细胞,48 h后检测细胞TGF-β1 mRNA和TGF-β1胞外蛋白的表达量变化。结果显示,与未转染DF1细胞对照组相比,pG1.2-TGF-β1 shRNA干扰表达质粒转染细胞后均显着下调DF1细胞的TGF-β1 mRNA的表达量和TGF-β1胞外蛋白表达量;pDC316-mCMV-ZsGreen-chickenTGF-β1过表达质粒转染细胞后均显着上调DF1细胞的TGF-β1 mRNA的表达量和TGF-β1胞外蛋白表达量。这为进一步研究鸡TGF-β1对致病菌黏附细胞的影响提供了模型,也为后续进一步探索TGF-β1及其调控的关键分子在临床禽病中的作用奠定基础。
在通过将鸡TGF-β1重组过表达和干扰表达载体质粒转染DF1细胞调节TGF-β1表达量的基础上,检测鸡TGF-β1的表达对致病性大肠杆菌和鸡白痢沙门菌黏附DF1细胞的影响,本试验采用涂板计数法和定量分析法验证细菌对细胞的黏附,结果显示,与空白对照组DF1细胞相比,大肠杆菌和鸡白痢沙门菌对过表达质粒pDC316-mCMV-ZsGreen-chickenTGF-β1组DF1细胞的黏附率显着增高,对干扰表达质粒pG1.2-TGF-β1 shRNA组DF1细胞的黏附率显着减少,表明本研究构建的干扰表达质粒pG1.2-TGF-β1 shRNA和过表达质粒pDC316-mCMV-ZsGreen-chickenTGF-β1转染DF1细胞,对DF1细胞TGF-β1胞外蛋白的表达量有显着的调控作用,从而有效影响大肠杆菌和鸡白痢沙门菌对DF1细胞的黏附作用,这与马丽莉[24]研究结果一致。这说明鸡TGF-β1可增加致病性大肠杆菌和鸡白痢沙门菌对DF1细胞的黏附,NDV感染后鸡TGF-β1表达的变化可能是病毒感染后并发或继发细菌性疾病的原因之一,这为TGF-β1在临床禽病防控中的应用提供了参考。鸡TGF-β1在多种禽病的发生发展中都扮演着重要角色,这也预示着鸡TGF-β1可能在多种禽病的混合感染中发挥着重要作用。鸡TGF-β1在禽病混合感染中的作用机制也将成为下一步研究的重点,本研究也为继续探究鸡TGF-β1在禽病混合感染中的作用机制提供支持。
4 结 论
本研究以临床常见的新城疫病毒、致病性大肠杆菌和鸡白痢沙门菌作为研究对象,初步证明NDV感染DF1细胞后,鸡TGF-β1的表达量增加,鸡TGF-β1可促进致病性大肠杆菌和鸡白痢沙门菌黏附DF1细胞,初步确定了鸡TGF-β1在新城疫、大肠杆菌和鸡白痢沙门菌混合感染中的作用,为研究鸡TGF-β1在病毒+细菌感染中的作用及机制提供重要的参考。



