李亚军,茹 毅,郝荣增,蒋成辉,王 伟,张 越,张贵才,刘华南,卢炳州,杨 洋,陶世宇,杨 锐,宋向东,陈 娇,余四九,郑海学*
(1.甘肃农业大学动物医学院,兰州 730070; 2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室/国家口蹄疫参考实验室,兰州 730046)
牛病毒性腹泻(bovine viral diarrhea, BVD)是由牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)引起的以腹泻、繁殖障碍、免疫机能障碍等为主要特征的一种急性、热性、高度接触性传染病[1],该病发病率高,死亡率低[2],防治的难点在于BVDV进入机体后可造成免疫抑制和持续性感染,降低机体免疫力,易诱发其他病原的混合感染或继发感染,是全球最重要的牛传染病之一[3]。该病在我国20多个省、市及自治区广泛流行且呈扩大趋势[4],导致我国的BVDV防控和净化状况不容乐观。
BVDV属于黄病毒科(Flaviviridea)瘟病毒属(Pestivirus),基因组由一个长度约12.3 kb的单链正义RNA分子组成[5]。BVDV有3种生物型,通常基于5′-UTR序列、基因组氨基端自身蛋白酶(Npro)或包膜糖蛋白(E2)区域分为BVDV-1型和BVDV-2型[6],第3种遗传物种BVDV-3型被描述为非典型的BVDV。目前,中国主要流行8个亚型:1a、1b、1c、1d、1m、1o、1p和1q[7]。BVDV基因组含有4个结构蛋白,分别是P14(C)、gP48(E0)、gP25(E1)、gP53(E2),其他的均为非结构蛋白[5,8]。其中,E0、E1、E2组成了病毒的囊膜结构,位于病毒的表面,而E2蛋白位于病毒的外表面,也是构成病毒的主要免疫保护性抗原,可诱导机体产生保护性的中和抗体[9]。动物机体在感染BVDV或者接种灭活疫苗后,体内主要产生针对结构蛋白E2的抗体[10],对于病原的检测应用,由E2蛋白产生的多克隆抗体可以快速检测BVDV的变异[11]。E2蛋白包括1个疏水序列和5个糖基化位点[12],但由于E2蛋白的基因突变率高,不同的毒株之间的免疫原性不同,容易导致疫苗免疫失败[13]。
有报道显示,E2蛋白在细胞周期的维持中扮演着重要角色,它主要参与病毒和宿主的吸附、识别以及结合过程,还参与病毒的免疫逃逸[14]。吴桐忠等[15]构建了表达E2蛋白的重组乳酸菌,结果表明,口服表达BVDV E2蛋白的重组乳酸菌可诱导机体产生特异性的体液免疫反应;何金科等[16]完成了E2蛋白多表位疫苗的筛选以及生物信息学验证等,为多表位疫苗的设计提供了一种新的方法;张忠辉等[17]利用原核表达系统表达制备E2蛋白,并免疫新西兰大白兔制备了多克隆抗体;吴立君等[18]利用昆虫表达系统表达E2蛋白,为诊断试剂盒的研制和亚单位疫苗的制备奠定了基础。以上研究表明,BVDV E2蛋白已成为BVD基因工程疫苗和诊断试剂开发研制的重要靶标蛋白,而利用不同表达系统制备的E2蛋白免疫动物后,可诱导机体产生不同程度的细胞免疫或体液免疫应答,因此,E2蛋白成为BVDV DNA疫苗和亚单位疫苗开发的首选抗原蛋白[19]。
目前,控制BVDV的传播主要有两种方法:消灭持续感染动物和疫苗接种。改良活疫苗或灭活疫苗主要用于BVDV疫苗接种计划,但这些疫苗分别存在安全风险或免疫保护不足等问题[20]。灭活疫苗对怀孕牛安全,但其免疫期短;而弱毒疫苗虽免疫期长,但对怀孕牛存在安全风险[21]。基于以上科学问题,本研究以研制BVD亚单位疫苗为目标,成功利用哺乳动物细胞表达系统制备了BVDV结构蛋白E2,实现了该蛋白在哺乳动物表达系统CHO细胞中高水平瞬时表达,通过免疫动物评价其免疫原性,为BVDV的基因工程亚单位疫苗的研发奠定良好的基础。
1 材料与方法
1.1 主要材料与试剂
1.1.1 实验动物 新西兰大白兔由中国农业科学院兰州兽医研究所实验动物中心提供。
1.1.2 主要试剂和仪器 BVDV-1 NADL疫苗标准株(BVDV-1型毒株,购自中国兽医药品监察所-中国兽医微生物菌种保藏管理中心)、真核表达载体pcDNA3.1(+)、BVDV阳性血清由本实验室保存。ExpiCHO悬浮细胞表达系统、亲和层析Ni柱购自GE公司。XhoⅠ和HindⅢ限制性内切酶购自New England Biolabs(NEB)公司。
主要仪器:PCR扩增仪(Thermo)、台式超速冷冻离心机(Thermo)、紫外凝胶成像仪(GE)、纯化仪(AKTA PURE 150)、激光共聚焦显微镜(莱卡公司)。
1.2 蛋白生物信息学分析和表达设计
利用SignalP 4.1 Server和TMHMM Server v.2.0网站软件分析BVDV结构蛋白E2信号肽及跨膜区域。根据分析结果,设计E2蛋白的重组真核表达质粒。
1.3 重组表达质粒的构建与鉴定
参考BVDV-1 NADL疫苗标准株基因序列,设计扩增目的基因引物(如表1所示),利用病毒RNA提取试剂盒常规提取RNA,以提取的RNA为模板,利用一步法RT-PCR扩增试剂盒扩增E2蛋白的基因片段,扩增程序:50 ℃ 30 min;94 ℃ 2 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ (1 min·kb-1),30个循环;72 ℃ 5 min。PCR扩增产物利用1%琼脂糖凝胶电泳鉴定,纯化回收DNA。pcDNA3.1载体和回收的基因片段用限制性内切酶XhoⅠ和HindⅢ双酶切,切胶回收纯化,使用T4 DNA连接酶连接,程序为16 ℃ 12 h,连接产物转化DH5α感受态细胞,挑取单菌落增菌培养,利用质粒提取试剂盒提取重组质粒,重组质粒命名为pcDNA3.1-BVDV-E2。
用XhoⅠ和HindⅢ对重组质粒进行双酶切鉴定,鉴定正确的重组质粒均送生物公司进行测序鉴定,确定目的基因序列的正确插入,确保阅读框完全正确。

表1 引物信息
1.4 蛋白的表达与纯化
参照ExpiCHO表达系统试剂盒说明书方法,将重组质粒pcDNA3.1-BVDV-E2转染ExpiCHO悬浮细胞,转染的细胞置32 ℃、5% CO2、湿度90%条件下继续悬浮培养12 d,然后4 000g离心10 min,经0.22 μm滤膜过滤后进行亲和层析Ni柱纯化。取纯化后的目标蛋白质进行SDS-PAGE鉴定,并使用BCA蛋白定量试剂盒测定蛋白质浓度。
1.5 蛋白印迹试验
将纯化后的蛋白经质量分数为12% SDS-PAGE电泳分离,通过半干式电转膜法将蛋白抗原转至硝酸纤维素薄膜上,分别使用抗小鼠His Tag单克隆抗体、BVDV阳性血清或BVDV-E2免疫血清为一抗,HRP标记的山羊抗小鼠和山羊抗兔IgG为二抗,对纯化的BVDV-E2蛋白或BVDV感染细胞内的病毒蛋白进行Western blot分析,用ECL化学发光显色后,高分辨率凝胶成像系统观察并拍照。
1.6 免疫荧光(IFA)试验
按照试验要求设置对照组和试验组;在激光共聚焦细胞培养皿中培养MDBK细胞,接种病毒感染后48 h将细胞用PBS进行洗涤;用4%多聚甲醛室温固定10 min,PBS洗涤3次,每次5 min,分别加入1 mL用一抗稀释液按1∶100稀释的免疫血清,4 ℃,孵育12 h;1×PBS洗涤3次,每次5 min,分别加入500 μL用1×PBS按1∶1 000稀释的488标记的山羊抗兔IgG,37 ℃孵育1 h;1×PBS洗涤3次,每次5 min,用激光共聚焦荧光显微镜观察细胞内荧光并拍照分析。
1.7 动物免疫与抗体检测
选取健康新西兰大白兔6只,分为2组,每组3只,A组免疫纯化的E2蛋白,B组为PBS对照组,首次免疫用300 μg·只-1的纯化蛋白和等体积的弗式完全佐剂乳化,背部多点注射免疫兔;首次免疫第14天,按照300 μg·只-1的纯化蛋白和等体积的弗式不完全佐剂乳化,背部多点注射进行二免,分别采集首免后第0、7、14、21、28天取全血,分离血清用于抗体检测。
采用间接ELISA对E2蛋白免疫兔血清进行检测,分析其免疫原性。用50 mmol·L-1碳酸盐缓冲液将纯化的BVDV-E2蛋白(50 ng·孔-1)包被于ELISA酶标板中,4 ℃孵育过夜。用1%牛血清白蛋白(BSA)37 ℃,封闭2 h。将待检血清用血清稀释液按1∶2 000稀释并加入反应孔中,100 μL·孔-1,每个样品设3个复孔,37 ℃孵育1 h。HRP标记的山羊抗兔IgG抗体用血清稀释液按1∶5 000稀释后加入反应孔中,100 μL·孔-1,37 ℃孵育1 h。TMB显色,每孔50 μL,显色10 min后,加入50 μL终止液终止反应,读取OD450 nm值。
2 结 果
2.1 E2蛋白分析与表达设计
软件分析结果显示,SignalP 4.1 Serve软件分析显示E2蛋白不存在信号肽(图1A);TMHMM Server v.2.0软件分析显示E2蛋白有一个跨膜区(第344—366位氨基酸)(图1B)。本研究根据分析结果,删除E2蛋白跨膜区,在目标蛋白氨基端插入信号肽序列、羧基端为His-Tag,依次串联组成蛋白表达阅读框(图1C)。
2.2 E2重组表达质粒的鉴定
RT-PCR扩增结果经核酸凝胶电泳鉴定显示,基因扩增片段大小约为1 330 bp,与预期的目的条带大小相符(图2A)。构建的重组表达质粒pcDNA3.1-BVDV-E2经XhoⅠ和HindⅢ双酶切后产生大小约5 109和1 358 bp的2条特异性条带,酶切产物大小与理论值相符,表明扩增的E2片段正确与载体连接,而基因测序结果也显示目的片段成功插入表达载体中(图2B)。
2.3 E2蛋白的表达与纯化
转染pcDNA3.1-BVDV-E2质粒的细胞培养上清在56 ku左右(图中箭头所示)位置处观察到特异性蛋白条带,蛋白大小与理论值相符(图3A)。对BVDV-E2蛋白进行纯化,洗脱样品在56 ku左右位置处观察到特异性蛋白条带,BCA蛋白定量试剂盒测定纯化后E2蛋白的质量浓度为1.228 mg·mL-1(图3B)。
2.4 重组蛋白的鉴定
纯化后BVDV-E2蛋白能够与His-Tag标签抗体(图4A)和BVDV阳性血清(图4B)发生反应,都约在56 ku位置处显示一条特异性条带。
将BVDV感染MDBK细胞24 h,利用BVDV-E2免疫兔血清检测细胞内的病毒蛋白表达,结果显示约在56 ku位置处显示一条特异性蛋白条带(图4C),表明该E2蛋白免疫血清可以特异性地与BVDV感染细胞内的E2蛋白反应。
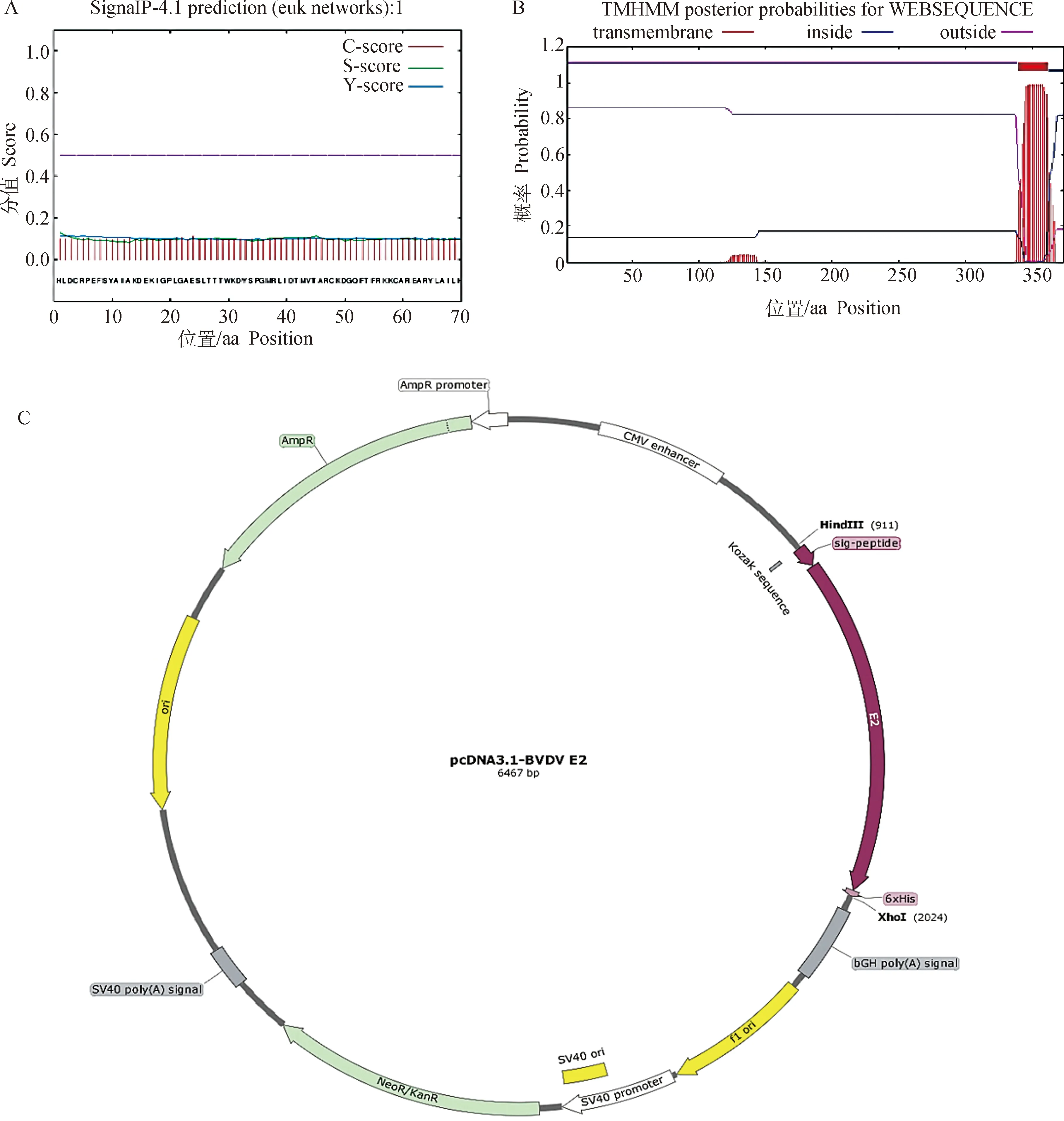
A.E2蛋白信号肽分析结果;B.E2蛋白跨膜区分析结果;C.BVDV-E2蛋白表达质粒示意图A. Result of E2 protein signal peptide sequence analysis; B. Result of E2 protein transmembrane region analysis; C. Diagram of expression plasmid of BVDV-E2 protein图1 BVDV-E2蛋白分析与表达设计Fig.1 Analysis and expression design of BVDV-E2
2.5 细胞免疫荧光(IFA)试验
IFA鉴定结果显示(图5),BVDV感染MDBK细胞后,免疫血清可以特异性检测到细胞内的病毒蛋白表达,而对照组未检测到荧光;结果表明,本研究制备的E2蛋白免疫血清具有良好的免疫反应性和特异性。
2.6 血清抗体水平
间接ELISA结果显示(图6),免疫后7 d,即可检测到针对E2蛋白的血清抗体,二免7 d后抗体水平显着升高,在免疫后28 d抗体保持较高水平且血清效价可达1∶1 024 000。结果证明了CHO细胞表达的E2蛋白具有良好的免疫原性。
3 讨 论
近年来,关于BVD基因工程疫苗研究在不断地进行,但仍无商品的亚单位疫苗可用[22]。E2蛋白作为BVDV囊膜上的重要结构蛋白,拥有突出囊膜表面的氨基端部分,决定了BVDV的抗原性[23],其免疫原性最好,是亚单位疫苗研究的主要抗原蛋白[24-25]。
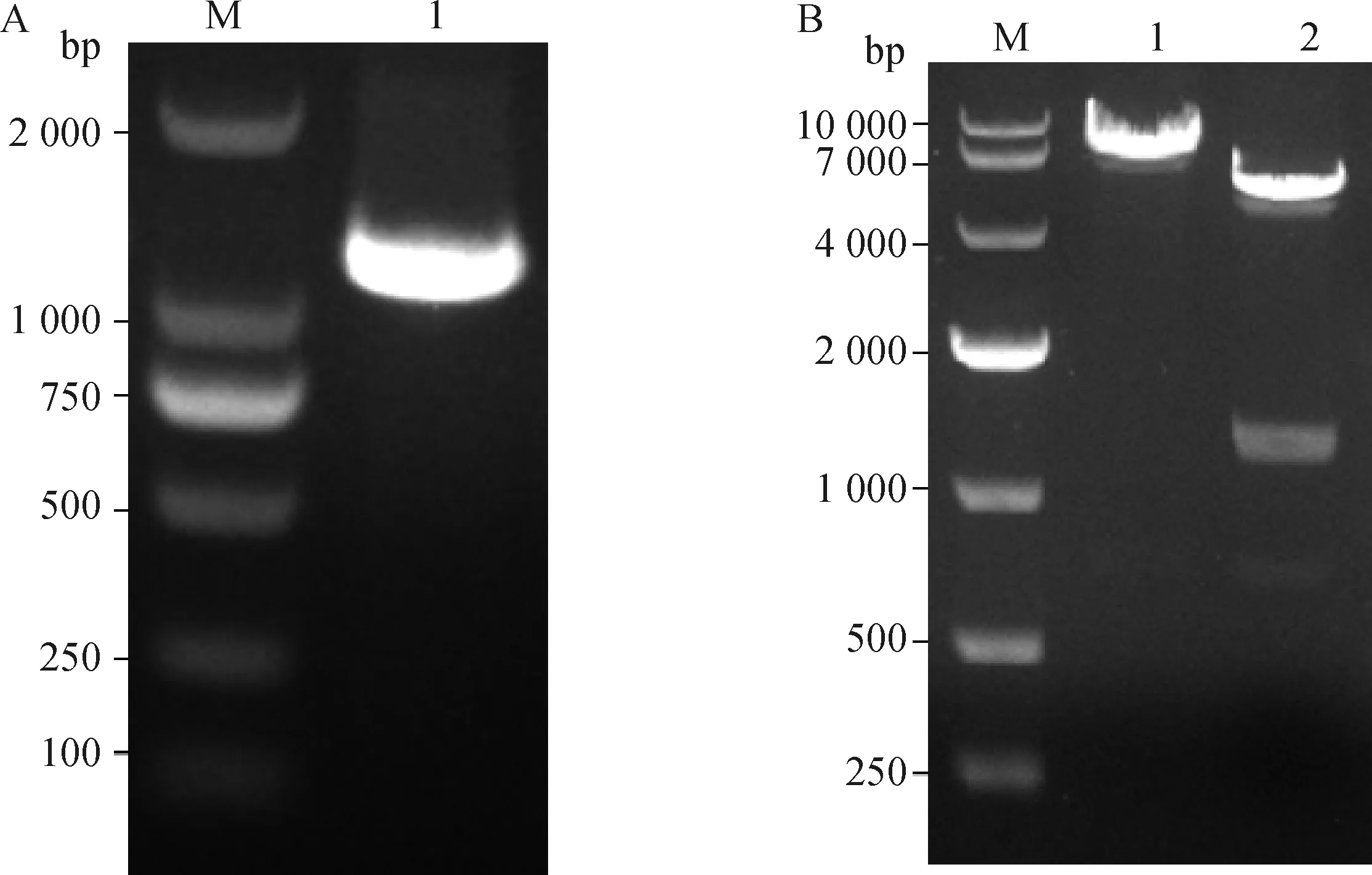
A.RT-PCR扩增基因片段鉴定(M. DL2000 DNA相对分子质量标准;1.E2基因片段);B.重组表达质粒双酶切鉴定(M. DL10000 DNA相对分子质量标准;1.未酶切E2表达质粒;2.E2表达质粒的酶切产物)A. Identification of gene fragments amplified by RT-PCR(M. DL2000 DNA marker; 1. E2 gene fragment); B. Identification of recombinant expression plasmid by double enzyme digestion (M. DL10000 DNA marker; 1. Undigested E2 expression product; 2.Digested E2 expression product)图2 重组表达质粒的鉴定Fig.2 Identification of recombinant expression plasmid
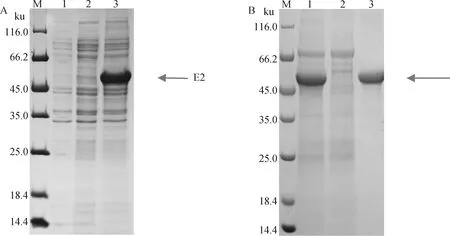
A.E2蛋白表达的SDS-PAGE分析(M.蛋白质分子质量标准;1.空白对照;2.空载体对照;3.转染pcDNA3.1-BVDV-E2);B.纯化后E2蛋白SDS-PAGE分析(M.蛋白质分子质量标准;1.过滤后细胞上清;2.流穿样品;3.洗脱样)A. SDS-PAGE analysis of the expression of E2 protein (M. Protein marker; 1. Blank control; 2. Empty plasmid control; 3. Transfected pcDNA3.1-BVDV-E2); B. SDS-PAGE analysis of E2 protein after purification (M. Protein marker; 1. Cell supernatant after filtration; 2. Flow through sample; 3. Elution sample)图3 重组蛋白的表达与纯化Fig.3 Expression and purification of recombinant protein
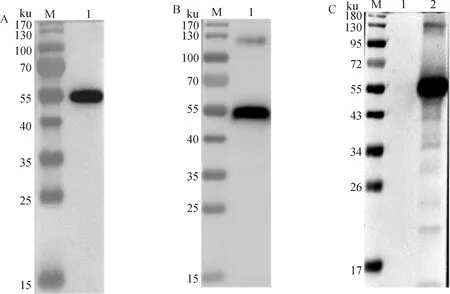
A.一抗为His-Tag单克隆抗体(M.预染的蛋白质分子质量标准;1.BVDV-E2);B.一抗为BVDV多克隆抗体(M.预染的蛋白质分子质量标准;1.BVDV-E2);C.E2蛋白免疫血清检测BVDV感染MDBK细胞的免疫印迹分析(M.预染的蛋白质分子质量标准;1.未感染细胞对照;2.BVDV感染MDBK细胞)A. Western blot identification with His Tag monoclonal antibody (M. Protein marker; 1. BVDV-E2); B. Western blot identification with BVDV polyclonal antibody (M. Protein marker; 1. BVDV-E2); C. Analysis of E2 protein expression in MDBK cells after BVDV infection by Western blot (M. Protein marker; 1. Uninfected cell control; 2. BVDV infected MDBK cells )图4 纯化后E2蛋白的免疫印迹分析Fig.4 Analysis of E2 protein after purification by Western blot
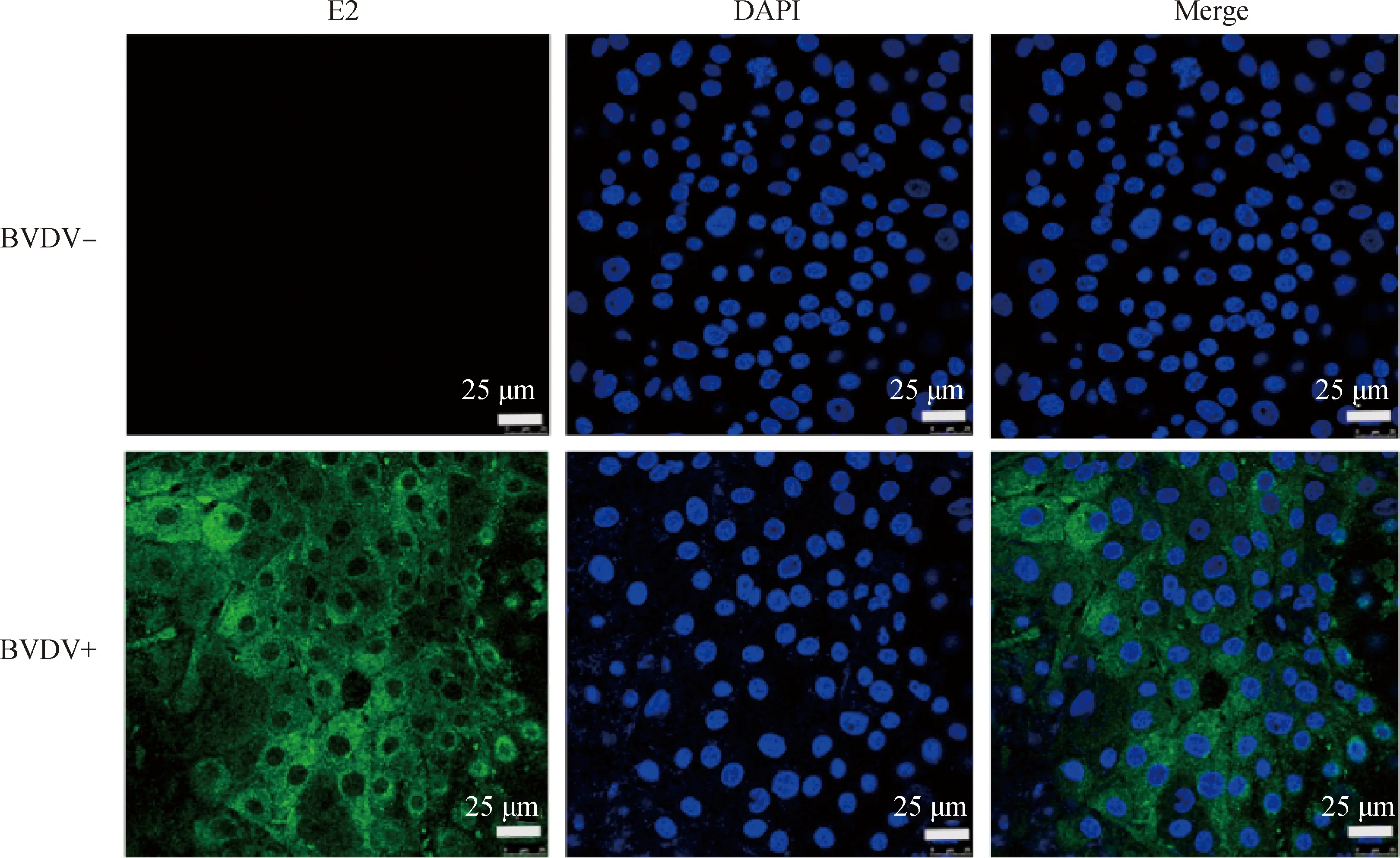
图5 IFA鉴定结果Fig.5 Identification of immunized serum by IFA
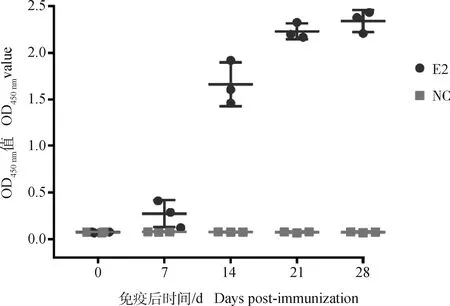
NC. PBS免疫组;E2. BVDV-E2蛋白免疫组NC. The group of immunized by PBS; E2. The group of immunized by purified E2 protein图6 间接ELISA分析血清抗体Fig.6 Analysis of serum antibodies by indirect ELISA
目前,在国内关于BVDV E2蛋白表达的相关研究中,大多数采用原核表达系统进行表达[10,17,26],也有报道利用烟草等真核表达系统表达E2蛋白[18,27]。BVDV E2蛋白为囊膜糖蛋白,含有多个糖基化位点,其翻译后修饰较为复杂,利用原核表达系统表达此类抗原蛋白存在一定的难度,且原核表达的产物抗原性一般较弱,并且大多数情况表达产物以不可溶形式存在,蛋白结构和翻译后修饰与真核表达存在较大差异[28]。通过真核表达系统表达的目的蛋白具有天然蛋白的构象和活性,与昆虫细胞杆状病毒表达系统相比,CHO细胞表达系统表达产量相对比较高,很少分泌自身内源性蛋白,利于外源产物的分离纯化;与细菌表达系统相比,CHO细胞表达系统可对蛋白进行翻译后加工,可胞外分泌表达,下游纯化工艺简单;与酵母表达系统相比,CHO细胞表达系统产物的免疫原性等生物活性与天然蛋白更相似,能够有效减少非特异性结合[29]。随着无血清悬浮培养技术、基因工程技术和大规模培养技术的应用和不断发展,CHO细胞表达系统产物表达量得到大幅提升,生产成本不断降低,在兽用产品领域的应用也显现出良好前景[30]。本研究为了获得免疫原性良好的BVDV抗原蛋白,使用CHO悬浮细胞对目标抗原进行分泌表达,并通过亲和层析法进行纯化,通过一步亲和纯化即可获得较高纯度的抗原蛋白,并且蛋白表达量显着高于其他报道水平;为CHO细胞表达系统在兽用生物制品领域的应用提供了新的范例。
4 结 论
本研究首次成功利用CHO细胞表达细胞制备了BVDV E2蛋白,鉴定结果显示,E2蛋白与BVDV阳性血清和His标签抗体有良好的反应性,同时免疫结果显示,制备的E2蛋白可诱导免疫动物产生强烈的体液免疫反应,免疫后第28天抗体水平仍保持较高水平;此外,利用动物免疫血清可特异性检测感染细胞内的病毒蛋白表达。本研究结果为BVD新型亚单位疫苗研制奠定了基础。



