周水莲,白雨曼,谢文婷,黄健佳,邱文粤,庞晓玥,章心婷,唐兆新,苏荣胜*
(1.华南农业大学兽医学院,广州 510642;2.广州医药研究总院有限公司,广州 510642)
糖尿病(diabetes mellitus,DM)是一种慢性代谢性疾病[1],近年来随着生活水平和医疗水平的改善,老龄宠物越来越多,宠物糖尿病的发病率亦呈逐年上升的趋势。眼病、心脏病等是糖尿病最常见的并发症。目前,白内障摘除和人工晶体植入手术是糖尿病性白内障的主要治疗方法,然而,手术可导致许多严重的术后并发症,尤其是老年和高血糖情况下[2]。临床流行病学和基础研究均表明氧化应激在糖尿病发病机制中占有重要地位[3],白内障的形成与脂质过氧化和自由基产生过多有关,从理论上讲,抗氧化剂的应用应成为防治此病,提高机体健康水平的重要途径;迄今为止,尽管人们围绕抗氧化剂进行了长期大量的研究和探索,但尚没有一个单纯的抗氧化剂被临床证实可以用于有效治疗疾病,抗氧化治疗并未获得预期的效果。
N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)是一种常见的小分子抗氧化剂,易进入动物机体进行细胞代谢,在体内可脱去乙酰基生成半胱氨酸,最终合成谷胱甘肽,是机体生理代谢的重要物质[4]。NAC作为一种经典的抗氧化剂,能降低机体细胞的活性氧,减轻机体异常的过氧化反应[5],最终有助于维持细胞正常的生理功能和细胞形态。秦淑兰等[6]探讨了NAC对糖尿病模型小鼠氧化应激的影响,研究结果表明NAC可有效改善糖尿病模型小鼠的氧化应激状态,减轻糖尿病引起的多个脏器的氧化损伤[7]。但NAC在机体眼部疾病,特别是糖尿病引起的白内障中的作用鲜有报道。鉴于此,本试验拟将NAC作用于STZ联合ALX诱导的1型糖尿病模型比格犬,探讨NAC是否参与改善糖尿病犬晶状体的氧化损伤,为NAC的临床应用提供又一理论支持。
1 材料与方法
1.1 实验动物
选用40只健康2~3岁比格犬,雌雄各半,体重9~13 kg,由广州医药研究总院有限公司提供。本批次实验动物已获得实验动物使用许可证(编号:SYXK 粤 2019-0196),所有动物试验程序均经实验动物伦理委员会批准,在试验前已通过华南农业大学动物伦理审查备案。
1.2 主要试剂与仪器
链脲佐菌素购自上海源叶生物科技有限公司;四氧嘧啶、NAC购自美国Sigma公司;精蛋白生物合成人胰岛素注射液,商品名为诺和灵N(中效),购自诺和诺德(中国)制药有限公司。
常规生化复合校准品、生化复合定值质控品均购于深圳迈瑞生物医疗电子股份有限公司;Trizol试剂盒、荧光定量试剂盒(SYBR®Premix Ex TaqTMII)和反转录试剂盒(PrimeScriptTMRT reagent kit with gDNA Eraser)均购自TaKaRa公司;脂质氧化物(MDA)检测试剂盒、谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)检测试剂盒、谷胱甘肽还原酶(GR)检测试剂盒(DTNB法)、谷胱甘肽过氧化物酶检测试剂盒(NADPH法)均购于上海碧云天生物技术有限公司。
1.3 试验设计与动物饲养管理
试验犬造模前先适应性饲养1周,将比格犬随机分为5组,每组8只,分别为对照组(CON组)、糖尿病模型组(DM组)、胰岛素治疗组(INS组)、NAC联合胰岛素治疗组(NAC+INS组)和NAC治疗组(NAC组)。
根据预试验的结果,确定造模所需的链脲佐菌素和四氧嘧啶的剂量。于试验开始当日(第1 天)和第4天,通过静脉注射的方式每组均给予20 mg·kg-1链脲佐菌素和20 mg·kg-1四氧嘧啶。此外,对照组静脉注射相应体积的生理盐水。此后连续两周监测空腹血糖值,并于试验第10天进行胰岛素释放试验,如果连续两周测得血糖空腹血糖浓度≥8.30 mmol·L-1或随机血糖浓度>11.1 mmol·L-1,则可判定为糖尿病[8]。据上述两种试验结果确定已成1型糖尿病模型后,INS组、NAC+INS组在试验第11天开始给予胰岛素,胰岛素用量参照说明书,每天2次,于早上09:00和晚上21:00进食后进行。NAC+INS组和NAC组亦在试验第11天开始,每日早上09:00按30 mg·kg-1的剂量给犬口服NAC。每月记录犬只体重和空腹血糖。
1.4 胰岛素释放试验
在空腹状态下,给每只试验犬按照10 mL·kg-1剂量灌喂10%葡萄糖溶液,使血糖升高刺激胰岛β细胞释放胰岛素,通过ELISA的方法测定空腹及服糖后0.5、1、2、3 h的血浆胰岛素水平。
1.5 样品采集与处理
将试验犬只安乐死后,迅速吸取双眼房水,取200 μL待检测葡萄糖含量,其余分装冻存于-80 ℃冰箱待检。用眼科器械行眼球摘除术,取出完整的眼球,然后迅速切取少量右眼晶状体组织用于分子生物学检测;切取左眼晶状体进行组织病理学分析。
1.6 比格犬晶状体白内障的等级测定
在造模第120天时,使用手持裂隙灯显微镜,检查眼晶状体,评估晶状体的分级状况分别拍摄记录。
晶状体混浊的分级如下:透明正常晶状体(0级);外周囊泡(1级);外周囊泡和皮质混浊(2级);弥漫性中央混浊(3级);和成熟的白内障(4级)[9]。记录每只眼睛等级,每级对应相应的分数。
根据裂隙灯检查结果,并参照晶状体混浊分类系统Ⅲ(LOCSⅢ)和Kador等国际分级标准来确定白内障分期[9],共分为Ⅰ~Ⅴ期。分期标准分别为①白内障Ⅰ期:散瞳后裂隙灯下可见晶状体周边皮质出现小囊泡或细小囊泡群;②白内障Ⅱ期:散在小囊泡群开始从赤道部向前极部蔓延,从而在镜下形成细环状或戒指状混浊;③白内障Ⅲ期:皮质部前极有放射状混浊,呈灰白色,从“Y”形缝蔓延。④白内障Ⅳ期:皮质部的混浊开始融合,有水裂或新月形投影,混浊区眼底细节不可见;⑤白内障Ⅴ期:皮质和晶体核均完全变成灰白混浊,眼底完全被遮蔽,细节不可见。
1.7 病理切片
将犬晶状体组织浸泡于4%的多聚甲醛中固定24 h以上,梯度酒精脱水处理,石蜡包埋,待石蜡凝固后修块,然后进行晶状体组织切片(3~7 μm),之后将置于37 ℃烘片机上平放烘干8~10 h后备用。将烘片机温度调高至55 ℃烤片2 h,37 ℃复温后使用苏木精和伊红(H&E)染色、中性树脂封片,晾干后于显微镜下观察并取图像记录。
1.8 抗氧化能力检测
称取20 mg晶状体组织于EP管中,加入0.2 mL裂解液,混匀2 min后匀浆,12 000g离心10 min,取上清用于后续测定;上清和眼房水用于MDA含量、GSH/GSSG、GSH-Px活性和GR活性的测定。测定过程严格按照说明书进行。
1.9 实时荧光定量PCR技术检测晶状体氧化损伤相关基因转录表达情况
使用Trizol法提取晶状体组织总RNA,并反转录制备cDNA。以β-actin作为内参基因,采用实时荧光定量PCR技术检测晶状体上皮细胞氧化损伤相关基因的转录表达水平,根据NCBI的GenBank中犬β-actin、SOD2和GRmRNA的基因组序列,应用Primer 6.0软件进行引物设计。设计成功后进行合成,引物序列见表1。按SYBR®Premix Ex TaqTMII荧光定量试剂盒说明书进行操作。
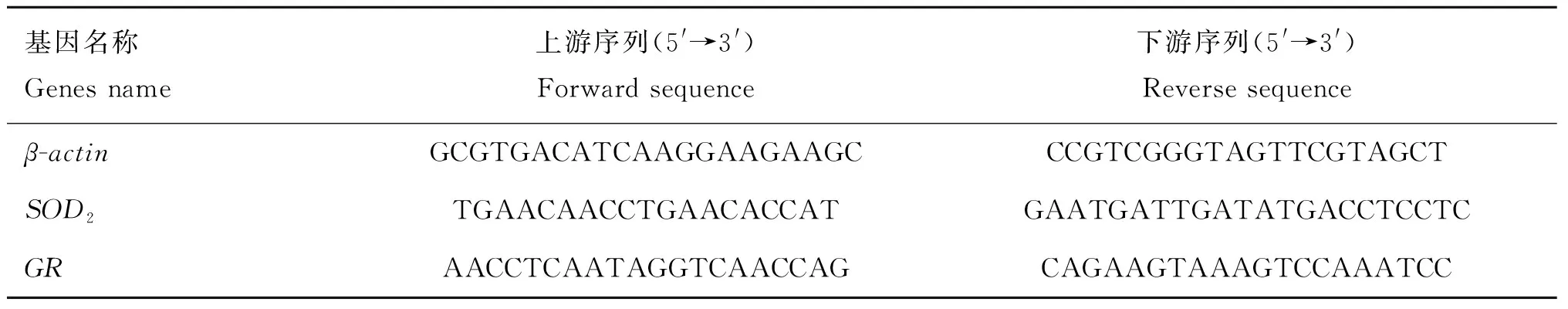
表1 引物序列Table 1 Reference sequences
1.10 数据处理
2 结 果
2.1 胰岛素释放试验和血糖图变化
试验期间空腹血糖曲线如图1A可见,试验15 d内,与CON组血糖一直在正常范围,而DM组连续两周测得血糖空腹血糖浓度≥8.30 mmol·L-1。
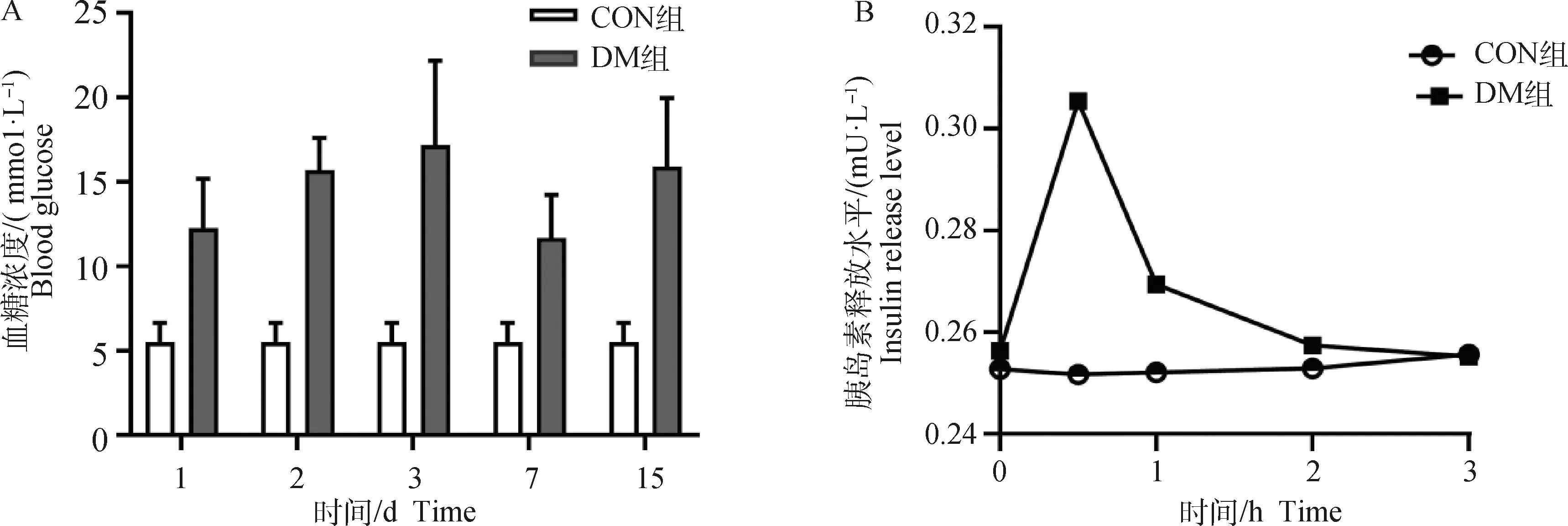
A.血糖;B.胰岛素。CON.对照组;DM.糖尿病模型组A. Blood glucose;B. Plasma insulin. CON. Control group;DM. Diabetes model group图1 血糖和血浆胰岛素含量曲线Fig.1 Blood glucose and plasma insulin content curves
试验犬血浆胰岛素含量变化见图1B,可见CON组犬血浆胰岛素水平在服糖后0.5 h达高峰,随后2 h内回降至空腹水平;而DM组犬血浆胰岛素曲线一直呈低平,无明显高峰状态。
2.2 NAC对1型糖尿病模型犬房水及血液中糖含量的影响
如图2A所示,与CON组对比,DM组房水中葡萄糖含量有大幅升高,差异显着(P<0.05);与DM组对比,NAC+INS组房水中葡萄糖含量呈显着降低(P<0.05),而INS组和NAC组房水中葡萄糖含量仅有轻微降低。
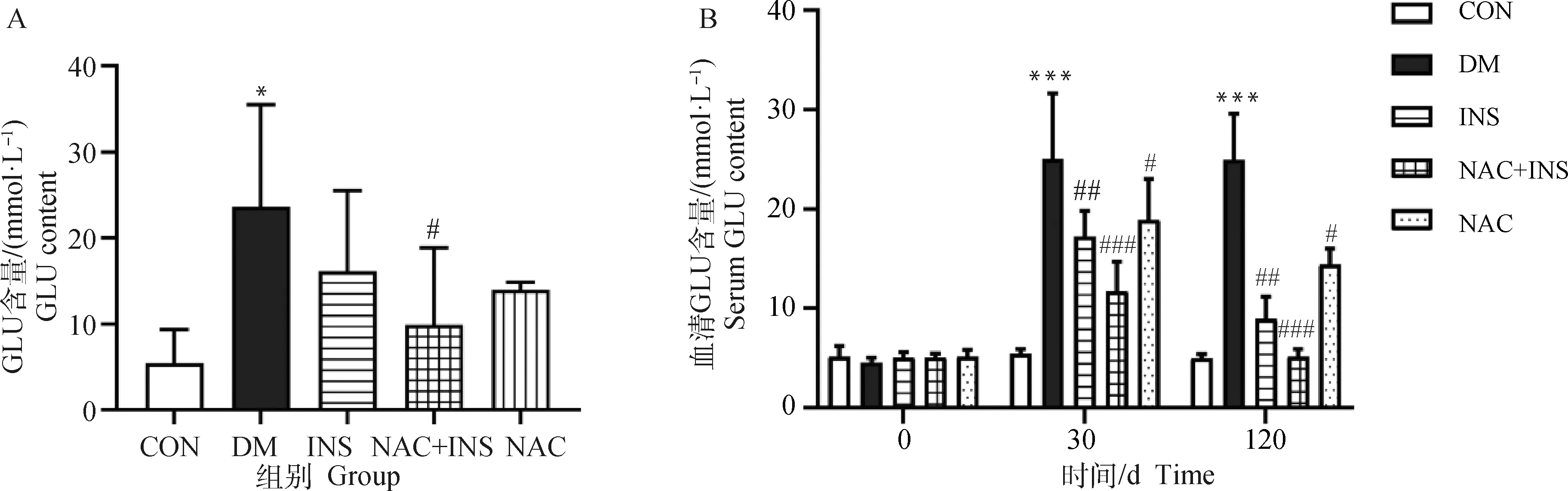
A.NAC对房水GLU含量的影响;B.各组不同时间点血清GLU含量。CON.对照组;DM.糖尿病模型组;INS. 胰岛素治疗组;NAC+INS. NAC联合胰岛素治疗组;NAC. NAC治疗组。同一时间点中,与CON组相比,*.P<0.05,**.P<0.01,***.P<0.001;与DM组相比,#.P<0.05,##.P<0.01,###.P<0.001。下同A. Effect of NAC on aqueous humor GLU content;B. Serum GLU content at different time points in each group. CON. Control group;DM. Diabetes model group;INS. Insulin treatment group;NAC+INS. NAC combined with insulin treatment group;NAC. NAC treatment group. At the same time point,compared with CON group, *.P<0.05,**. P<0.01,***. P<0.001; compared with DM group, #.P<0.05,##. P<0.01; ###. P<0.001. The same as below图2 NAC对房水和血清葡萄糖含量的影响Fig.2 Effect of NAC on aqueous humor and serum glucose content
各组试验犬血糖含量变化见图2B,试验犬在造模前各组间血糖含量无统计学差异;试验30 d时,与CON组相比,DM组血糖含量极显着升高(P<0.001),与DM组比较,NAC+INS、INS及NAC组中血糖含量均显着降低(P<0.05,P<0.01或P<0.001),其中,NAC+INS组下降幅度最大;试验120 d时,与CON组相比,DM组血糖含量极显着升高(P<0.001),与DM组比较,NAC+INS、INS及NAC组中GLU含量均显着降低(P<0.05,P<0.01或P<0.001),其中,NAC+INS组下降幅度最大。
2.3 NAC对白内障程度的影响
各试验组犬在造模120 d时对晶状体进行裂隙灯检查照片,图3为从试验组犬中挑选1只最具代表性的进行展示。造模4个月后,CON组和NAC+INS组晶状体呈清晰、正常状态为0级;DM组和INS组试验犬皮质部的混浊开始融合,有水裂,混浊区眼底细节不可见,弥漫性中央混浊,可分为白内障Ⅳ期,3级;NAC组试验犬散瞳后皮质部前极有放射状混浊,呈灰白色,从“Y”形缝蔓延外周囊泡和皮质混浊,可分为Ⅲ期,2级。
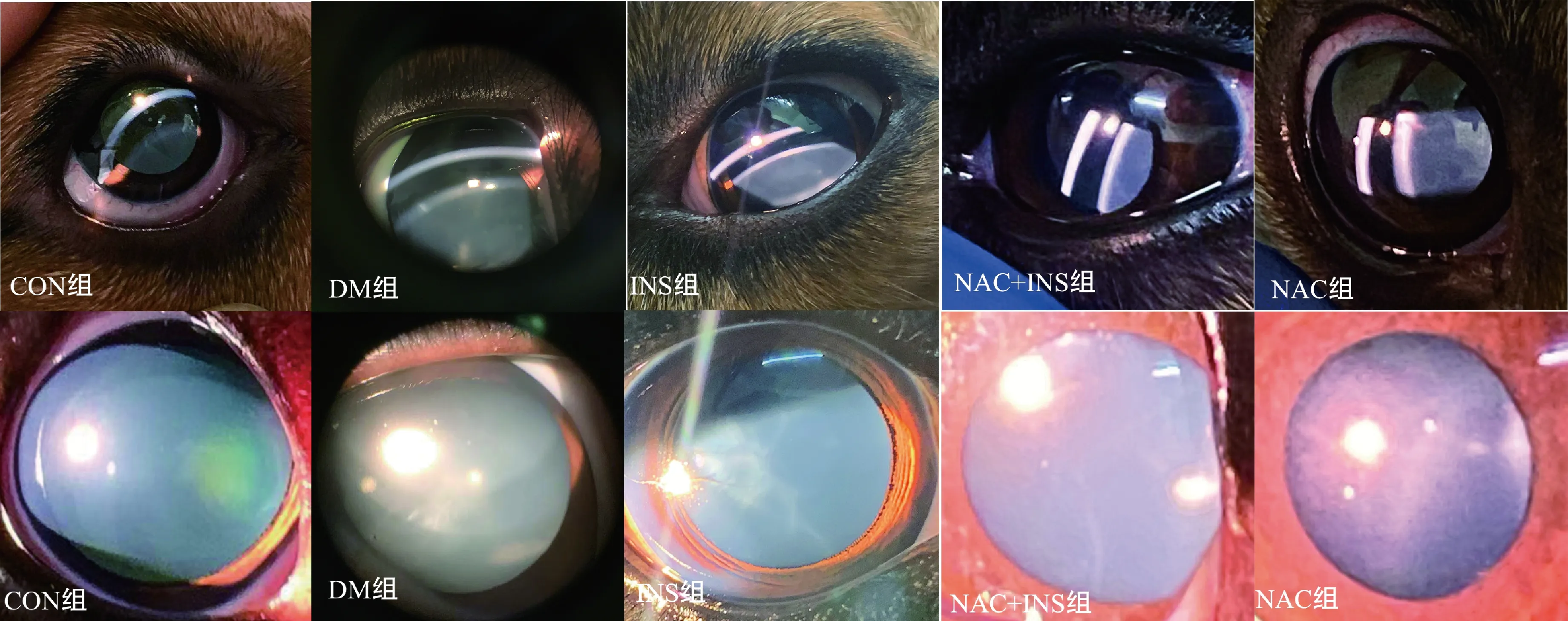
图3 裂隙灯检查图片Fig.3 Slit-lamp examination pictures
综合两种分级标准对病变进行描述,记录结果如表2。DM组白内障评分显着高于CON组(P<0.01);NAC+INS组评分显着低于DM组(P<0.01)。
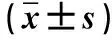
表2 白内障等级评估表Table 2 Cataract grade assessment table
2.4 NAC对眼睛病理组织学的影响
从图4可以看出,CON组和NAC+INS组的晶状体上皮细胞(LECs)排列整齐,大小均一,细胞间连接紧密,胞间空隙均匀,核呈圆形又大,且染色均匀,与前囊膜连接紧密;然而,DM组LECs间隙不均匀,细胞大小不均,细胞核数量减少且部分出现核固缩,有坏死小体(箭头所示),且前囊膜连接疏松,染色过程中前囊膜脱离,图中所见为厚切之后多层LECs裸露在表面;经NAC或胰岛素单独治疗的组中LECs胞间连接较为紧密,病变情况有所改善,但细胞核形态不均一,且与前囊膜连接也出现缝隙,治疗效果不及NAC+INS组。此外,5个组的晶状体内部浅皮质区和深皮质区,成熟的晶状体纤维排列和走向均整齐,无明显病变,INS组和NAC组由于染色过程出现裂纹,其纤维结构未出现明显变化。
左列为HE染色,200×;中间列为左列的放大;右列为晶体深皮质区。箭头指示细胞核The left column is HE staining, 200×; The middle column is a larger version of the left column; The right column is the deep cortex of the crystal. The arrow indicates the nucleus图4 晶状体组织病理学切片图(HE染色,200×)Fig.4 Histopathological section of lens (HE staining,200×)
2.5 NAC对晶状体上皮细胞抗氧化指标的影响
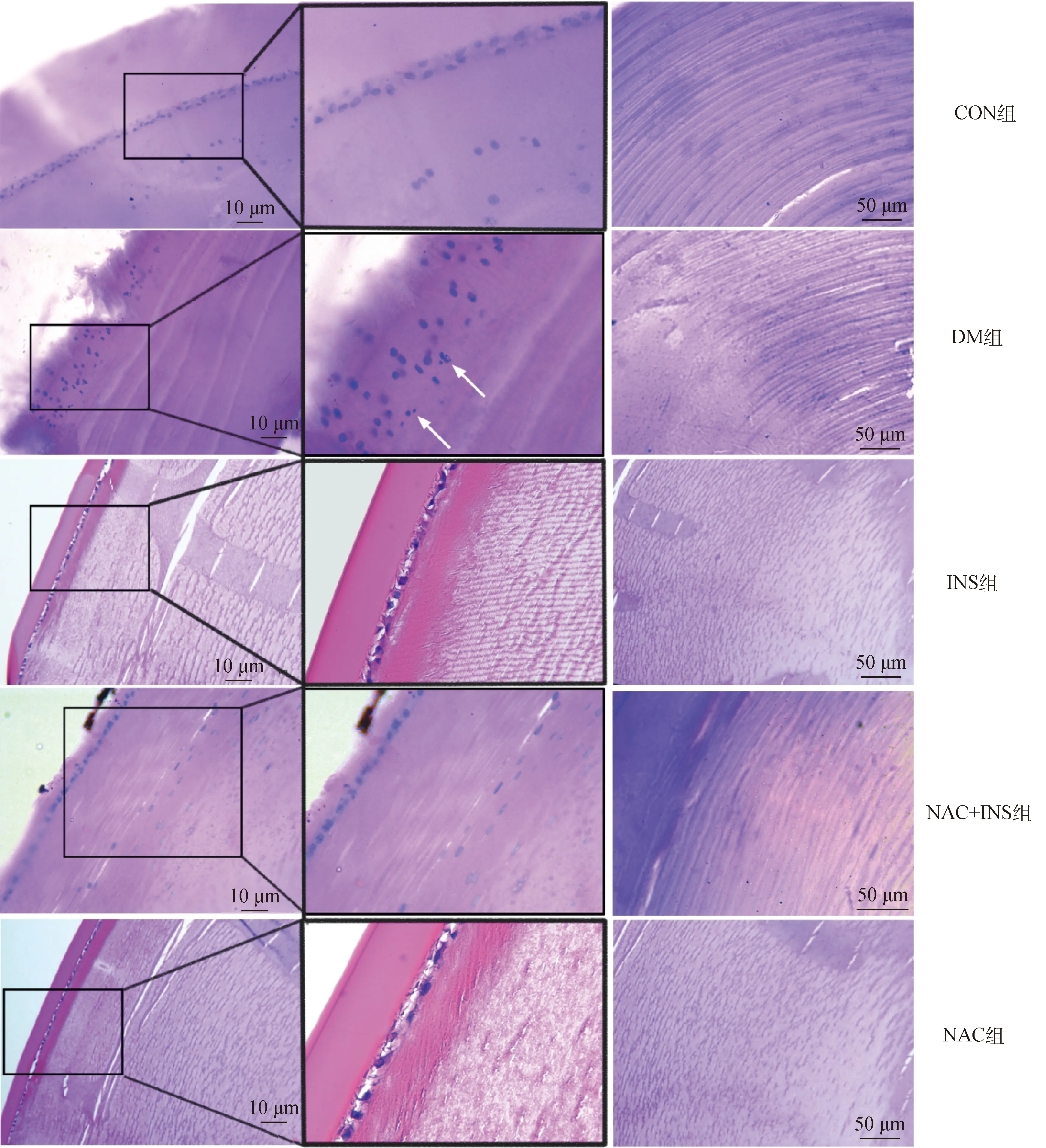
NAC对晶状体上皮细胞抗氧化指标的结果如图5所示,与CON组相比,DM组的晶状体上皮细胞内MDA含量显着升高(P<0.05)、GSH/GSSG和GSH-Px活性均显着下降(P<0.05)、GR活性下降(P>0.05);而与DM组相比,NAC+INS组中晶状体上皮细胞内MDA含量显着下降(P<0.05)、GSH/GSSG和GSH-Px活性显着上升(P<0.05)、GR活性极显着上升(P<0.01),表明NAC联合胰岛素治疗可抑制DM犬晶状体上皮细胞氧化应激。

图5 NAC对晶状体上皮细胞抗氧化指标的影响Fig.5 Effect of NAC on antioxidant index of lens epithelial cells
2.6 NAC对房水中抗氧化指标的影响
NAC对房水中抗氧化指标的结果如图6所示,在造模第120天,与CON组相比,DM组的房水中MDA含量极显着升高(P<0.01),而GSH/GSSG、GR活性和GSH-Px活性均极显着下降(P<0.01);与DM组相比,NAC+INS组房水中MDA含量下降(P>0.05)、GSH/GSSG极显着上升(P<0.001)、GR活性和GSH-Px活性极显着上升(P<0.05),表明NAC联合胰岛素治疗可降低DM犬房水中氧化应激水平。
图6 NAC对房水中抗氧化指标的影响Fig.6 Effect of NAC on antioxidant indexes in aqueous humor
2.7 NAC对晶状体上皮细胞氧化损伤相关基因表达的影响
NAC对晶状体上皮细胞氧化损伤相关基因表达量变化如图7所示,与CON组对比,DM组的GR和SOD2mRNA表达水平明显上调,且差异显着(P<0.05);而与DM组对比,NAC+INS组GR和SOD2mRNA表达水平上调,但差异不显着(P>0.05),表明NAC联合胰岛素治疗可进一步增加抗氧化相关基因的表达量。
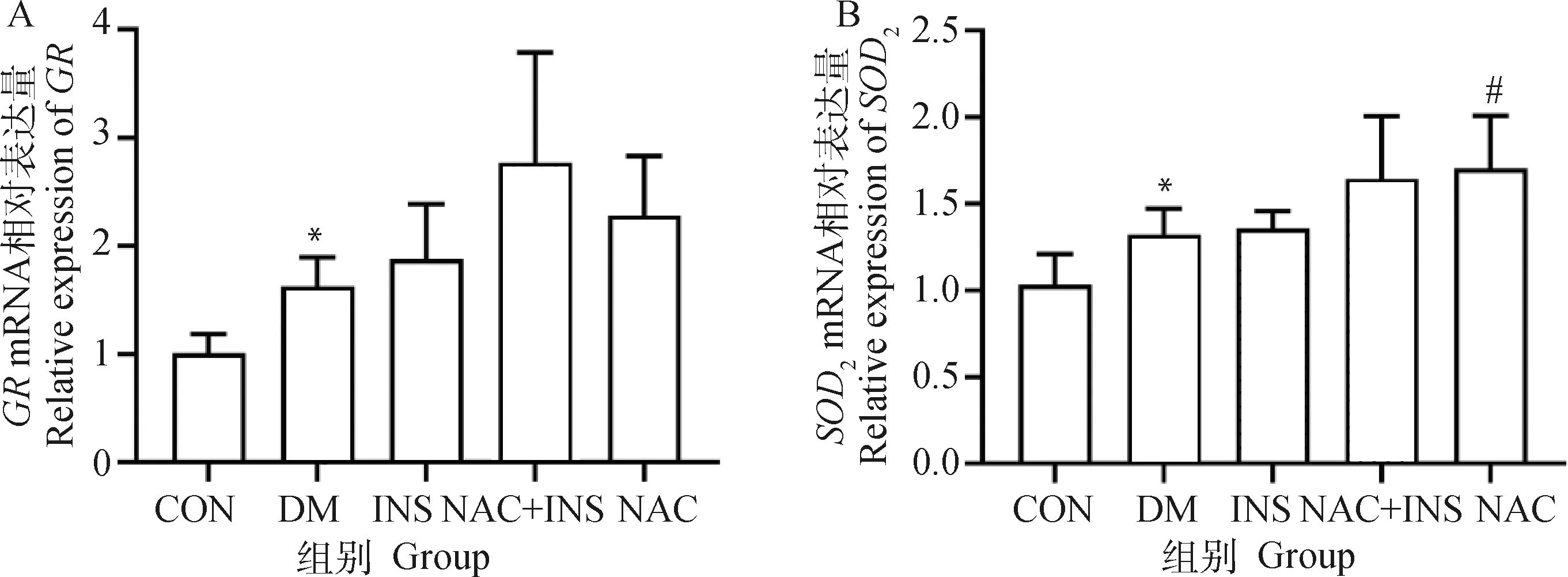
图7 NAC对晶状体上皮细胞氧化损伤相关基因表达量的影响Fig.7 Effect of NAC on expression of oxidative damage-related genes in lens epithelial cells
3 讨 论
为了研究糖尿病性白内障发病机制,筛选保护药物并探索其作用机理,建立合适的试验性糖尿病白内障动物模型具有重要意义[10-11]。运用对胰岛β细胞有毒性的化学物质ALX和STZ对试验比格犬进行造模。在本试验结束时,5个组呈现的血清和房水的GLU变化趋势是一致的,表明用血清和房水中任何一种来作为测量房水葡萄糖含量都是可行的,但是血清中测量的葡萄糖含量变化差异性要高于房水,说明临床中如果要为眼部患畜做诊断,若选择检测血清去推测房水葡萄糖,那么房水中的葡萄糖含量会被高估。张志鹏[12]研究表明,犬糖尿病性白内障模型分级形成时间分别为C1:30 d左右;C2:60 d左右;C3:150 d左右;C4:180 d左右;C5:240 d左右。本试验中所监测到的空腹血糖水平均表明已建成1型糖尿病模型。成模120 d后进行散瞳,可见DM组中犬晶状体皮质部的混浊开始融合,有水裂,即为白内障Ⅳ期,与张志鹏[12]研究结果相一致。有研究表明,与非糖尿病患者相比,即使血糖水平降低至机体正常范围内,波动也较小,DM患者的白内障发生可能性还是没有显着降低[13-14]。本试验中INS组血糖水平较NAC组控制更好,但是裂隙灯结果中INS组比NAC组白内障等级要更高,说明只用胰岛素,可以有效控制血糖,但不能延缓糖尿病性白内障的发展。本研究结果表明,NAC联合胰岛素治疗,可以有效延缓晶状体混浊的发生发展。
有研究表明,氧化应激是白内障的致病因素,与正常个体相比,从复杂性白内障患者获得的房水样品的脂质过氧化产物浓度增加[15]。据报道STZ和ALX是通过氧化应激对β细胞造成损伤[16]。Boarescu等[17]研究表明,1型糖尿病可降低机体的总抗氧化能力。另有研究表明,STZ诱导的DM大鼠氧化应激水平升高,提示高糖可触发氧化应激,与对照组相比,DM组大鼠的血清,MDA含量明显增加[18]。本试验中首先采用ELISA试剂盒对各组试验犬的房水、晶体组织进行机体氧化应激指标的检验,研究结果与上述学者所得一致。与CON组对比,在两种样本中DM组的犬晶体上皮的MDA含量升高,GSH-Px活性、GR活性和GSH/GSSG含量均呈不同程度的增加。说明运用SLX联合STZ造模会使试验犬机体氧化应激水平升高。房水中各氧化应激指标降低幅度很大,与CON组对比差异极显着,而同样条件下,在晶体组织中检测结果差异显着性更小。可能是晶状体酶类抗氧化剂从细胞内核糖体被制造,通过细胞膜扩散至细胞外液,分布在全身各个组织中,所以细胞代谢功能越活跃的器官,抗氧化酶浓度越高,越容易检测到,而房水是由睫状体某些上皮细胞产生,而晶状体上皮细胞只有单层,数量较少,且晶状体囊膜形成一层屏障,房水中与晶状体上皮细胞的抗氧化酶浓度与活力存在梯度,所以房水中比晶体组织中检测的氧化应激指标显着性差异更大。
黄酮苷可以抑制糖尿病性白内障小鼠中LECs的氧化应激水平,显示GSH-Px、T-SOD活性全部都低于阴性对照组(P<0.05或P<0.01),提示高糖对LECs表现出明显的氧化应激[19],而高剂量黄酮苷治疗组与高糖组对比GSH-Px、T-SOD活性显着升高[20]。DL-丁基苯酞对STZ诱导的糖尿病性白内障大鼠血清MDA含量比模型组显着降低[21]。本试验对DM组和其他治疗组犬房水和晶体组织中的各氧化应激因子水平进行了对比,研究结果显示,与DM组相比较,NAC+INS组的MDA含量在两种样本中均降低;所有已测的抗氧化酶活力和GSH/GSSG在两种样本中均呈不同程度的升高,与前人研究结果相一致,表明NAC联合胰岛素治疗可抑制DM犬氧化应激,其中,晶体组织中GSH-Px、GR活力和GSH/GSSG的升高程度与DM组对比有显着差异,且MDA含量也显着升高,同时在房水中仅有GSH-Px、GR活力的升高程度与DM组对比有显着差异,说明在晶状体酶系抗氧化剂中以GSH-Px和GR为主。而且通过比较两种样本,INS组和NAC+INS组可改善氧化应激水平,且NAC+INS组比INS组表现更佳,说明NAC联合胰岛素治疗与单独使用胰岛素治疗相比,在抑制糖尿病性白内障犬氧化应激方面可取得更好的效果。Takahashi等[22]研究表明,T1D患者中与氧化应激有关的基因为上调,本研究中,DM组的SOD2和GR基因相对表达水平相较于CON组也有显着性升高,与Takahashi等[22]的研究结果相一致。而各治疗组相较于DM组均有不同程度上调,其中,NAC组的SOD2基因相对表达水平与DM组对比有显着性上调(P<0.05);与INS组相比,NAC+INS组和NAC组上调程度更高,说明只要发生糖尿病,那么机体内氧化应激基因均出现上调,而NAC作为抗氧化剂,也可能对氧化应激有关的基因有激活作用,其具体机制有待进一步探究。
4 结 论
NAC联合胰岛素治疗能改善1型糖尿病犬的血糖、晶状体功能,比单独使用胰岛素组的效果更好。NAC联合胰岛素治疗对糖尿病犬晶状体上皮损伤的保护作用,可能和抑制晶状体的氧化应激有关。



