陈思颍,孙雅雯,李 伉,刘 硕,郝海生,杜卫华,邹惠影,朱化彬,庞云渭
(中国农业科学院北京畜牧兽医研究所,北京 100193)
家畜体外胚胎生产(invitroembryo production,IVEP)技术体系包括卵母细胞体外成熟、体外受精(invitrofertilization,IVF)、胚胎体外培养和超低温冷冻保存等若干技术环节,是一个极为复杂的集成技术体系[1-2]。该技术在良种母畜繁殖潜力挖掘、快速扩繁以及种质资源保护等方面均具有重要的应用价值。近20年来,全球体外胚胎生产数量持续攀升,IVEP技术已成为当前国际家畜繁育技术竞争的新赛道。然而,与体内胚胎相比,体外胚胎生产仍存在卵母细胞成熟质量差、体外胚胎发育能力弱以及抗冻性差等问题,严重制约IVEP技术体系总体效率提升。
微流体学既是一门科学,也是一种技术。从科学上讲,它是利用数十微米至数百微米的微流控通道精确控制和操纵亚微升流体(10-9~10-18L)行为的研究[3-4];在技术上,它涉及分析、诊断、细胞生物学和单细胞基因组学的应用,是一个包含工程、物理、化学和生物学的多学科和跨学科研究领域。以层流和低雷诺数为特征对微流体进行操纵的过程称为微流控[4],由于微流控装置具有样品消耗少、分析速度快、高通量、高灵敏度、高自动化和集成化等特点[3,5],其在家畜体外胚胎生产多个关键技术环节中显示出巨大的应用前景[6]。本文综述了近年来微流体技术在卵母细胞选择、精子分选、IVF集成、胚胎体外培养以及配子和胚胎超低温冷冻保存中的应用进展,为提升家畜IVEP效率提供新思路。
1 微流体技术在卵母细胞选择中的应用
在IVEP中,卵母细胞的选择取决于对细胞质、极体和卵丘细胞的形态学评估,体外停留时间长且主观性较强。而微流体技术可以对卵母细胞进行自动化处理和制备,从而最大限度地降低卵母细胞的损伤[7]。Iwasaki等[8]为了提高IVF效率,根据不同质量卵母细胞在蔗糖缓冲液中的沉降速率差异,设计了一种筛选牛卵母细胞的微流控装置(图1A)。分离通道的出口分为上腔室和下腔室。在蔗糖缓冲液中,优质卵母细胞比劣质卵母细胞沉降得更快,因此,从下腔室收集到的卵母细胞质量较好,且优质卵母细胞回收率可达55%左右。对分离的卵母细胞分别进行IVF后发现,从下腔室收集的卵母细胞囊胚发育率显着高于从上腔室收集的卵母细胞(36.0% &14.1%)。
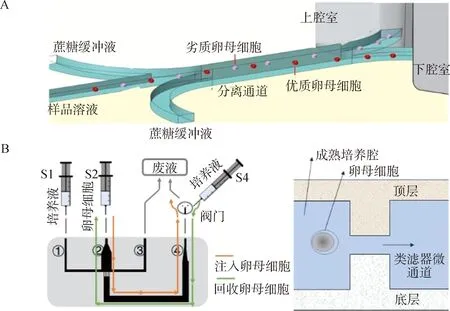
A.分离卵母细胞的微流控装置;B.培养卵母细胞的微流控装置 A. Microfluidic device for oocyte seperation;B. Microfluidic device for oocyte cultivation 图1 用于卵母细胞选择和培养的微流控装置示意图[8,10]Fig.1 Schematic of microfluidic device for oocyte seperation and cultivation[8,10]
与传统的静态体外培养卵母细胞相比,采用微流控装置构建的动态培养系统可更好地模拟体内生理环境[9]。Berenguel-Alonso等[10]以环烯烃聚合物和低温共烧陶瓷为材料,采用热压和微铣削相结合的方法制作了一种捕获和选择牛卵母细胞的微流控装置(图1B)。该装置中“过滤器状”结构用于捕获卵母细胞,使卵母细胞固定在成熟室避免丢失,并通过相连的微铣腔运输培养液,从而进行动态培养。采用该装置培养的卵母细胞成熟率与传统四孔板培养无显着差异,但使用该装置进行的动态培养有助于提高卵母细胞的整体成熟度。借助流体力学分析和3D生物打印模型,Mastrorocco等[11-12]构建了基于藻酸盐填充的微流控装置用于羔羊卵母细胞体外成熟,发现经动态培养系统培养的卵母细胞,核质成熟、生物能量和囊胚发育质量均有所改善,并且此法可用于培养濒危物种、老年供体或冷冻保存后等次优条件下的卵母细胞。
2 微流体技术在精子分选中的应用
有效分选以获得足够数量形态正常且有活力的精子对IVF至关重要[13]。与传统精子处理方法相比,微流控装置能够快速精确地分离出高质量精子,在不影响精子形态的前提下改善精子动力学参数,降低DNA 碎片水平[14],具有标准化高、灵活性和可控性强等优点[15]。
Nagata等[16]开发了一种具有超高选择通量,且能够筛选DNA完整性高、运动力强且的牛精子的扩散型微流控分选装置(diffuser-type microfluidic sperm sorter,DMSS),由3个柱形腔室和底部14个微通道构成(图2A),根据3个腔室的不同尺寸和液柱相对高度差产生的静水压使精子通过微通道进行分选。其结果显示,DMSS分选的精子活力和直线运动比例达到100%,DNA完整率达到95%以上。Yaghoobi等[17]设计了一种基于微腔的微流控装置(图2B),可将渐进运动的精子与不活动精子及其碎片分离,并将非渐进精子捕获在微腔室中。经过该装置分选出的牛精子活力从38%提升至90%,DNA完整性提高了近20%,并且微腔深度不影响运动精子的停留时间,可在相同的时间范围内分选更多数量的精子。
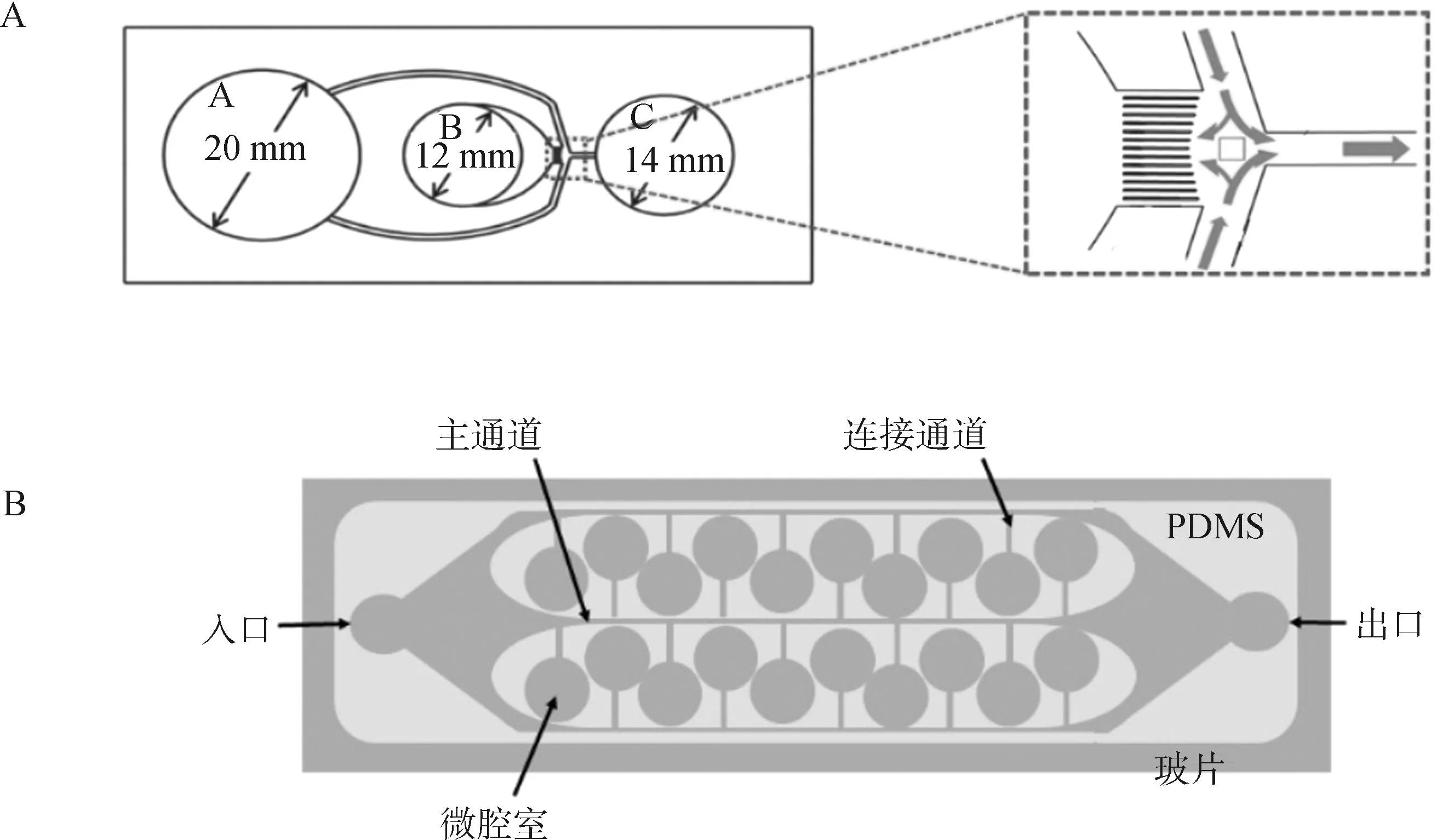
A.扩散型精子分选装置;B.基于微腔的精子分选装置A. A diffuser-type microfluidic sperm sorter; B. Microchamber-based microfluidic device for sperm selection图2 用于精子分选的微流控装置示意图[16-17]Fig.2 Schematic of microfluidic device for sperm selection[16-17]
为了全面评价精子质量,Pan等[18]开发了一种可以自动混合样品的微流控芯片,并配备便携式显微成像系统进行实时观察,提出了一套识别精子活力和存活率的算法。采用该装置检测猪存活精子的准确率为94.0%,误差率仅为0.6%,与计算机辅助精子分析结果一致。Herbicht等[19]提出了一种新型微流控芯片式精液处理装置(VetCountTM收集器)用于牛IVF,并与不连续密度梯度离心法进行比较,分别对来自6头不同公牛的冷冻-解冻精液质量进行评估后发现,与未处理组相比,两种处理均显着增加了渐进运动精子的比例(84.4% &85.1%vs.41.9%);IVF试验发现,采用VetCountTM收集器筛选的2头公牛精子的受精效果要优于不连续密度梯度离心处理法,但这种能力因公牛而异。Alkan等[20]评估了微流控精子分选芯片(microfluidic sperm sorting chip,MFSC)对牛IVEP胚胎发育和质量的影响,发现MFSC组IVF卵裂率(85.71%vs. 76.33%)、囊胚率(44.15%vs. 32.54%)均显着高于常规精子处理组,囊胚总细胞数、内细胞团数、滋养层细胞数明显增加,且凋亡细胞比例显着减少,表明MFSC可替代常规精子处理方案提高牛IVEP效率。此外,Vigolo等[21]采用商业化的ZyMot多精子分离装置测定种马精液的分选效果,在微流体回收前、后对精子的运动学参数、质膜和顶体完整性、线粒体膜电位等进行评估,发现该装置对质量较差的种马冷冻精液分选效果更好,可用于特定精子群体的筛选。
3 微流体技术在IVF中的集成应用
常规IVF是将卵母细胞放置在培养皿中,加入适宜浓度的精子使其自然穿透卵母细胞,但这常会导致多精受精的发生,致使胚胎染色体异常[22-23],而且配子和胚胎在整个操作过程中会多次受到温度、二氧化碳浓度和氧张力波动的影响[24];同时,操作人员技术的差异也使IVF难以实现标准化[25]。而集成多种IVF操作程序的微流控装置可以减少人为操作的干预,提高生产效率。
Clark等[26]模仿输卵管功能设计了一款微通道,在层流状态下用于将精子输送至卵母细胞。研究发现,与传统微滴系统相比,猪卵母细胞在微通道中的单精受精率(63.89%vs.22.32%)显着提高。这表明该仿生微通道可降低多精受精的发生率,增加存活胚胎的数量,并且不会降低体外胚胎整体生产效率。Han等[27]报道了一种新型微孔结构的微流体装置,采用微孔阵列在流场中捕获单个卵母细胞,并进行原位受精、培养基置换和胚胎培养(图3A)。通过有限元建模和流动洗涤实验比较了不同的微孔深度,发现在快速原位培养基更换过程中,高达200 μm的微孔深度在卵母细胞捕获和碎片去除方面最有效,有助于受精和胚胎培养在单个微流体装置中的集成。采用该装置培养的胚胎各阶段的发育率与微滴培养相似。此外,通过改变微腔的宽度和深度,该装置还可用于培养不同物种的卵母细胞和胚胎。袁一田[28]设计制作了集成精子筛选、受精、胚胎培养的集成微流控芯片(图3B),用于猪IVF试验,发现IVF囊胚率从5.4%提高到10.3%。该研究证明了微流控芯片在优化猪IVF体系中的有效性。Ma等[29]开发了一种集成卵母细胞定位、精子分选、体外受精、胚胎培养等多功能的微流控芯片(图3C)。卵母细胞可单独定位在4×4的八柱单元阵列中,4个对称的直通道在卵母细胞定位区交叉以有效地选择运动精子,并有助于快速更换培养基。采用该装置筛选的精子活力显着高于传统离心法(96.1%vs.60.8%),但卵裂率和囊胚发育率与传统IVF培养方式无显着差异。
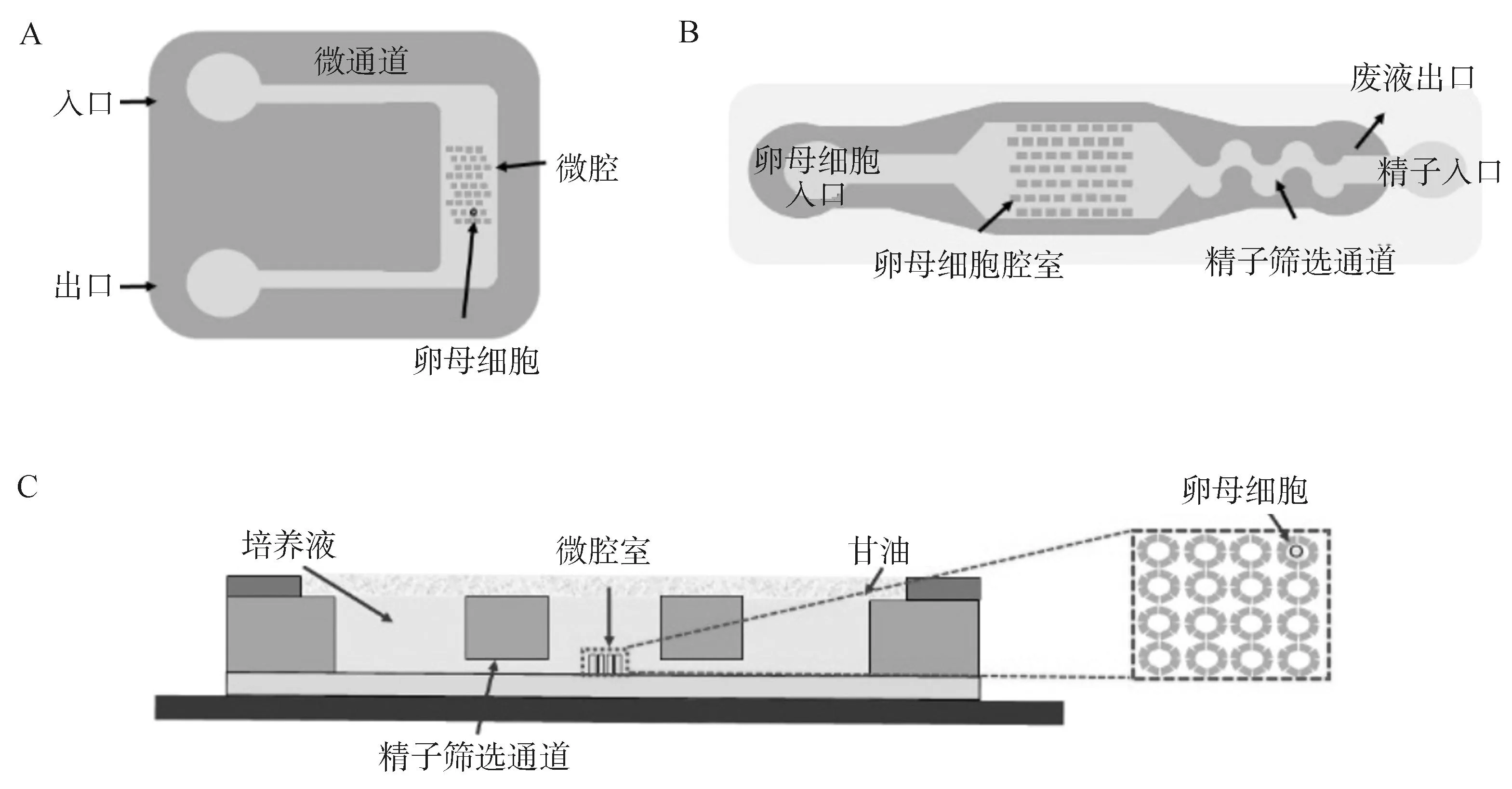
A.新型微孔结构的微流控装置;B. 多层微流控装置;C.多功能微流控芯片A. A novel microwell-structured microfluidic device; B. Multilayer microfluidic device; C. Multifunctional microfluidic chip图3 用于体外受精的微流控装置示意图[27-29]Fig.3 Schematic of microfluidic device for in vitro fertilization[27-29]
4 微流体技术在胚胎体外培养中的应用
早期胚胎的体外培养是胚胎工程的关键环节之一。目前,IVEP效率低的主要原因之一是胚胎体外培养体系仍无法完全模拟雌性生殖道微环境,造成囊胚发育率低、胚胎质量差以及移植妊娠率低等一系列问题[2]。微流体系统将3D架构、不同类型的细胞[30-31]和流动流体结合起来,可创造一个动态的胚胎体外培养系统[32],持续为胚胎提供新鲜的营养物质,同时去除胚胎产生的有毒物质,从而改善体外胚胎发育质量[33]。
Bormann等[34]将牛体外胚胎随机在传统培养微滴和具有动态流体的微流控装置中进行培养,发现微流控装置培养的体外胚胎囊胚发育率显着高于传统液滴培养(35.0%vs.21.4%)。Kim等[35]开发了一种用于牛胚胎体外培养的微流控装置,采用传统的光刻和聚二甲基硅氧烷(polydimethylsiloxane,PDMS)复制成型工艺制作无收缩功能的直通道或通过模拟肌肉的蠕动性收缩构建具有收缩功能的微通道,将受精卵在微流体培养系统上培养,发现采用具有收缩功能的微流控装置产生的8-细胞胚胎比例显着高于直通道(56.7%vs.23.9%)。上述结果表明,动态培养环境以及机械刺激可促进早期胚胎的体外发育。
20世纪90年代出现的介质电润湿(electrowetting on dielectric, EWOD)技术催生了被称作数字微流控(digital microfluidics,DMF)的微尺度液体处理技术,EWOD能够提供胚胎发育所需的动态培养微环境,更好地模拟输卵管功能[36]。到目前为止,EWOD芯片仅被用于小鼠胚胎的体外动态培养[37-38]和人类早期胚胎发育的非侵入性评估工具[39]。最近,Karcz等[40]利用EWOD技术设计了一种用于体外操纵牛胚胎的微流控芯片,发现采用EWOD芯片培养的胚胎出现发育迟缓的迹象,与传统静态培养相比,在第8天(192 hpi)仅达到早期囊胚阶段。尽管没有达到预期结果,但该研究使DMF成为真正的芯片实验室成为可能,并为开发更多用于体外胚胎操作的仿生微型设备提供理论基础。
5 微流体技术在超低温冷冻保存中的应用
早期研究发现,在玻璃化冷冻-解冻过程中添加和移除冷冻保护剂(cryoprotectant agents, CPAs)会导致渗透和机械损伤以及细胞毒性[41-42],直接影响卵母细胞和胚胎的发育能力[43-46]。而微流体技术可使CPAs在微流控芯片中保持缓慢而稳定的流速,实现CPAs稳步添加和移除[47],降低细胞损伤[48-49],提高发育率[50-52]。
Lai等[53]利用高度差驱动CPAs开发了自动玻璃化微流控装置。与手动操作相比,该装置将卵母细胞和受精卵的收缩率降低了13.8倍,显着增加了玻璃化冷冻-解冻后牛卵母细胞中的脂质含量,降低了渗透损伤,获得更好形态、更高存活率和发育率的牛卵母细胞。衣星越等[54]设计了一种用于猪MⅡ期卵母细胞CPAs添加和移除的微流控芯片(图4A),并分析了CPAs移除时间对卵母细胞存活和体外发育能力的影响,发现微流控装置移除CPAs总时间为8 min时,卵母细胞存活率和桑椹胚率(95.99% &74.17%)与新鲜组相比(98.53% &78.22%)无显着差异,表明采用微流控法移除CPAs能够降低卵母细胞损伤。Guo等[55]采用微流控法实现连续添加和移除猪MⅡ期卵母细胞中的CPAs,发现微流控法处理的卵母细胞体积变化明显小于分步法,卵母细胞存活率(95.3%vs.79.4%)、卵裂率(64.4%vs. 43.6%)和囊胚率(19.4%vs.9.7%)显着提高。Cai等[56]开发了一种压力触发式微流控芯片(图4B)。通过按压压力变形区顶部压力点改变微通道横截面来控制添加和移除CPAs的时间,该芯片简化了添加和移除CPAs的操作过程,降低了对卵母细胞的损伤。Jiang等[52]以环烯烃聚合物为基质设计了具有微柱阵列的微流控装置。与微通道微流控芯片相比,该装置提高了液体交换效率、减少了液体残留、加快了卵母细胞在液氮中的冷却速率,使其能承受液氮和室温的温差冲击,还避免了冷冻过程中卵母细胞体积的快速变化,在保持卵母细胞原有形态的同时,降低渗透损伤,提高冷冻效率。以上装置都可以通过改变微流控芯片的材料和微通道的尺寸,以适用不同物种卵母细胞的冷冻保存。
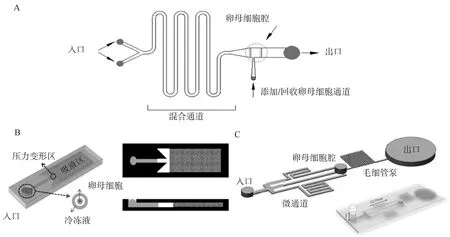
A.蛇行通道微流控装置;B.压力触发式微流控芯片;C.液压型微流控装置A. Serpentine channel-based microfluidic device;B. Push-triggered microfluidic chip; C. Hydraulic microfluidic device图4 用于添加和去除CPAs溶液的微流控装置示意图[49,54-56]Fig.4 Schematic of microfluidic device for CPAs addition and removal[49,54-56]
微流体技术在胚胎玻璃化冷冻保存方面的进展相对缓慢。Pyne等[57]首次开发了DMF装置以实现玻璃化冷冻胚胎的自动制备,与传统手动法和基于通道的玻璃化微流控装置相比,DMF装置能最大限度地减少胚胎与外界空气的接触,并且在整个玻璃化过程中不断跟踪和控制胚胎的位置,避免丢失。采用该装置对胚胎进行玻璃化冷冻-解冻后,胚胎的存活率和发育率与传统手动法无显着差异。Tirgar等[49]利用静水压力差驱动CPAs设计了一种多通道微流控芯片(图4C),并分析了CPAs添加时间对囊胚发育的影响。结果发现,采用该装置添加CPAs的时间保持在12 min时最有利于解冻后囊胚的发育;与两步法解冻相比,使用该装置解冻后的胚胎仍能保持原有形态,并且与内质网应激、氧化应激、热休克和细胞凋亡等相关的有害基因的表达降低。Miao等[58]设计了一个可自动进行胚胎玻璃化的机器人系统,包括CPAs预处理、将胚胎转移到玻璃化细管以及用液氮进行冷冻保存。采用该系统解冻后胚胎的存活率(90.9%vs.94.4%)和发育率(90.0%vs.94.1%)与人工操作无显着差异,该研究对实现自动玻璃化冷冻胚胎标准化具有重要的借鉴意义。
6 结论和展望
近年来,微流体技术在体外胚胎生产领域的应用取得重大进展。从混合的T型通道、蛇形通道到基于液滴的平面微流控装置,微流体技术的应用越来越多样化。与传统手动操作相比,微流控装置具有低消耗、快响应以及高度集成等特性,使其在IVEP的各个领域发挥重要作用。同时,采用微流控装置可以提高操作过程标准化,减少人为因素的干预以及由此产生的误差和污染[33],提高后续相关操作的成功率[59]。然而,由于微流控芯片的通道、接口设计以及材料加工工艺等缺乏统一标准,目前微流体技术的应用还仅限于动物实验水平;而且,多数微流控装置只能对单个细胞进行操作,效率较低;微流控装置中的阀门、连接管道和注射泵等设备不便于进行胚胎操作。微流控芯片采用的载体大多为PDMS,为了芯片的集成性能,应采用高导热材料作为替代[55],也可以使用封闭式载体系统替代开放式载体系统以提高芯片安全性,避免交叉感染[60]。
总之,微流体技术在卵母细胞选择培养、精子分选、体外受精、体外胚胎培养以及配子和胚胎超低温冷冻保存中的应用已日渐成熟,随着该技术的进一步发展和优化,设计出高度集成的微流控芯片,实现体外胚胎生产的自动化操作,对提高IVEP技术效率具有重要意义。



