武上杰,栾园园,王明坤,张贺春,于 波,马月辉,蒋 琳,何晓红*
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.朝阳市朝牧种畜场有限公司,朝阳 122629)
布鲁氏菌病(以下简称布病)是一种由布鲁氏菌(以下简称布菌)感染引起的人畜共患病,具有高度传染性,在170多个国家和地区流行,每年感染人数逾50万[1]。根据布菌对宿主的偏好性,一般将其分为羊种(B.melitensis)、牛种(B.abortus)、猪种(B.suis)、鼠种(B.neotomae)、犬种(B.canis)和绵羊附睾种(B.ovis)等[2]。其中,B.melitensis(绵羊和山羊均易感)的毒力和感染性最强,也是人间布病的最主要病原,在我国占据主导地位[3]。此外,B.suis和B.ovis在绵羊群的感染状况也不容忽视[4]。布病的典型症状表现为波浪热、关节炎和繁殖障碍(公畜睾丸炎和附睾炎,母畜流产和不孕)。我国是绵羊生产大国,存栏量在2022年已达1.86亿只。但近年来,绵羊布病疫情在华北和西北等地呈蔓延趋势[5-6],不仅给我国绵羊养殖业带来巨大经济损失,还对公共卫生形成重大安全隐患。
布病是自然疫源性传染病,提高管理水平、接种疫苗和淘汰染疫动物是部分发达国家防控和净化布病的成功模式[3,7],但在我国仍面临巨大挑战[8]。一方面,布菌是兼性胞内寄生菌,具有免疫逃避能力,布病临床表现为隐性感染和慢性经过,早期难发现,晚期难控制;另一方面,疫苗作用有限[9],加之我国羊群基数庞大,流动性强,尚未全面形成集约化养殖,疫苗难以完全覆盖。因此常规措施难以有效控制布病在我国的流行态势。从长远来看,开展绵羊抗布病新品种的选育工作,提高宿主动物抗病力,能根本上从动物源头切断布病的传播途径,真正落实“人病兽防,关口前移”。
1 布菌的致病机制
布菌是兼性胞内寄生菌,能侵入多种细胞,介导凋亡与自噬进程,建立起复制生态位以逃避免疫杀伤,营造出微环境来维持慢性感染[10]。毒力因子的存在对于布菌生存繁殖的维系以及免疫逃避策略的执行不可或缺。如布菌的非典型脂多糖(lipopolysaccharide,LPS)协同外膜蛋白(outer membrane proteins,OMPs),不仅可抑制免疫激活,阻止补体沉积,还能限制溶酶体融合[11-13]。同时,布菌缺少诸如外毒素、菌毛、鞭毛和质粒等强效致病因子,因此其较弱的免疫原性往往不会引起宿主机体强烈的免疫应答[13]。
1.1 感染与侵袭
布菌可经呼吸道、消化道、眼结膜和损伤皮肤感染宿主,侵入吞噬细胞(如巨噬细胞、树突状细胞和中性粒细胞)以及非吞噬细胞(如上皮细胞、成纤维细胞和滋养层细胞)[14]。脂筏(lipid raft)存在于质膜表面,富含胆固醇和鞘磷脂,是参与细胞膜内外信号传导和物质传递的专门膜微区[15],能介导巨噬细胞以内吞的方式摄取布菌[16]。布菌的环β-1,2-葡聚糖(cyclic β-1, 2-glucan,CβG)能扰乱脂筏中的胆固醇组分[17-18]。发动蛋白(dynamin)和网格蛋白(clathrin)共同作用于布菌内化过程中包被囊泡的再分配和重排[19]。发动蛋白具有GTP酶活性,可选择性地调节囊泡的组装[20];网格蛋白汇聚于脂筏,招募发动蛋白富集,挤压质膜内陷形成小窝,进而包被囊泡[21]。至此,布菌被质膜裹入细胞内部。
1.2 运输与定位
巨噬细胞既是布菌侵入的主要靶细胞,又是先天免疫的重要功能细胞。90%的内化布菌在感染前期会被清除,余下部分则迁移到内质网处建立起复制生态位[22]。布菌内化后形成的囊泡结构统称布氏小体(Brucellacontaining vacuoles,BCVs),是布菌进行胞内运输与定位的载体。在转运初始阶段,由BCVs形成的初级内体(early endosome)短暂接触溶酶体,获得其表面标记分子而成为eBCVs(early BCVs)[23],布菌CβG可阻止eBCVs被溶酶体深度融合[17-18]。同时,这种有限融合产生的酸化环境提供了激活布菌IV型分泌系统(type IV secretion system,T4SS)的信号[24],T4SS分泌的效应子重定向eBCVs的胞内运输途径,以阻止其与溶酶体过分接触而被消化[13,25]。少数(约10%)逃避降解的布菌脱离内体,驱动效应子截获由内质网出芽向高尔基体转运的囊泡[26]。BCVs与内质网融合形成rBCVs(replicative BCVs)区隔,并带有内质网的特异标记[22,27]。另外,双组分调控系统(two-component regulatory system,TCS)时刻调控布菌对环境信号刺激的感知、传递和反应[28]。BCVs的胞内运输与定位伴随着分子标记的更新,内体特征的成熟标志着复制生态位的建立。
1.3 繁殖与扩散
在感染后期,rBCVs参与巨噬细胞的自噬途径而转化为aBCVs(autophagy BCVs),布菌完成胞内循环后开始胞间传播[29]。巨噬细胞的裂解焦亡引发布菌的外流逸散,Hiyoshi等[30]发现布菌可利用T4SS穿透BCVs膜形成PIT(pore-induced intracellular trap)结构,诱使补体沉积其中,产生补体依赖的find-me信号,启动中性粒细胞对PIT的胞吞摄取,而留存于PIT中的布菌得以逃避呼吸爆发。
2 绵羊布病的抗病育种研究进展
畜禽抗病育种,简言之就是通过定向选择或改变特定基因型来培育具有抗病能力的畜禽新品种,主要分为3个方向:家系群体选育、基因工程选育和标记辅助选育。
2.1 抗病性与遗传基础
2.2 家系群体选育
群体选育指从畜禽种群挑选抗病力突出的个体作为亲本建立家系,再通过对子代逐代选择纯化目的基因,获得稳定遗传抗病性状的新品种。这种传统的育种方式实际上是对基因型的直接选择,耗时、费力和成本高的缺点突出,因此往往应用于世代间隔短、群体规模大的家禽研究中,如鸡抗沙门菌[35]和鸭抗肝炎病毒[36]等,而在绵羊的抗病研究中应用较少。
2.3 基因工程选育
基因工程选育指利用锌指核酸酶(ZFNs)、转录激活因子样效应物核酸酶(TALENs)和成簇规律间隔短回文重复序列及其相关蛋白(CRISPR/Cas9)等基因编辑技术对畜禽基因组敲除受体基因或转入目的基因[37]。相较于其它基因编辑技术,CRISPR/Cas9因其高效、稳定和廉价的优点而被广泛应用于转基因动物生产中。
Toll样受体4(TLR4)能识别布菌的脂多糖成分,激活炎症反应和免疫反应。2012年,中国农业大学的研究团队对萨福克绵羊受精卵微量注射线性化的pTLR4-3S载体,借助胚胎移植技术,成功构建了过表达TLR4的转基因绵羊。进一步的攻毒试验结果显示,IL-6、IL-8和TNF-α的表达水平提高,炎症细胞的凋亡增加,机体的抗布菌感染能力明显增强[38]。在此基础上,该团队改进方法,在绵羊非繁殖季也能通过微量注射原核胚胎生产转基因绵羊,并且发现TLR4的过表达对绵羊的生长无不良影响[39]。
褪黑素(melatonin,MT)是由松果体分泌的神经类激素,作为一种抗氧化剂,可缓解氧化应激和促进免疫系统成熟,N-乙酰基-5-羟色胺-O-甲基转移酶(N-acetylserotonin O-methyltransferase,ASMT)是其合成过程中的关键限速酶[40]。2017年,中国农业大学的研究团队选用杜泊绵羊作为供受体,利用CRISPR/Cas9、微量注射和胚胎移植技术成功构建出过表达ASMT的转基因绵羊[41]。布菌攻毒试验发现转基因绵羊均未患病,并且差异表达基因显着富集在自然杀伤细胞介导的相关通路,这表明转基因绵羊抗布病能力强于野生型[42]。
2.4 标记辅助选育
标记辅助选择(marker-assisted selection,MAS)指利用育种性状相关标记代替表型层次的选择,抗病性状标记辅助选择可分为免疫遗传学标记辅助选择和分子标记辅助选择[43]。其中,分子标记辅助选择指从分子水平利用与目标基因紧密连锁的遗传标记直接选择基因型,可在遗传本质上选育绵羊抗布病新品种。与家系群体选育相比,标记辅助选育可有效缩短世代间隔、增大选择强度、提高选种准确性和降低育种成本;与基因工程选育相比,标记辅助选育可避免生物安全、伦理道德和动物福利等方面的诸多限制。主效基因的挖掘是标记辅助选择的基础工作,以下从免疫和炎症反应的激活和效应两个阶段介绍布病相关基因和非编码RNA(non-coding RNAs,ncRNAs)。另外,如表1和表2所示,大多数研究选用B.abortusS2308经典菌株验证基因功能,不同菌株与宿主之间作用机制的比较还未见文献报道。
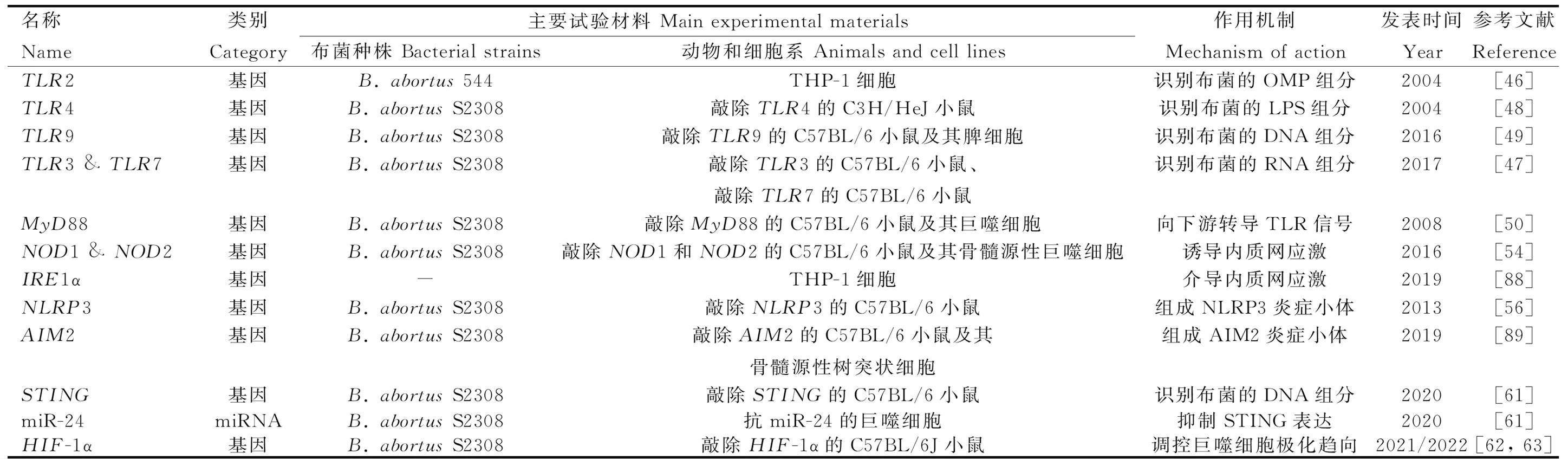
表1 参与免疫和炎症反应激活阶段的基因或ncRNA
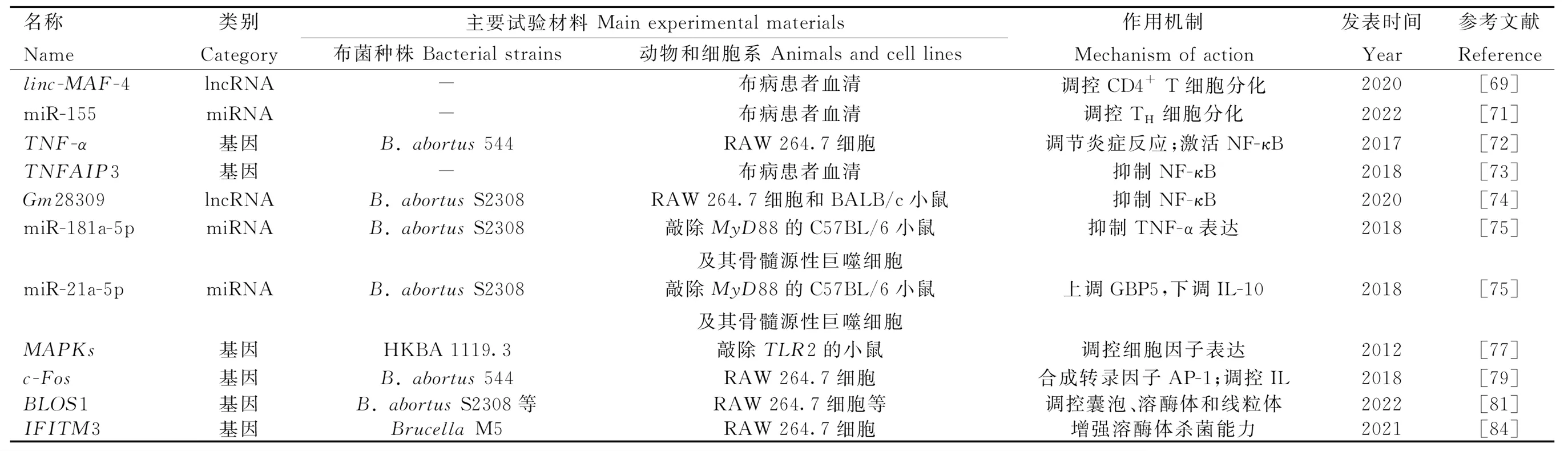
表2 参与免疫和炎症反应效应阶段的基因或ncRNA
2.4.1 参与免疫和炎症反应激活阶段的基因或ncRNA 免疫和炎症反应的激活依赖于模式识别受体(pattern recognition receptors,PRRs)结合病原相关分子模式(pathogen-associated molecular patterns,PAMPs)或损伤相关分子模式(damage-associated molecular patterns,DAMPs)。能识别布菌的PRRs主要分为Toll样受体(toll-like receptors,TLRs)和NOD样受体(NOD-like receptors,NLRs)。
2.4.1.1 Toll样受体:TLRs是跨膜蛋白受体,其抗菌作用最早在1996年被发现于果蝇的真菌感染试验中[44]。迄今为止,在哺乳动物中共鉴定到13种TLRs,能监测多种PAMPs组分[45]。其中,TLR2驻留于质膜,能识别布菌的OMP[46];TLR3和TLR7驻留于内体膜,能识别布菌的RNA[47];TLR4驻留于质膜,能识别布菌的LPS[48];TLR9驻留于内体膜,能识别布菌的DNA[49]。除TLR3外,活化的TLRs均可募集髓样分化因子88(myeloid differentiation factor 88,MyD88)。MyD88是一种胞质可溶性的接头蛋白(adaptor),能将TLR信号向下游的IκB激酶(IKK)复合物和MAPK激酶激酶(MAP3K)转导,促进炎症介质和细胞因子的释放。若敲除小鼠的MyD88,则在感染布菌时,其巨噬细胞产生的TNF-α和IL-12显着减少[50],TNF-α和IL-12是首要的促炎症因子。由B.Melitensis分泌的TIR结构域蛋白(TIR domain-containing proteins,Tcps)称TcpB,TcpB可直接结合MyD88,阻碍TLR依赖于MyD88介导的NF-κB激活,还能诱导未折叠蛋白反应的靶基因表达[51-52]。
2.4.1.2 NOD样受体:NLRs家族是定位于胞浆的模式识别受体,其中,NOD1和NOD2可识别布菌胞壁的肽聚糖组分,通过结合接头蛋白RIP2激活IKK复合物和MAP3K[53]。此外,NOD1和NOD2还是诱导内质网应激的重要介质:布菌在侵入宿主细胞后会通过T4SS释放效应子VceC,触发由内质网应激传感器IRE1α介导的未折叠蛋白反应。其中,IRE1α是内质网跨膜蛋白,可募集TRAF2(TNF-receptor associated factor 2),依赖于NOD1和NOD2激活NF-κB受体[54]。布菌能通过IRE1α轴抑制宿主细胞的自噬[55]。NLRs家族的NLRP3受体蛋白在抗布菌感染中同样发挥重要作用。一般地,NF-κB信号的激活促进NLRP3的表达,NLRP3与凋亡相关斑点样蛋白(ASC)和半胱氨酸天冬氨酸蛋白酶1前体(pro-caspase-1)组装形成的NLRP3炎症小体,同源活化的caspase-1剪切促炎细胞因子IL-1β和IL-18的前体,使其成熟并释放到胞外,增强机体免疫能力[56]。最近的研究完善了该通路,在布菌感染时,IRE1α可诱导活性氧(ROS)依赖性的NLRP3易位到内质网与线粒体连接处,激活caspase-2和BID之间的信号轴,导致线粒体的损伤相关分子模式(DAMP)释放,刺激NLRP3炎症小体合成[57]。这一发现整合了布菌感染过程中内质网应激、线粒体损伤与先天免疫之间的联系。另外,黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)是最近发现的胞内PRR,可识别布菌DNA,由其组装的AIM2炎症小体,同样能增进IL-1β和IL-18的产生[56,58]。
2.4.1.3 其他模式识别受体:除TLRs和NLRs外,在2008年,首次发现了干扰素基因刺激蛋白(stimulator of interferon genes,STING)参与固有免疫应答的信号转导作用[59]。STING位于内质网膜,不仅能作为PRR行使区别于TLR9的“布菌DNA识别作用”,还能充当接头蛋白发挥二级受体结合cGAMP的“布菌DNA传感作用”,激活I型IFN的产生,调控促炎细胞因子通过NF-κB途径介导巨噬细胞的自噬,支持CD8+T细胞的适应性免疫[59-60]。最近,Khan等[61]发现布菌可在感染早期抑制宿主细胞编码STING的Tmem173基因表达,并能诱导靶作用于STING的miR-24产生,增加免疫激活的成本,破坏胞浆监测的机制。在此基础上,Oliveira团队[62-63]的两项研究接连报道了STING通过缺氧诱导因子1α(HIF-1α)调控巨噬细胞在抗布菌感染中的代谢重编程,驱动其向促炎的M1型或抗炎的M2型极化,并指出该过程与IRE1α所介导的内质网应激紧密联系。有关HIF的发现已获得2019年的诺贝尔生理学和医学奖,但其在布病上的研究较少。
只听张小飞大喊一声:“教练,接好了!”他猛地飞起一脚,只见足球在空中翻转了360度,又向下45度直冲过来,最后准确无误地击中了一名高年级同学的腿,那位同学疼得嗷嗷直叫,全场队员却笑得人仰马翻。
2.4.2 参与免疫和炎症反应效应阶段的基因或ncRNA
2.4.2.1 免疫应答:主要组织相容性复合物(major histocompatibility complex,MHC)主要分为MHC I、MHC II和MHC III。经巨噬细胞处理的布菌肽段可由MHC II递呈给CD4+T淋巴细胞中的辅助性T细胞(helper T cell,TH),促进特异性TH的增殖及其淋巴因子(如IFN-γ)的表达,IFN-γ能激活巨噬细胞的杀菌作用,在抗布菌的细胞因子中发挥首要作用;也可由MHC I递呈给CD8+T淋巴细胞,使其活化成细胞毒性T淋巴细胞,杀伤感染布菌的靶细胞[64]。TH细胞包含TH1亚型和TH2亚型,它们分别是介导布菌感染前期细胞免疫和后期体液免疫的优势亚群[65-66]。而控制TH细胞分化方向的关键是cMAF。cMAF是促进CD4+T细胞依赖IL-4向TH2亚型分化的特异性转录因子[67]。在2015年,Ranzani等[68]首次发现linc-MAF-4可抑制cMAF活性。最近,布病患者的血清学检测结果证实,过表达的linc-MAF-4调控CD4+T细胞在感染早期趋向TH1亚型分化[69]。另外,miR-155最近也被证实可调控TH细胞的发育分化来应对布菌感染[70-71]。
2.4.2.2 NF-κB信号通路:由接头蛋白MyD88或RIP2激活的IKK复合物促使NF-κB与抑制因子IκB解聚,暴露出核定位序列,由胞浆转运至核内,启动细胞因子表达。若阻断NF-κB,则显着抑制肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)的表达和分泌。同时,TNF-α也是一种具有调节作用的促炎细胞因子,其与受体TNFR-1的结合能导致IκB泛素化,正反馈于NF-κB途径,减少抗炎细胞因子(如IL-10),增加促炎细胞因子(如活性氧和一氧化氮)[72]。但是,由TNF-α所诱导表达的一种泛素编辑酶A20,也称肿瘤坏死因子α诱导蛋白3(tumor necrosis factor alpha-induced protein 3,TNFAIP3),它能抑制NF-κB活化,该基因座的相关风险变异能增进IL-6和IL-1β产生,在应对布菌感染中发挥保护作用[73]。布菌通过影响巨噬细胞ncRNA的表达可抑制炎症反应的进行。比如,上调的Gm28309(竞争性内源RNA)能充当分子海绵富集miR-3068-5p,以阻止κB-Ras2蛋白的降解,抑制NF-κB的激活[74];miR-181a-5p和miR-21a-5p依赖于MyD88变化,前者上调,抑制TNF-α表达,后者下调,导致抗菌的鸟苷酸结合蛋白5(GBP5)减少和抗炎的IL-10增加[75]。
2.4.2.3 MAPK信号通路:丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路包括MAPK激酶激酶(MAP kinase kinase kinase,MAP3K)、MAPK激酶(MAP kinase kinase,MAP2K)和MAPK。由接头蛋白MyD88或RIP2激活的MAP3K逐级激活MAP2K和MAPK,MAPK家族成员包括ERK1/2、JNK和p38。MAPK级联系统调控免疫和炎症反应,或还影响BCVs的转运与定位。早先,在小鼠巨噬细胞中发现布菌LPS通过限制MAPK信号通路(p38、ERK1/2和JNK)的激活,抑制TNF-α等细胞因子的合成[76]。随后的研究指出,由TLR2诱导的MAPK信号通路(p38和ERK1/2)激活能抑制由TLR9介导的IL-12产生[77]。布菌在人单核细胞内的维持与复制反而依赖于由TLR2介导的MAPK信号通路(p38和JNK)延迟激活[78]。MAPK信号通路可激活转录因子激活蛋白-1(activator protein-1,AP-1),有效促进炎症反应清除布菌。AP-1是由原癌基因c-Fos和c-Jun所编码的蛋白二聚体,其中,c-Fos可通过抑制促炎因子IL-10的产生来限制布菌的生存,但也会负调控TNF-α、IL-6和IL-10等抗炎因子,并且c-Fos还负反馈于TLR4[79]。综上,在响应布菌刺激时,NF-κB与MAPK通路之间密切联系,信号串扰(crosstalk)。
2.4.2.4 其他细胞因子:在布菌胞内寄生的各环节,某些炎症因子可作用于囊泡、溶酶体和内质网来控制感染。例如:1)溶酶体相关细胞器生物发生复合物-1亚基1(biogenesis of lysosome-related organelles complex-1 subunit 1,BLOS1)在线粒体和溶酶体的功能行使以及囊泡和内体的胞内运输中承担重要功能[80]。Wells等[81]发现BLOS1是防御布菌感染的新型免疫因子,而布菌能通过内质网应激途径的IRE1α-RIDD轴定向降解翻译BLOS1的mRNA。 2)干扰素刺激基因家族(interferon-stimulated genes,ISGs)表达的干扰素诱导跨膜蛋白(IFITM3)是先天免疫的关键效应器[82],可介导溶酶体pH降低,有效抑制布菌等多种胞内病原体[83]。经布菌刺激的小鼠巨噬细胞能分泌包含IFITM3的外泌体,广泛地增强微环境中未感染细胞的免疫能力[84]。3)天然抗性相关巨噬蛋白1(natural resistance associated macrophage protein 1,NRAMP1)通过竞争性消耗布菌[85-86]和分枝杆菌[87]等胞内寄生菌繁殖所必需的铁、镁等二价金属离子而发挥抗菌作用。
3 绵羊抗布病育种研究存在的问题
目前,绵羊抗布病育种工作还处于研究阶段,正面临许多问题,如: 1)遗传机制复杂,易受环境因素影响,目前绵羊抗布病性状的遗传力及其与生产性状的相关作用有待评估; 2)筛选指标不明确,目前抗布病性状主要用免疫指标表征,如血清抗体滴度,但将其视作阈性状抑或数量性状还有待研究; 3)主效基因稀缺,目前国内外挖掘出的抗布病候选基因均非主效基因,不足以支撑分子标记辅助选择工作的展开; 4)功能验证困难,布病为二类动物疫病,布菌攻毒试验要求在三级及以上生物安全实验室进行,增加了候选基因下游验证的难度。
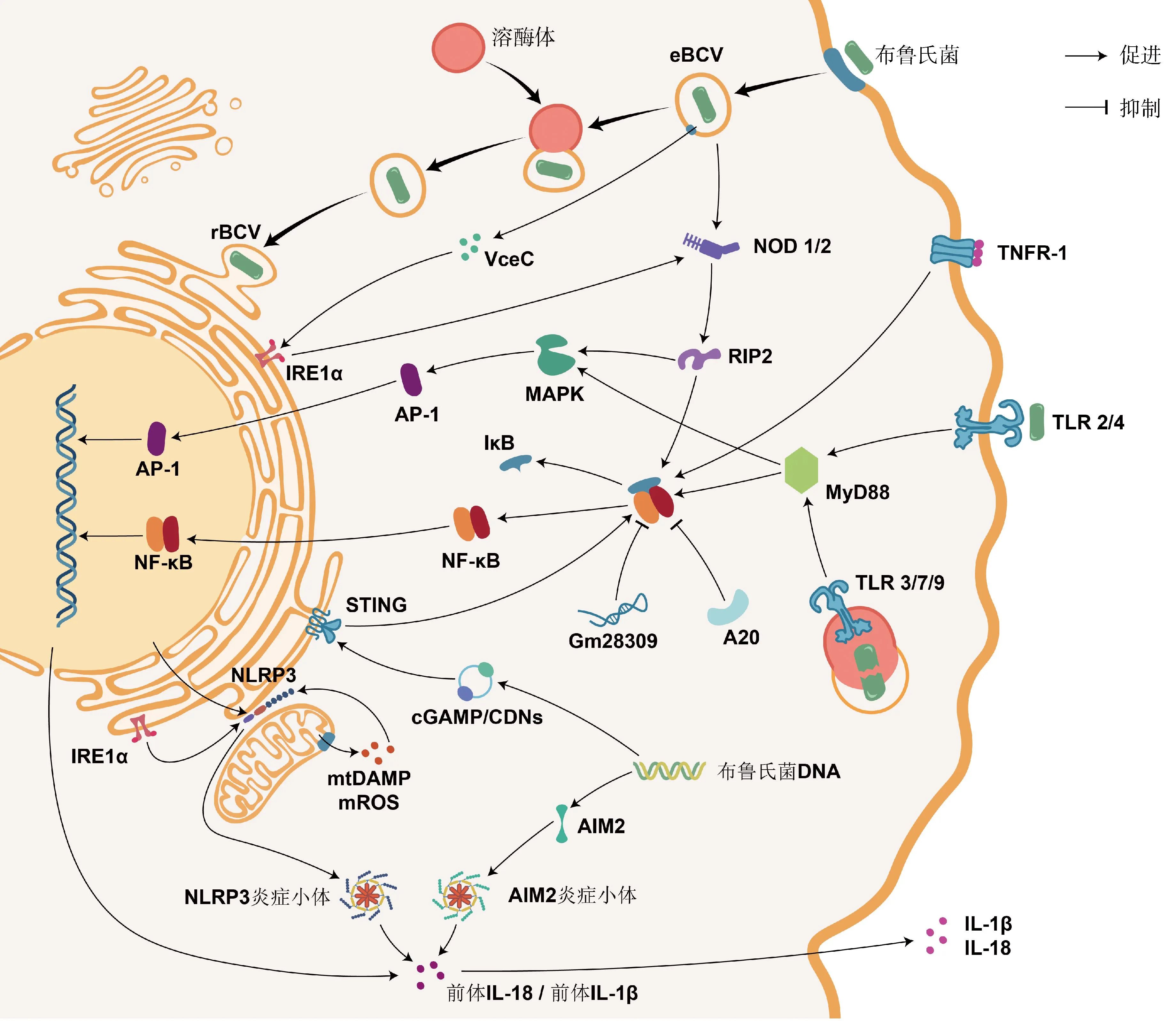
图1 参与免疫和炎症反应的基因或ncRNA及其通路Fig.1 Genes or ncRNAs involved in immune and inflammatory responses and their pathways
4 展 望
机器学习(mechine learning,ML)是人工智能领域近年新兴的分支,适用于数据驱动的科学,能有效处理基因组高维数据信息,在生物育种研究中展现出巨大潜力,为基因挖掘工作提供了全新视角。基于监督机器学习算法,例如决策树(decision tree,DT)、随机森林(random forest,RF)、支持向量机(support vector machines,SVM)和神经网络(neural network,NN)等[90],输入训练集、验证集和测试集数据的基因型特征与抗布病表型标签,建立结合年龄、性别和品种等效应的“基因多态性-抗布病性能”预测模型,以达到根据绵羊基因分型信息预测其抗布病能力表型的目的,实现依据特征值贡献比例筛选有效抗布病突变位点的目标。总之,随着布病研究的深入,布菌的毒力因子作用和免疫逃避机制日渐明晰,越来越多的研究者加入抗布病位点基因的挖掘和验证工作中,相信终将培育出兼顾优良经济性状的抗布病新品种绵羊。



