唐薇薇,郑 洪
(1.遵义医学院 病理生理学教研室,贵州 遵义 563099;2. 遵义医学院附属医院 病理科,贵州 遵义 563099)
RNA干扰survivin对卵巢癌HO-8910PM细胞周期的影响
唐薇薇1,郑 洪2
(1.遵义医学院 病理生理学教研室,贵州 遵义 563099;2. 遵义医学院附属医院 病理科,贵州 遵义 563099)
目的探讨RNA干扰survivin基因对卵巢癌HO-8910PM细胞周期的影响。方法实验分3个组:siRNA组,采用脂质体法将靶向survivin siRNA荧光真核表达质粒载体pGPU6-GFP-survivin-shRNA转染卵巢癌HO-8910PM细胞;空白对照组,单纯细胞培养;阴性对照组,用表达与survivin序列无同源性的siRNA片段质粒pGPU6-GFP-NC转染细胞。于转染后48 h和72 h,用PI单染法流式细胞术检测各组HO-8910PM细胞周期的变化以及Western blot检测survivin 蛋白的表达情况。结果PI单染流式细胞仪检测细胞周期结果表明,与空白对照组和阴性对照组相比较,2个时间点siRNA组转染后的G0/G1期细胞比例明显增加,而G2/M期细胞比例均下降(P<0.05);Western blot结果证实,siRNA组的HO-8910PM细胞survivin蛋白的表达量明显下调。结论导入survivin基因特异性的siRNA可导致卵巢癌HO-8910PM细胞周期阻滞于G0/G1期,细胞增殖受阻,且细胞survivin蛋白表达量下降。
卵巢癌;survivin ;HO-8910PM细胞;细胞周期
恶性肿瘤细胞凋亡和增殖异常的重要原因之一是细胞周期调控异常[1]。史惠蓉等[2]研究发现,卵巢癌组织survivin表达增强并与细胞增殖密切相关。survivin siRNA真核荧光表达质粒载体pGPU6/GFP/Neo/survivin-siRNA是采用DNA重组技术构建的RNA干扰载体,可用于转染肿瘤细胞以阻断survivin基因的表达,而凋亡抑制蛋白survivin主要在恶性肿瘤中高表达,若该基因的表达减弱,则会对肿瘤细胞的增值产生抑制作用,甚至可以促进肿瘤细胞的凋亡[3]。本实验将靶向survivin siRNA真核表达质粒载体转染入卵巢癌HO-8910PM细胞,研究其对该肿瘤细胞周期是否有影响。
1 材料与方法
1.1 细胞株与质粒 卵巢癌HO-8910PM细胞购自南京凯基生物公司。真核表达载体质粒pGPU6-GFP-survivin-shRNA为实验室自行设计构建[4];PGPU6-GFP-NC质粒载体由上海吉玛制药技术有限公司馈赠。
1.2 方法
1.2.1 细胞培养 采用含10%新生牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI1640培养液,于37 ℃、5%CO2细胞培养箱内培养卵巢癌HO-8910PM细胞。
1.2.2 细胞转染 实验分3组:空白对照组(Blank组),用含10%新生牛血清的RPMI1640培养基常规培养细胞;阴性对照组(NC组),采用表达与目的基因survivin序列无同源性的siRNA质粒pGPU6-GFP-NC转染细胞;siRNA组,用含survivin siRNA的pGPU6-GFP-survivin -shRNA质粒转染细胞。各组细胞均接种于6孔板(每孔培养液为2 mL),接种细胞密度为每孔(4~5)×105/mL,每组设三个复孔,细胞种板24 h后进行转染实验,转染步骤按照LipofectamineTM2000说明书要求进行。
1.2.3 PI单染流式细胞仪检测细胞周期 各组分别于细胞转染后48 h和72 h消化、收集细胞,加入含30 g/L BSA的700 mL /L预冷乙醇中, 4 ℃固定24 h,离心1 500 r ×5 min,弃上清,再用预冷PBS液洗细胞两次,离心、弃上清。加50 mg/L的RNase 1 mL,室温避光30 min,离心、弃上清,加入1 mL60 mg/L的PI,室温避光30 min后,流式细胞仪检测细胞周期。
1.2.4 Western Blot 检测转染后survivin 蛋白的表达 培养HO-8910PM细胞并于转染后72 h收集细胞,实验分组及转染步骤同前。用EDTA溶液处理细胞,悬浮细胞,离心收集细胞,细胞沉淀备用。细胞蛋白抽提试剂盒抽提细胞核和细胞浆蛋白,用BCA蛋白浓度测定试剂盒进行蛋白定量后将样品按相同量分装,容积相等。SDS-PAGE凝胶电泳检测survivin蛋白的表达,配置12%分离胶和5%积成胶,跑电泳,转膜,制模,封闭,一抗(survivin兔抗人)孵育,二抗(survivin羊抗兔)孵育,BCA显影。
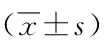
2 结果
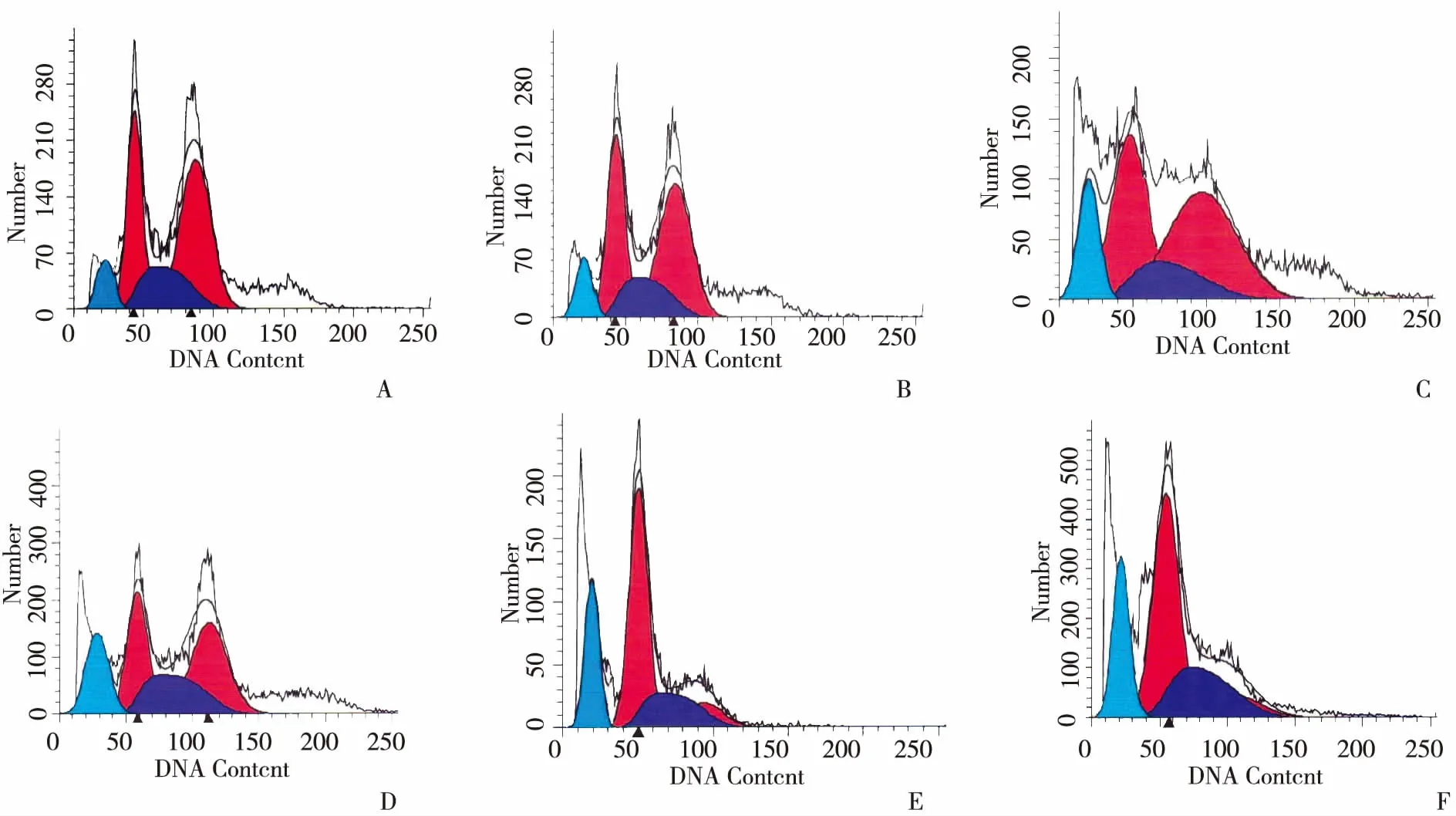
2.1 转染后HO-8910PM细胞周期检测结果 转染后48 h和72 h,siRNA组G0/G1期细胞比例与Blank组比较升高,G2/M期细胞比例与Blank组比较下降,有统计学意义(P<0.05),S期变化不明显,无统计学意义(P>0.05);NC组与Blank组比较,细胞周期无明显差异 (P>0.05,见图1、2)。
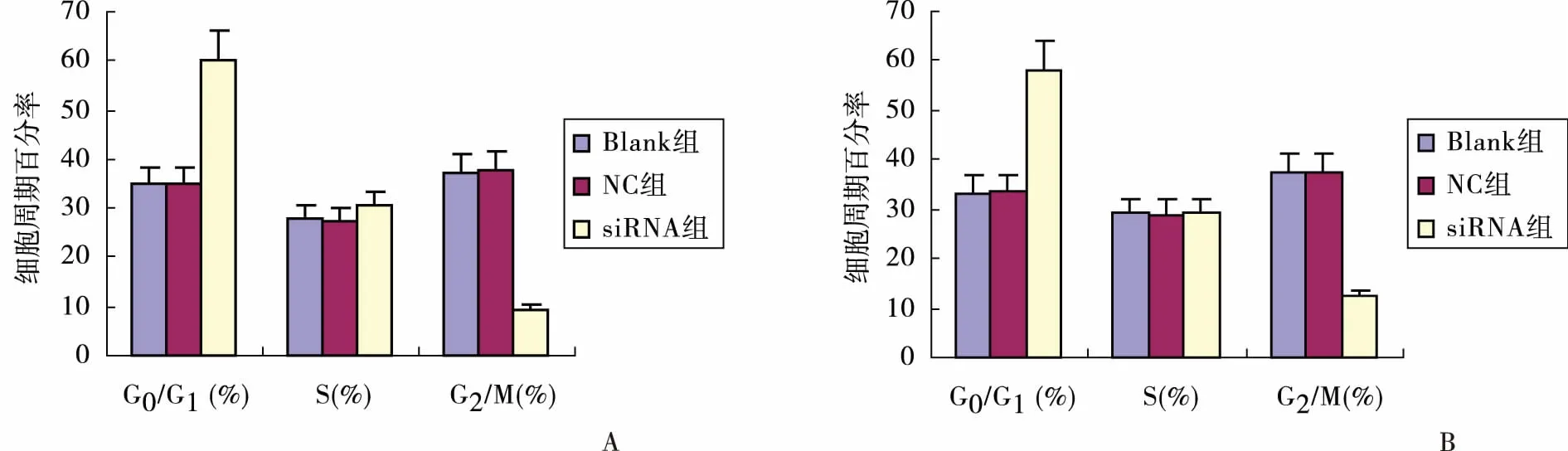
2.2 Western blot检测转染后72 h各组survivin 蛋白表达情况 各组内参β-action 蛋白条带一致,Blank组和NC组survivin蛋白的条带清晰可见,而siRNA组survivin蛋白的条带与对照组比较明显减弱(见图3)。Imagequant图像分析显示,转染72 h后,各组β-action条带平均光密度值相比,无统计学差异(P>0.05),siRNA组survivin蛋白的平均光密度值与Blank组和NC组相比,有统计学意义(P<0.05,见表1)。
表1各组平均光密度值比较

组别β-actionsurvivinBlank组11NC组1.025±0.0111.011±0.013siRNA组1.005±0.0150
注:A:示48hBlank组细比例G0/G1期32.91%,S期 31.16%,G2/M期35.93%;B:示72 hBlank组细胞比例G0/G1期33.43%,S期 27.57%,G2/M期39 %;C:示48 hNC组细胞比例G0/G1期37.26%,S期 26.27%,G2/M期36.47%;D:示72 hNC组细胞比例G0/G1期34.19%,S期 24.82%,G2/M期41%;E:示48h siRNA组细胞比例G0/G1期58.05%,S期30.52%,G2/M期11.40%;F:示72 h siRNA组细胞比例G0/G1期61.76%,S期28.74%,G2/M期9.5%。 图1 转染后各组细胞周期比例
注:A示转染后48 h各组细胞周期情况;B示转染后72 h 各组细胞周期情况。 图2 转染后各组细胞周期情况
图3 转染72h后survivin蛋白的表达情况1.Blank组;2.NC组;3.siRNA组
3 讨论
随着医学的发展,肿瘤的治疗方法也越来越多,但是其发生率和死亡率仍然比较高,其中卵巢癌的死亡率居妇科恶性肿瘤首位,近10年来卵巢癌患者5年生存率仍然徘徊在30%~40%[5]。而survivin蛋白是凋亡抑制蛋白家族(Inhibitor of apoptosis proteins,IAPs)中的一员,通过影响细胞周期对细胞的增殖分化起着重要作用,其在卵巢癌组织中的高效表达,具有强大的抗细胞凋亡和促进细胞增殖的活性[6],它与卵巢癌细胞的生长、侵袭转移及耐药密切相关[7]。且survivin基因的启动子序列中存在3个CDE和1个CHR,可能与survivin的细胞周期依赖性有关,并在G2/M期高表达。因此,特异性的干扰使卵巢癌细胞的细胞周期发生改变,将对肿瘤细胞的增殖抑制具有十分重要的意义。
RNA 干扰( RNA interferens,RNAi),即是指通过外源性或内源性双链RNA( dsRNA)介导细胞内的mRNA 发生特异性降解,以导致靶基因表达沉默,从而产生相应的功能表现型缺失的现象。从被发现以来,已广泛应用于对基因功能、基因诊断以及基因治疗等领域的研究[8]。本实验采用了siRNA技术,将靶向的survivin siRNA荧光真核表达质粒载体转染于卵巢癌HO-8910PM细胞,用PI单染流式细胞仪检测HO-8910PM细胞的细胞周期。从实验结果可看出,siRNA组的HO-8910PM细胞的细胞周期发生了改变,与空白对照组和阴性对照组相比较,其G0 /G1期细胞比例明显增加(72h可达61.76%), G2/M期细胞比例明显减少(72h可降到9.5%)。我们知道,肿瘤细胞的生长分数,即肿瘤细胞群体中处于增殖状态的细胞的比例,是影响肿瘤细胞生长的一个重要因素。处于增殖状态的细胞,不断分裂繁殖,这一过程即细胞周期,分为G1、S、G2和M期,肿瘤细胞处于静止时即称为G0期。那么,根据实验结果可推断,转染了pGPU6- GFP- survivin-shRNA质粒载体的HO-8910PM细胞处于静止期的细胞比例增加了,而进行有丝分裂的细胞比例减少了,细胞的生长与增殖受到明显了抑制。本实验还运用免疫蛋白印迹Western blot方法检测了转染后72h各组survivin 蛋白的表达情况,结果显示,siRNA组细胞survivin蛋白的表达量与空白对照组和阴性对照组比较明显减少了,说明survivin蛋白在HO-8910PM细胞中的复制明显受到影响。
综上所述,本实验室构建的特异性survivin siRNA可有效的抑制人卵巢癌HO-8910PM细胞的增殖,使该细胞的细胞周期发生了改变,并抑制了细胞内survivin蛋白的复制,为以后的临床实验提供了一定的理论基础。
[1] Pietenpol J A , Stewart Z A. Cell cycle checkpoint signaling: Cell cycle arrest versus apoptosis [J]. Toxicology, 2002, 27:475-481.
[2] 史惠蓉,兰莉,乔玉环,等. 卵巢癌组织中Survivin 和PCNA 的表达[J]. 郑州大学学报:医学版,2004,39(4):552- 554.
[3] 刘海威,程乐.脂质体转染survivin反义寡核苷酸对人胰腺癌细胞凋亡的影响[J].中国普外基础与临床杂志,2010,17( 10):1056-1061.
[4] 唐薇薇,郑洪,王琳琳,等.凋亡抑制因子Survivin siRNA 荧光表达载体的构建[J].遵义医学院学报,2008,31(6):565-567.
[5] Jemal A,Siegel R,Xu J,et al.Cancer statistics[J].CA Cancer J Clin,2010,60:277-300.
[6] Fulda S, Vucic D. Targeting IAP proteins for therapeutic intervention in cancer[J].Nat Rev Drug Discov,2012,11(2):109-124.
[7]Xing J, Jia C R, Wang Y, et al. Effect of shRNA targeting survivin on ovarian cancer[J]. J Cancer Res Clin Oncol,2012,Mar 18,[Epub ahead of print]——update.
[8] Suggate E L,Ahmed Z,Read M L, et al. Optimisation of siRNA-mediated Rho A silencing in neuronal cultures[J]. Molecular and Cellular Neuoscience,2009, 40(4) : 451-462.
EffectofsurvivingenesilenceoncellcycleofHO-8910PMovariancancercells
Tangweiwei1,Zhenghong2
(1.Department of Pathophysiology ,Zunyi Medical University, Guizhou Zunyi 563099,China;2. Department of Pathology ,The Affiliate Hospital Zunyi Medical University,Guizhou Zunyi 563099,China)
ObjectiveTo explore the effect of RNA interfered silence of the survivin geng on ovarian cancer HO-8910PM cell cycle.MethodsExperiments were set up three groups: siRNA group, liposome targeting survivin siRNA eukaryotic expression vector pGPU6-GFP- survivin-shRNA transfected ovarian cancer HO-8910PM cells; Blank control group with cultured cells alone ; Negative control group, with the expression of survivin siRNA sequence but? no homology pGPU6- GFP-NC plasmid transfected cells. Forty-eighth and 72h after transfection, the HO- 8910PM cell cycle changes were detected by PI staining flow cytometry method, and the survivin protein expression was detected by Western blot.ResultsCompared with the blank control group and negative control group,PI staining flow cytometry results showed that after transfection of siRNA G0/G1 phase cells increased , while the G2 / M phase cells decreased (P<0.05); Western blot analysis confirmed that in siRNA of HO-8910PM cells, survivin protein expression was significantly reduced.ConclusionImporting survivin gene-specific siRNA can lead to ovarian cancer HO-8910PM cell cycle arrest at G0/G1 phase, cell proliferation blocked, and cellular survivin protein expression decreased.
ovarian cancer; survivin; HO-8910PM cell; cell cycle
R737.31
A
1000-2715(2013)05-0413-04
[收稿2013-07-12;修回2013-09-13]
(编辑:谭秀荣)



