明 钰,熊承良
(1.武汉轻工大学 医学技术与护理学院,湖北 武汉 430023;2.华中科技大学同济医学院 计划生育研究所,湖北 武汉 430022)
目前,对于Atrn生理作用和生化功能的研究主要聚焦于免疫应答,毛发色素形成,能量代谢,髓鞘形成[1-4]等方面。近10年来,我们通过研究发现,Atrn在大鼠睾丸间质和精曲小管中均有分布,在Leydig细胞的表达明显强于睾丸生精细胞[5]。而且,纯合子Atrn无效突变小鼠外周血生殖激素也发生改变[6]。本实验拟用hCG刺激体外培养Leydig细胞,观察其合成分泌睾酮的能力,同时检测AtrnmRNA和Atrn蛋白在此过程中的表达变化,以探讨Atrn在Leydig细胞中的生物学作用。
1 材料与方法
1.1 实验动物 10~12周龄雄性BALB/c 小鼠,体重23~28 g,购于华中科技大学同济医学院实验动物中心。
1.2 实验试剂 Ⅰ型胶原酶(Sigma), DMEM/F12(Gibco), Percoll(Amersham pharmacia biotech), Trizol(Invitrogen),3%~8%NuPAGE®Novex Tris-Acetate Gels(Invitrogen),睾酮检测试剂盒(Cayman),兔抗Atrn多克隆抗体由斯坦福大学医学院遗传研究室Dr.G.S.Barsh和沈士亮博士惠赠。
1.3 实验方法
1.3.1 Leydig细胞的分离和培养 小鼠断颈处死,取出双侧睾丸,剥除被膜、剔除血管,放入含胶原酶的睾丸组织消化液中,37 ℃振荡消化10~12 min(100 rpm/min)。200目筛网过滤,滤液离心后弃上清。细胞沉淀用DMEM/F12培养液重悬混匀,接种于细胞培养瓶,37 ℃培养1 h。吸出细胞悬液,缓慢加于梯度Percoll之上 (试管底部向上依次为70% 、58% 、30% 、10% Percoll液各2 mL),4 ℃800 g离心30 min。收集第3细胞带,PBS洗2次,将细胞密度调至5×105个/mL,接种于6孔培养板。34 ℃培养24 h,经3β-HSD染色鉴定纯度在90%以上时用于实验。
1.3.2 睾酮检测 更换分别含有0,0.1,1,10,100 ng/mL hCG的无血清培养液,34℃继续培养24 h。吸取上清,1500×g离心10 min,用于测定睾酮分泌量。
1.3.3 实时荧光定量RT-PCR检测Leydig细胞AtrnmRNA表达 用Trizol提取细胞总RNA,按试剂盒说明书进行RT反应。Atrn上游引物5'-CTCCTGGTCAGTCAAGGTCTC-3,下游引物5'-TCCTGCCCCAGTATCAAATGC-3',PCR产物长度154bp;β-Actin上游引物5'-GGGAAATCGTGCGTGACAT-3',下游引物5'- TCAGGAGGAGCAATGATCTTG-3',PCR产物长度385bp。反应条件为:95 ℃ 10 min(预变性)后进入循环(40个):95 ℃ 变性 25 s;60 ℃ 退火30 s;72 ℃ 延伸30 s;82 ℃ 8 s采集荧光。PCR结束后,以每秒0.2 ℃的速度(从60~95 ℃升高温度)连续荧光测量做解链曲线。各处理组Leydig细胞AtrnmRNA的量是以其β-ActinmRNA 为内参标准化的相对量。
1.3.4 Western Blot检测Leydig细胞Atrn蛋白表达 Leydig细胞用RIPA裂解液提取。BCA蛋白测定试剂盒检测蛋白浓度。3%~8%NuPAGE®Novex Tris-Acetate Gels电泳分离蛋白,XCell IITMBlot Module转移蛋白至PVDF膜(30 V,1 h)。封闭后,加一抗(工作浓度1∶1000),洗膜后加入二抗。用化学发光试剂盒显示反应条带。Atrn蛋白的相对含量以其胶片上条带光密度与同一泳道中β-Actin蛋白条带光密度的比值表示。
2 结果
2.1 hCG对Leydig细胞睾酮生成量的影响 体外原代培养的小鼠Leydig细胞对hCG的刺激有较好的反应性。刺激24 h后,与0 ng/mL hCG剂量组相比较,0.1,1,10,100 ng/mL hCG剂量组睾酮生成量都明显增加,统计学差异较大(P<0.01),且这种反应表现为剂量依赖性。当hCG刺激浓度大于10 ng/mL时,Leydig细胞睾酮生成量的增加速度趋于平缓(见表1,图1)。


hCG(ng/mL)T(ng/mL)AtrnmRNA/β-ActinmRNAAtrn蛋白/β-Actin蛋白015.1±3.48 0.000707±0.000113 0.043774±0.003219 0.198.21±21.06∗∗0.001135±0.00011∗ 0.07763±0.013551∗∗1153.75±17.64∗∗0.001821±0.00019∗∗0.129672±0.018782∗∗ 10200.39±12.32∗∗0.002179±0.000375∗∗0.159446±0.019441∗∗ 100 213.87±29.73∗∗0.002362±0.000361∗∗0.171152±0.022085∗∗
注:与0ng/mL hCG剂量组相比*P<0.05,**P<0.01。
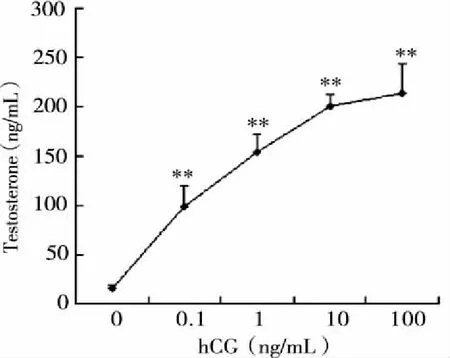
注:Leydig细胞在不同剂量hCG刺激下合成分泌睾酮的量增加,且表现为剂量依赖性(与0 ng/mL hCG组相比较,**P<0.01)。图1 hCG对小鼠Leydig细胞睾酮生成量的影响
2.2 hCG对Leydig细胞AtrnmRNA表达的影响 表1和图2显示,0.1,1,10,100 ng/mL hCG刺激后,Leydig细胞AtrnmRNA表达量增加(0.1 ng/mL hCG组P<0.05 , 其余剂量组P<0.01),且这种反应表现为剂量依赖性。

注:Leydig细胞在不同剂量hCG刺激下,Atrn mRNA表达量增加,且表现为剂量依赖性(与0 ng/mL hCG组相比较,* P<0.05 ,**P<0.01)。图2 hCG对小鼠Leydig细胞Atrn mRNA表达的影响
2.3 hCG对Leydig细胞Atrn蛋白表达的影响 Western blot检测结果(见表1,图3,4)显示,对蛋白条带进行光密度定量分析,0.1,1,10,100 ng/mL hCG刺激后,Leydig细胞Atrn蛋白表达量均增加(P<0.01),且这种反应表现为剂量依赖性(见图4)。

注:Atrn蛋白:160KD;β-Actin蛋白:40KD。图3 各剂量组Leydig细胞Western blot电泳结果
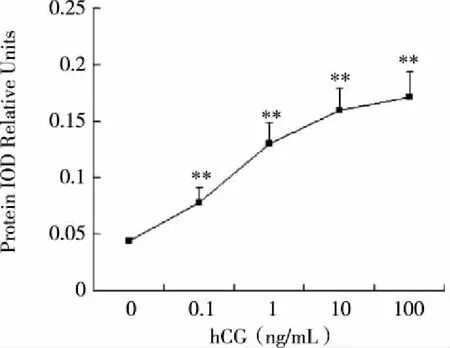
注:Leydig细胞在不同剂量hCG刺激下,Atrn蛋白表达量增加,且表现为剂量依赖性(与0 ng/mL hCG组相比较,**P< 0.01)。图4 hCG对小鼠Leydig细胞Atrn蛋白表达的影响
2.4 hCG调节原代培养小鼠睾丸Leydig细胞AtrnmRNA和Atrn蛋白表达量与睾酮生成量的相关分析 相关分析结果显示,原代培养小鼠睾丸Leydig细胞给予不同剂量hCG,睾酮生成量与Atrn蛋白表达量(r= 0.987,P<0.01)和AtrnmRNA表达量(r= 0.982,P<0.01)呈正相关。
3 讨论
小鼠Atrn基因位于2号染色体,73.9 cM区,包含29个外显子,其mRNA约为9 kb,编码1 428个氨基酸的Ⅰ型跨膜蛋白[7]。AtrnmRNA 分布广泛,它主要高表达于黑色素细胞、皮肤和中枢神经系统,包括脑、心脏、肾、肝、肺、胃和睾丸[5,7-8]。在下丘脑弓状核、内侧视前区、视上核、室旁核等GnRH神经元分布的部位,同时检测到Atrn表达[9- 10],提示Atrn可能参与调节下丘脑、垂体、睾丸的功能。
Leydig细胞存在于睾丸间质组织,是体内雄激素的主要来源。雄激素在诱导雄性性别分化,促进性成熟,维持生殖能力和雄性特征等方面起着重要作用。Leydig细胞合成分泌雄激素的功能除了受到下丘脑和垂体调控外,还受到睾丸局部细胞分泌因子的旁分泌调节。垂体分泌的LH与睾丸Leydig细胞膜受体结合后,激活腺苷酸环化酶,形成环磷酸腺苷(cAMP),cAMP再激活相应的蛋白酶,使底物磷酸化,产生一系列生物学效应,使Leydig细胞以胆固醇为原料合成和分泌睾酮。通过免疫电镜进行Atrn蛋白的亚细胞定位,发现Atrn表达于神经元的细胞膜,神经元和神经胶质细胞的高尔基体膜、内质网膜、线粒体膜上[9-10]。而线粒体和滑面内质网正是Leydig细胞进行合成睾酮过程的主要场所。
本实验结果显示,原代培养的Leydig细胞在hCG刺激下,睾酮生成量、AtrnmRNA和Atrn 蛋白表达量都呈现hCG剂量依赖性的增加,并且睾酮生成量无论是与Atrn蛋白表达量还是和AtrnmRNA表达量都呈正相关。由此我们推测Atrn可能与hCG刺激的睾酮合成分泌存在着联系。但是,本实验尚无法说明是hCG刺激睾酮产生后引起Atrn表达增加,还是Atrn参与了hCG刺激的睾酮合成分泌过程,这有待进一步的研究。
[参考文献]
[1] Duke-Cohan J S, Gu J, McLaughlin D F, et al. Attractin (DPPT-L), a member of the CUB family of cell adhesion and guidance proteins, is secreted by activated human T lymphocytes and modulates immune cell interactions[J]. Proc Natl Acad Sci USA, 1998, 95(19): 11336-11341.
[2] Cota C D, Liu R R, Sumberac T M, et al.Genetic and phenotypic studies of the dark-like mutant mouse[J]. Genesis,2008,46(10):562-573.
[3] Overton J D, Leibel R L.Mahoganoid and mahogany mutations rectify the obesity of the yellow mouse by effects on endosomal traffic of MC4R protein[J].J Biol Chem,2011,286(21):18914-18929.
[4] Kuramoto T, Kitada K, Inui T, et al. Attractin/mahogany/zitter plays a critical role in myelination of the central nervous system[J]. Proc Natl Acad Sci USA, 2001,98(2): 559-564.
[5] Shang X, Liu J, Xu Q, et al.Changes in expression and distribution of attractin in the testes of rats at different developmental stages[J]. Int J Mol Med,2013,32(3): 599-606.
[6] 隋聪, 熊承良, 沈士亮. 敲除Attractin或Mahoganoid基因对雄性小鼠生殖内分泌激素的影响[J].中国计划生育学杂志,2007,15(12):729-731.
[7] Gunn T M, Miller K A, He L, et al. The mouse mahogany locus encodes a transmembrane form of human attractin[J]. Nature,1999,398(6723):152-156.
[8] Gunn T M, Barsh G S. Mahogany/attractin: en route from phenotype to function[J].Trends Cardiovasc Med, 2000,10(2):76-81.
[9] Lu X, Gunn T M, Shieh K, et al. Distribution of Mahogany/Attractin mRNA in the rat central nervous system[J]. Febs Lett, 1999, 462(1-2):101-107.
[10] Nakadate K, Sakakibara S, Ueda S. Attractin/mahogany protein expression in the rodent central nervous system[J]. J Comp Neurol, 2008, 508(1):94-111.



