李永菊,周 涯,陈 超,朱顺飞,胡 燕,秦娜琳,郑 静,徐 林
(1.遵义医学院 免疫学教研室暨贵州省免疫学研究生教育创新基地,贵州 遵义 563099;2.遵义医学院 医学物理学教研室,贵州 遵义 563099)
微小RNA-7(microRNA-7,miR-7)是新近报道的miRNA家族成员,定位于第15号染色体,已有的研究显示其可以广泛参与调节机体生物学活动和临床相关疾病的发生过程,但其在机体整体水平的生物学功能仍待深入研究阐明[1-2]。我们设想通过建立miR-7基因敲减小鼠,以研究动物整体的miR-7抑制后,对机体生物学功能的潜在影响。本文拟构建转基因用的真核表达载体pG-miR-7-Sponge,并通过转染95D细胞鉴定其表达活性,以验证该载体用于下一步miR-7基因敲减小鼠建立的可行性。
1 材料与方法
1.1 材料 人源性肺巨细胞癌细胞株95D,由本实验室保存。限制性内切酶HindⅢ与KpnI和T4 DNA连接酶购自Thermo公司;Stbl3感受态细胞由本实验室保存;质粒抽提试剂盒购自天根生化科技有限公司;MTT、DMSO试剂购自Sigma公司;RPMI 1640培养基购自Hyclone公司;优质胎牛血清购自Solarbio公司;SYBR Premix Ex Taq real-time PCR试剂盒购自TaKaRa公司;eGFP-C2真核表达载体和LipofectamineTM2000转染试剂购自美国Invitrogen公司;分析纯级异丙醇、无水乙醇、甲醛、结晶紫购自重庆川东化工;生化培养基购自苏州净化设备厂;二氧化碳培养箱购自Thermo公司;C1000TM Thermal Cycler Real-Time PCR仪、S1000TM Thermal cycler PCR 仪购自Bio-Rad 公司;TD5A-WS台式低速离心机购自湘仪仪器公司;IX-51倒置显微镜、IX-71倒置荧光显微镜购自OLYMPUS公司;DNA合成由赛业生物科技有限公司完成和测序由上海生物工程有限公司完成。
1.2 方法
1.2.1 miR-7靶序列的设计与合成 选取miRBase 数据库上小鼠成熟miR-7a-5p序列,根据碱基互补原则设计其反义序列,去掉前两个碱基后在第12-14个碱基处突变为不互补碱基,并将第15个碱基处凸出,将6个拷贝互补靶序列串联,每个拷贝之间由“CGCG”连接,该序列两端加入酶切位点Hind Ⅲ与Kpn I,组成miR-7 Sponge片段(见图1)。由赛业生物科技有限公司分别合成正义链和反义链。

1.2.2 重组质粒pG-miR-7-Sp的构建与鉴定正义链和反义链寡核苷酸片段溶解及退火配成双链,其反应体系为:200 μmol/L正义链寡核苷酸 5 μL,200 μmol/L反义链寡核苷酸5 μL,10×寡核苷酸退火缓冲液2 μL,ddH2O 8 μL,总体积20 μL。其反应条件为:95℃加热5 min,放置室温冷却10 min,形成双链寡核苷酸。用Hind Ⅲ/ Kpn I双酶切骨架载体pEGFP-C2、目的基因miR7- Sponge,回收片段,过夜连接。连接反应体系:10×T4 Ligase buffer 2 μL,目的基因(Hind Ⅲ+ Kpn I)0.03 pmol,PEGFP(Hind Ⅲ+Kpn I)0.3 pmol,T4 DNA Ligase 1 μL,加ddH2O至20 μL。反应条件:16 ℃过夜。转化连接产物到Stbl3感受态细胞。随机挑取克隆摇菌,菌液PCR鉴定阳性克隆(上游引物:5‘-ACGTAAACGGCCACAAGTTC-3’,下游引物:5‘-GATCTTGAAGTTCACCTTGATGC-3’),并小量提取质粒,用Hind Ⅲ/ Kpn I双酶切鉴定,阳性质粒命名为pG-miR-7-Sp,并送上海生物工程有限公司测序,并用Chromas软件将测序所得到的序列与原设计寡核苷酸序列进行比对分析。
1.2.3 细胞培养与重组质粒转染 人肺癌细胞株95D细胞,用含10%胎牛血清、1000 μ/mL青霉素、100 mg/mL链霉素及2 mmol/L谷氨酰胺的RPMI 1640细胞培养液,于37 ℃、CO2体积分数为5%条件下培养95D细胞。在6孔板中培养24 h后细胞达到90%~95%融合度时,采用脂质体LipofectamineTM2000分别转染eGFP-C2-Control和pG-miR-7-Sp。具体操作步骤按LipofectamineTM2000说明书进行。转染36h后,用倒置荧光显微镜观察GFP的表达计算转染效率。
1.2.4 Real-time PCR检测细胞中miR-7的表达 收集转染48 h后的细胞,用TRIzol试剂抽提总RNA。采用miR-7反转录引物对RNA样品进行转录,利用Real-Time法对样品中miR-7表达水平进行检测和比较分析。通过iCycler iQTMReal-Time PCR Detection System 进行定量分析。内参基因GAPDH逆转录反应体系及条件按试剂盒说明书操作,Real-Time PCR 反应体系及条件:2×SYBR®Premix Ex TaqTM10 μL,ddH2O 8 μL,cDNA 1 μL,PCR Forward Primer 0.5 μL,PCR Reverse Primer 0.5 μL,95 ℃预变性30s,95 ℃ 15 s, 60 ℃ 60 s,40个循环,获取荧光信号温度为84 ℃,以排除引物二聚体的干扰;miR-7逆转录反应体系及条件按试剂盒说明书操作,Real-Time PCR 反应体系及条件:Premix Ex Taq Version2.0 10 μL, ddH2O 8μL,cDNA 1μL,20×TaqMan®Small RNA Assay 1 μL,95 ℃预变性30 s,95 ℃ 15s, 60 ℃ 60 s,40个循环,获取荧光信号温度为60 ℃。在扩增结束后对每对引物的扩增产物在2%的凝胶上进行电泳分析确定扩增产物的特异性和灵敏度。miR-7的表达量以GAPDH为内参,采用2-△△Ct方法计算。miR-7反转录条件:16℃、30 min;42℃、30 min;85℃、30 min;4℃保存。GAPDH反应条件 :42 ℃、1 h;70 ℃、10 min;4 ℃保存。实验步骤:取EP管,依次加入RNA样品 7.5 μL、寡核苷酸 1 μL、DEPC处理后的水 3.5 μL,轻轻混匀,置于PCR仪上65 ℃ 5 min,之后立即取出,冰浴2 min以上;再加缓冲液3 μL、10 mmol/L dNTP 2 μL,混匀,冰浴5 min后,于PCR仪上进行逆转录。分别利用探针法和用SYBR-Green荧光染料法于Real-Time PCR仪检测miR-7和GAPDH的表达,miR-7上游引物:5’-ACA- -CTCCAGCTGGGTCGTACCGTGAGTAAT-3’,下游引物:5’-TGGTGTCGTGGAGGAGT- -C-3’;GAPDH上游引物:5’-GAAGGTCGGAGTCAACGGATT-3’,下游引物:5’-ATGGGTG- -GAATCATATTGGAA-3’。 miR-7反应条件如上所述。GAPDH反应条件:95 ℃、10 min, 95 ℃、15 s,60 ℃、1 min,共50个循环,84℃采集荧光信号,反应完成后,绘制溶解曲线。
1.2.5 MTT实验检测95D细胞的增殖 取对数生长期的95D细胞制备成单细胞悬液,调整细胞密度至1×104/mL,接种于96孔培养板,每孔加100 μL,设立eGFP-Control和pG-miR-7-Sp组,每组细胞设6个复孔。转染48 h后,每孔加入5 mg/mL的MTT 20 μL,继续培养4 h,弃孔内培养液,每孔加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),振荡10 min,待结晶物充分溶解后,酶标仪检测570 nm处各孔吸光度(OD)值。对数据进行统计学分析。
2 结果
2.1 克隆PCR鉴定 目的基因与载体的连接产物经转化感受态细胞(见图2),Amp抗性筛选培养12 h后随机挑取4个克隆,分别培养16 h。经菌液PCR和2%琼脂糖电泳鉴定,可见约440bp大小的目的条带(见图3),提示所挑取的4个克隆均为阳性克隆。
图2 质粒pG-miR-7-Sp示意图
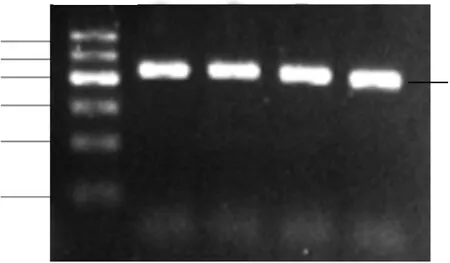
注:M:100bp DNA Ladder;1-4:分别为1号,2号,3号,4号克隆菌液PCR。 图3 pG-miR-7-Sp克隆PCR鉴定
2.2 pG-miR-7-Sp质粒的酶切与测序鉴定 将阳性克隆进行质粒抽提,抽提的重组质粒用Hind Ⅲ和Kpn I双酶切。2.0%琼脂糖凝胶电泳后,可观察到约170 bp大小的目的条带(见图4)。将酶切鉴定为阳性的质粒送测序,测序结果显示与预期结果一致(见图5)。
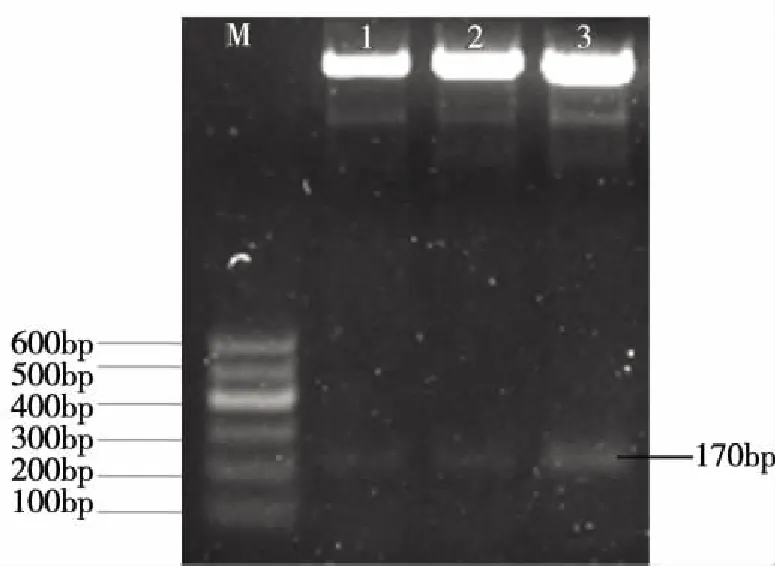
注:M:100bp DNA Ladder;1-3:分别为1号,2号,3号克隆质粒。 图4 pG-miR-7-Sp质粒KpnI/ HindⅢ双酶切鉴定

注:1号质粒DNA测序结果。图5 pG-miR-7-Sp质粒测序结果
2.3 pG-miR-7-Sp转染后对95D细胞中miR-7表达的影响 pG-miR-7-Sp转染95D细胞,48 h后倒置荧光显微镜观察95D细胞的转染效率。结果显示两组中GFP阳性细胞比例均约40%(见图6A);进一步利用 Real-time PCR特异性探针法检测了各组细胞中miR-7成熟体的表达水平。结果显示,与对照组相比,pG-miR-7-Sp转染组中miR-7成熟体的表达水平明显较低(P<0.05,见图6B),提示pG-miR-7-Sp转染组中miR-7成熟体存在部分降解。
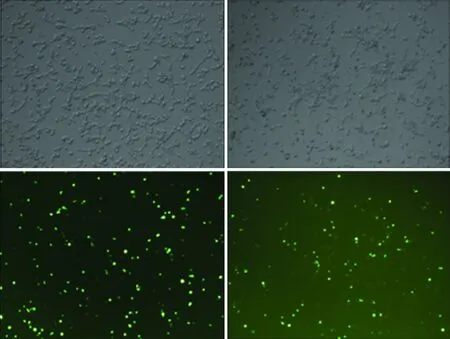
注:A:pG-miR-7-Sp与eGFP-Control转染组分别在白光和荧光镜下示意图;B:Real-time PCR检测miR-7相对表达量(P<0.05)。 图6 pG-miR-7-Sp瞬时转染95D细胞后GFP(A)与miR-7(B)的表达
2.4 pG-miR-7-Sp转染后对95D细胞增殖的影响 进一步光镜下观察发现,pG-miR-7-Sp瞬时转染95D细胞72 h后,细胞数明显多于eGFP-Control对照转染组;MTT实验结果显示,转染72h后pG-miR-7-Sp转染组OD570值为0.65±0.03,而对照组的OD570值为0.42±0.03。提示,pG-miR-7-Sp转染组95D细胞的增殖能力明显增强(P<0.05)。
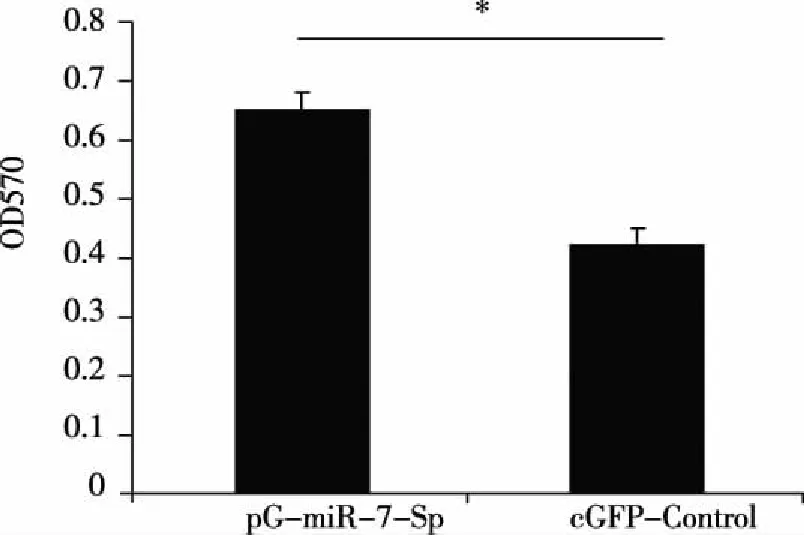
注:pG-miR-7-Sp与eGFP-Control转染组95D细胞在OD570处平均光密度值(P<0.05)。 图7 瞬时转染pG-miR-7-Sp对95D细胞增殖的影响
3 讨论
miR-7是新近报道的miRNA家族成员之一,大量研究显示,miR-7可能通过作用于不同的靶标分子参与机体生长发育或多种疾病的发生发展[1,3-5]。如miR-7通过调节KFL-4抑制乳腺癌干细胞样细胞的脑转移[1]。Yu等[5]还发现miR-7抑制组蛋白甲基转移酶SET8 (SET domain containing 8),可使乳腺癌细胞的侵袭能力下降,对DNA损伤更敏感。我们之前的研究也发现人肺癌细胞95D中,miR-7可以显着抑制胰岛素样生长因子受体1(insulin-like growth factor 1 receptor ,IGF1R)的表达,从而降低其下游信号分子AKT的磷酸化水平及其体外侵袭能力[6]。此外,miR-7沉默人表皮生长因子受体(epidermal growth factor receptor, EGFR) /磷脂酰肌醇-3-激酶(phosphoinositide-3-kinase, PI3K)通路可以逆转脑胶质瘤U251细胞的恶性表型[7]。另外,最近的研究显示,miR-7在正常脑组织中特异性高表达,并且敲除miR-7可以改变斑马鱼的大脑发育[2]。小鼠是研究人类生命科学的重要的实验工具,且miRNA具有种属保守性。然而,目前尚未有在小鼠整体水平上观察miR-7功能的研究。
成熟的miRNA长度大约22个碱基,对于这些小分子RNA功能的研究,目前已有一系列功能获得性(gain-of-function)和功能缺失性(loss-of-function)研究手段。对于功能缺失性研究而言,可以通过转染外源性miRNA反义抑制剂,如,修饰的反义寡核苷酸,能最特异的抑制miRNA;LNA修饰的oligo能与miRNA高亲和力结合,提供强烈的抑制作用。但这些方法存在亲和力低、脱靶效应或降解等问题,且只能用于瞬时转染细胞。在小鼠等动物模型中,观察整体水平上miRNA功能下调的效应,必须稳定抑制miRNA。Phillip等人[8]根据miRNA自身特点和功能特点开发出的miRNA海绵技术,实现了对特定miRNA的稳定抑制。其原理在于串联多个miRNA靶位点(target)的序列,能与miRNA的天然靶标竞争结合miRNA分子,隔离细胞中有活性的miRNA,从而可以对特定miRNA及含有相同种子序列的miRNA家族进行功能缺失性研究[8]。该技术通过构建到含有启动子的真核表达载体上,可以在细胞甚至动物水平上长效抑制miRNA的表达或功能。尤其是,最新的研究发现机体内可能存在一种环状大RNA,发挥类似miRNA海绵的作用[9]。Hansen等人[10]则明确指出miR-7的功能活性可受这种RNA抑制。因此,本课题组拟采用sponge技术研究miR-7下调表达对动物整体水平上生物学功能的影响。
本实验首先应用“海绵”的构建策略,通过设计与miR-7结构不完全互补的Sponge序列,构建到具有强启动子、及带有绿色荧光蛋白eGFP标志的真核表达载体pEGFP-C2上,并以菌液PCR、质粒酶切、鉴定出阳性质粒pG-miR-7-Sp,质粒测序分析目的基因的正确性。其次,将成功构建的pG-miR-7-Sp载体体外瞬时转染人肺癌细胞株95D细胞,在荧光显微镜下观察到pG-miR-7-Sp载体标记蛋白GFP在真核细胞中的表达,提示载体启动子可有效启动miR-7-Sponge的表达。重要的是,Real-time PCR检测发现95D细胞中miR-7表达的显着下降,提示载体表达的miR-7-Sponge可有效下调miR-7的表达。本课题组的前期研究发现,miR-7能显着促进人肺源性癌细胞95C或95D细胞的体外增殖能力[11-12]。与之一致的是,本实验中我们最后观察到pG-miR-7-Sp转染后细胞增殖能力增强。可以推测这与真核表达载体pG-miR-7-Sp能功能性下调miR-7表达从而促进95D细胞的增殖有关。
总之,本实验成功构建了真核表达载体pG-miR-7-Sp,并可在真核细胞中能有效表达miR-7-sponge序列,发挥基因敲减的作用,这为后续miR-7基因敲减小鼠模型的建立提供了前期实验基础。
[参考文献]
[1] Choudhury N R, de Lima Alves F, de Andrés-Aguayo L,et al.Tissue-specific control of brain-enriched miR-7 biogenesis[J]. Genes Dev, 2013,27(1):24-38.
[2] Okuda H, Xing F, Pandey P R, et al.miR-7 suppresses brain metastasis of breast cancer stem-like cells by modulating KLF4[J]. Cancer Res, 2013, 73(4):1434-1444.
[3] Li Y J, Wang C H, Zhou Y,et al.TLR9 signaling repressed tumor suppressor miR-7 expression through up-regulation of HuR in human lung cancer cells[J]. Cancer Cell Int, 2013,13(1): 90.
[4] Xu L, Wen Z, Zhou Y,et al. MicroRNA-7-regulated TLR9 signaling-enhanced growth and metastatic potential of human lung cancer cells by altering the phosphoinositide-3-kinase, regulatory subunit 3/Akt pathway[J]. Mol Biol Cell, 2013, 24(1): 42-55.
[5] Yu N, Huangyang P, Yang X,et al.microRNA-7 suppresses the invasive potential of breast cancer cells and sensitizes cells to DNA damages by targeting histone methyltransferase SET8[J]. J Biol Chem, 2013, 288(27): 19633-19642.
[6] 徐林,任涛, 秦安东, 等. microRNA-7对人肺癌95D细胞体外侵袭的作用[J]. 遵义医学院学报, 2011, 34(1):12-16.
[7] 刘晓智, 姜忠敏, 陈镭, 等. miR-7沉默EGFR/PI3K通路可以逆转脑胶质瘤U251细胞的恶性表型[J]. 肿瘤, 2011, 31(11): 987-992.
[8] Ebert M S,Neilson J R,Sharp P A. MicroRNA sponges: competitive inhibitors of small RNAs in mammalian cells[J]. Nat Methods,2007,4(9):721-726.
[9] Memczak S, Jens M, Elefsinioti A,et al.Circular RNAs are a large class of animal RNAs with regulatory potency[J]. Nature,2013, 495 (7441):333-338.
[10] Hansen T B, Jensen T I, Clausen B H,et al.Natural RNA circles function as efficient microRNA sponges[J]. Nature, 2013, 495(7441):384-388.
[11] 徐林,任涛,周涯,等.微小RNA-7对人肺癌95D细胞体外增殖的作用[J]. 肿瘤,2010,30(9): 763-767.
[12] 宋永祥, 李颖, 秦安东, 等. miRNA-7真核表达载体的构建与鉴定[J]. 西安交通大学学报:医学版,2013,34(4):454-459.



