田 昕,李 宁,李 冉
(遵义医学院附属肿瘤医院 胸部肿瘤科,贵州 遵义 563099)
肺癌是全球最常见的恶性肿瘤,目前缺乏简单有效的早期检查方法,因此,约2/3的患者确诊时已经出现远处转移,无手术机会,化疗是其主要的治疗手段,化疗耐药是亟待解决的问题。肿瘤耐药是多因素参与的过程,其生物化学机制有很多,DNA修复机制是目前研究较多的机制之一,核酸切除修复(nucleotide excision repair,NSE)为DNA修复的限速步骤,ERCC1为NES中DNA损伤识别和链间切割的关键基因,ERCC1表达上调可致肿瘤细胞DNA修复加快,导致耐药[1]。细胞因子活化的杀伤细胞被认为是新一代肿瘤过继治疗的首选方案之一。近年来,有学者发现CIK能逆转肿瘤耐药,其逆转耐药的机制涉及了多种蛋白质及通路的改变, ERCC1作为介导耐药的重要基因,是否也能被CIK所改变从而实现耐药的逆转,是我们需要思考的问题。因此,本研究通过在体外用CIK作用于A549/DDP细胞,检测其ERCC1 mRNA及蛋白的表达情况,与未予CIK干预组进行比较,明确CIK对A549/DDP细胞耐药的逆转作用,并探讨这种逆转作用是否与ERCC1有关。
1 材料与方法
1.1 主要实验材料
1.1.1 实验细胞 A549细胞和 A549/DDP细胞购自中国医学科学院肿瘤细胞库。
1.1.2 主要试剂及仪器 iMarkTMMicroplate Reader、
MINI电泳系统、Chemi DosXRS电泳凝胶成像分析系统,BIO-RAD公司;ND-2000核酸蛋白测定仪,Thermo公司;注射用顺铂(冻干型),齐鲁制药有限公司;MTT,solarbio公司;抗人CD3单克隆抗体、IFN-γ、IL-2,sigma-aldrich 公司;IL-1α,prospec公司;人淋巴细胞分离液,天津灏洋生物制品科技有限责任公司;RNAiso Plus、Real-Time RT-PCR反转录试剂盒,Takara公司;ERCC1 Rabbit Antibody,Cell Signaling Technology公司;Rabbit Anti-beta Actin Monoclonal Antibody,Beyotime公司;山羊抗兔IgG/辣根酶标记,中杉金桥生物技术有限公司,BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒,Beyotime公司。PCR引物,由TaKaRa公司合成(见表1)。
表1基因引物序列
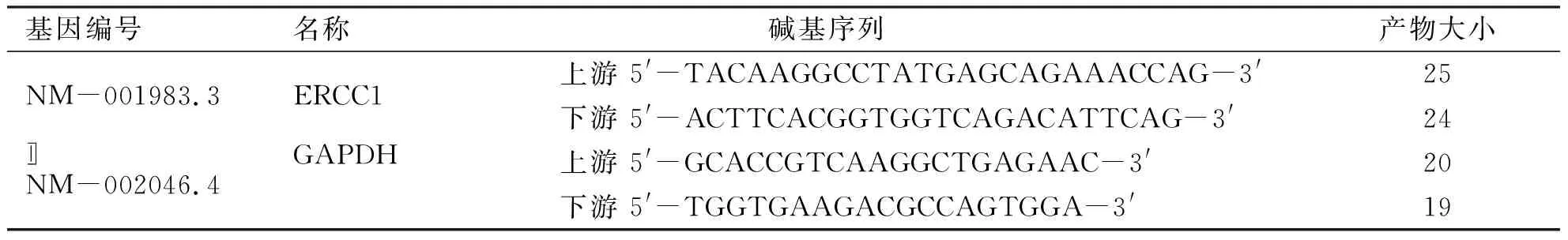
基因编号 名称 碱基序列产物大小NM-001983.3ERCC1上游 5'-TACAAGGCCTATGAGCAGAAACCAG-3'25下游 5'-ACTTCACGGTGGTCAGACATTCAG-3'24NM-002046.4GAPDH上游 5'-GCACCGTCAAGGCTGAGAAC-3'20下游 5'-TGGTGAAGACGCCAGTGGA-3'19〛
1.2 方法
1.2.1 A549及A549/DDP细胞的培养 A549细胞及A549/DDP细胞均采用改良型RPMI-1640培养基,向其中加入胎牛血清及青链霉素配制的双抗,置于37 ℃,5%CO2孵箱中培养。0.25%胰蛋白酶消化传代。
1.2.2 CIK细胞的诱导及培养 于我院产科手术室无菌条件下采集脐血约50 mL,肝素抗凝,于超净台内将脐血缓慢加入到盛有人淋巴细胞分离液的离心管中,脐血与人淋巴细胞分离液的比例约为2∶1,放入低速冷冻离心机中离心2 000 r/min,25 min。然后吸取中间白膜层,加入5倍体积PBS重悬细胞,1 500 r/min,10 min,洗涤细胞,最后以含5%AB型血清的RPMI-1640培养液重悬细胞,调整细胞数,分装入培养瓶中,在第0天向其中加入IFN-γ,使其终浓度为1 000 U/mL,第1天加入抗人CD3单克隆抗体、IL-1α、IL-2,使其终浓度分别为5 μL/106个细胞、100、300 U/mL。之后每3 天更换新鲜培养液,同时补加IL-2,并调整细胞浓度。置于37 ℃,5%CO2孵箱中培养,2周后收获细胞。
1.2.3 MTT法检测耐药逆转倍数 ①取对数生长期的A549/DDP细胞,制成单细胞悬液,调整细胞浓度为1×104个/mL,以每孔100 μL接种于96 孔培养板,置于37 ℃,5 % CO2培养箱中培养过夜。次日早上向其中加入CIK细胞,效靶比分别为5∶1;10∶1;20∶1;40∶1;80∶1,每组设6个复孔,同时设对照组和调零组(对照组不加CIK细胞,加等体积培养液,调零组不接种细胞,余步骤与实验组相同)置37 ℃,5 % CO2培养箱中培养24 h后,酶联免疫检测仪OD490 nm处测量各孔吸光度值,通过线性回归计算出IC10值。②分别取对数生长期的A549及A549/DDP细胞,制成单细胞悬液,调整细胞浓度为1×104个/mL,以每孔100μL接种于96 孔培养板,其中, A549/DDP细胞接种于2个96 孔培养板,设置调零孔,不加细胞,加入等体积培养液。置于37 ℃,5 % CO2培养箱中培养过夜。次日向已接种A549细胞 及1个A549/DDP细胞的96 孔培养板中加入不同浓度的顺铂(0.5、1、2、4、8、16、32 μg/mL),各100 μL,每个浓度设置6个复孔,对照孔加入无菌PBS,置37 ℃,5 % CO2培养箱中培养24 h后,每孔加入MTT20 μL,置孵箱中孵育4 h,终止培养,弃去上清液,每孔加150μLDMSO,低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪OD490nm处测量各孔吸光度值,计算抑制率(inhibition,IR)和耐药指数(resistance index,RI)。IR=[1-(用药组OD值-空白对照组OD值)/(对照组OD值-空白对照组OD值)]×100%;RI=耐药细胞株IC50值/敏感细胞株IC50值;药物半数抑制浓度(50% inhibitory concentration,IC50)通过药物对细胞的抑制率和药物浓度的对数作图求出。③另一个接种A549/DDP细胞的96孔培养板,于次日加入CIK(通过预实验,计算出CIK的IC10效靶比为10.44∶1,故设定效靶比为10∶1,作为无毒剂量逆转耐药)。作用24 h后再加入不同浓度顺铂,对照组不加CIK,加等体积培养液,测其OD值,计算逆转倍数(reversal fold,RF)=耐药株IC50(不加CIK)/耐药株IC50(加CIK)。
1.2.4 Real time PCR检测ERCC1 mRNA表达 收集对数生长期的A549细胞、A549/DDP细胞,制成细胞悬液,以每孔2.5mL体积接种至6孔培养板中,置37 ℃,5 % CO2培养箱中培养。显微镜下观察细胞长满孔底时,向A549/DDP细胞的3个孔中加入无毒剂量的CIK细胞(效靶比为10∶1),其余各孔加入等体积培养液,继续培养24h。加Trizol裂解细胞,再向各管加100 μL三氯甲烷,震荡后于4 ℃,12 000 r/min离心15 min,吸取上清液至新的去酶EP管中,加入等体积异丙醇,轻微振匀,静置5 min后于4 ℃,12 000 r/min离心10 min,离心后RNA形成白色乳胶状沉淀沉于管底。弃去上清,将EP管倒置于滤纸上,空干,各管加入75%乙醇清洗RNA沉淀,重复2次。室温空干,加入DEPC水溶解RNA,核酸蛋白测定仪检测RNA浓度。分别取少量RNA母液,均用DEPC水稀释至50 ng/μL,按20 μL反应体系逆转录成cDNA,-80℃保存备用。 cDNA样品配置15 μL实时定量 PCR反应体系,置于Real-time PCR仪上进行PCR扩增反应,反应条件为:95 ℃ 2min预变性,然后按95 ℃ 15 s,60 ℃ 45 s,共40做个循环;95 ℃ 1 min,最后55 ℃ 14 min。
1.2.5 Western blot检测ERCC1蛋白表达 A549/DDP细胞消化后进行细胞计数,调整两瓶细胞数一致,向其中一个培养瓶中加入无毒剂量的CIK细胞(效靶比10∶1),另一培养瓶加等体积培养液,继续培养24 h,PBS洗涤细胞3遍,吸干液体后每瓶加入400 μL含PMSF的细胞裂解液,冰上裂解30 min,然后用细胞刮和微量加样器将裂解液移至EP管中,离心,4 ℃,12 000 r/min,5 min,最后将上清液转移至新的EP管中,-80 ℃保存备用。重复上述方法收集蛋白样本,采用BCA蛋白浓度测定试剂盒测定蛋白浓度。根据SDS-PAGE凝胶配制试剂盒取说明配胶,取蛋白上样量为50 ng,进行电泳、转膜、封闭、孵育一抗和孵育二抗,最后采用凝胶成像系统曝光。
1.2.6 所有试验均重复3次。
2 结果
2.1 CIK细胞对A549/DDP细胞的杀伤作用 CIK细胞分别以5∶1;10∶1;20∶1;40∶1;80∶1的效靶比作用于A549/DDP细胞,作用24 h后通过MTT计算出CIK细胞对A549/DDP细胞的抑制率(见表2),随着效靶比的增加,其抑制作用逐渐增强。通过线性回归计算出CIK对A549/DDP细胞的IC10效靶比为10.44∶1。
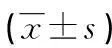

CIK:A549/DDP抑制率5∶110∶120∶140∶180∶10.045±0.0110.090±0.0110.197±0.0210.389±0.0370.520±0.030
2.2 顺铂对各组细胞的抑制作用 顺铂对各组细胞的抑制率(见表3)。MTT数据表明,在不同浓度顺铂作用24 h后,抑制率呈浓度依赖性增加。DDP对A549细胞的抑制作用较A549/DDP 细胞更为显着,两组相比差异有统计学意义(P<0.05)。加效靶比为10∶1的CIK预处理的A549/DDP细胞与不加CIK的A549/DDP细胞相比,DDP对前者的抑制作用更强,差异有统计学意义(P<0.05)。以DDP对细胞的抑制率和顺铂浓度的对数值进行线性回归,求出DDP对A549细胞、A549/DDP细胞及加CIK干预的A549/DDP细胞的IC50值分别为3.980、9.518、2.399 μg/mL,进一步计算出RI(耐药指数)=2.391,RF(逆转倍数)=3.967。
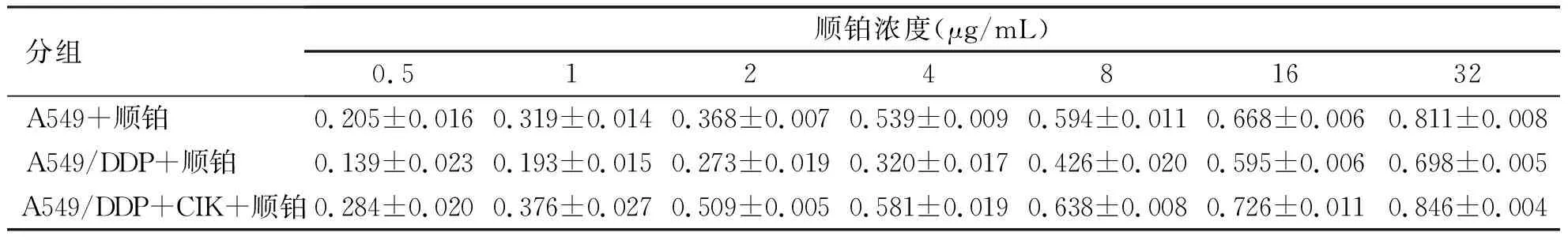
分组顺铂浓度(μg/mL)0.512481632A549+顺铂0.205±0.0160.319±0.0140.368±0.0070.539±0.0090.594±0.0110.668±0.0060.811±0.008A549/DDP+顺铂0.139±0.0230.193±0.0150.273±0.0190.320±0.0170.426±0.0200.595±0.0060.698±0.005A549/DDP+CIK+顺铂0.284±0.0200.376±0.0270.509±0.0050.581±0.0190.638±0.0080.726±0.0110.846±0.004
2.3 Real time PCR检测A549细胞、A549/DDP细胞以及CIK干预后的A549/DDP细胞中ERCC1 mRNA的表达情况 不同细胞中ERCC1 mRNA相对表达量(见表4)。A549细胞与A549/DDP细胞相比ERCC1 mRNA相对表达量明显降低,差异有统计学意义(P<0.05)。CIK干预组A549/DDP细胞与未加CIK的A549/DDP细胞相比,ERCC1 mRNA表达量稍降低,差异无统计学意义(P>0.05)。
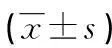
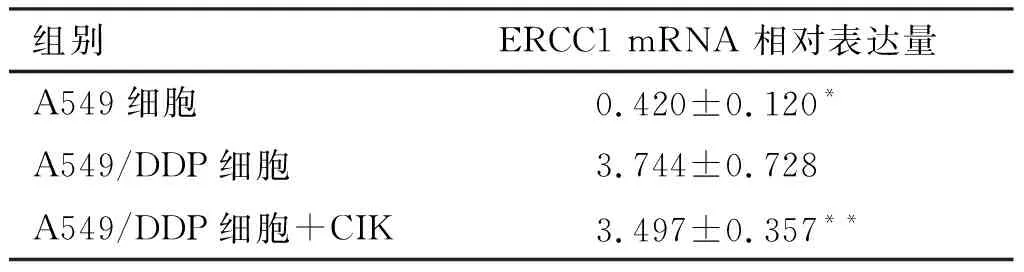
组别ERCC1 mRNA 相对表达量A549细胞 0.420±0.120*A549/DDP细胞3.744±0.728A549/DDP细胞+CIK3.497±0.357**
注:*与A549/DDP细胞组相比,P<0.05;**与A549/DDP细胞组相比,P>0.05。
2.4 Western blot检测各组细胞中ERCC1蛋白表达情况 以β-actin为内参,采用Western blot方法测得ERCC1蛋白相对表达量(见表5)。ERCC1蛋白在A549细胞组中表达较A549/DDP细胞组明显降低(P<0.05)。未加CIK的A549/DDP细胞组与CIK干预后的A549/DDP细胞组比较,ERCC1蛋白表达量无明显差异(P>0.05)。
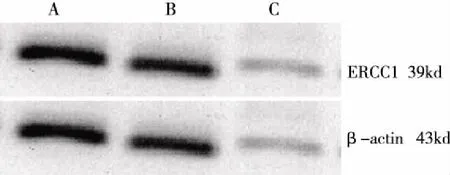
注:A:A549/DDP细胞+CIK组;B:A549/DDP细胞组;C:A549细胞组。 图1 ERCC1蛋白在各组细胞中的表达水平
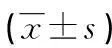

组别ERCC1 蛋白相对表达量A549细胞0.0076±0.0006*A549/DDP细胞0.0231±0.0011A549/DDP细胞+CIK0.0220±0.0007**
注:*与A549/DDP细胞组相比,P<0.05;**与A549/DDP细胞组相比,P>0.05。
3 讨论
肺癌的发病率和死亡率居恶性肿瘤首位,其就诊时多属中晚期,化疗是其主要的治疗手段,但化疗对肺癌的疗效已达到一个瓶颈,其主要原因是肿瘤细胞产生耐药所致。因此,研究肿瘤产生耐药机制,寻找有效的逆转方法以提高化疗的有效率成为当前国内外肿瘤界研究的热点。
近年来,许多药物和物理方法被发现能逆转肿瘤耐药,但因副作用大、存在技术困难等因素而不能在临床中得到推广应用。CIK细胞因其广谱的杀瘤活性以及对机体不良反应小而倍受关注。已有研究报道,CIK能逆转肿瘤对化疗药物的耐药性。CIK细胞又称自然杀伤样T淋巴细胞,具有NK细胞的非主要组织相容性复合体限制性杀瘤特点和T淋巴细胞强大的抗瘤活性,其主要效应细胞是CD3+CD56+T细胞。除了直接杀伤肿瘤细胞外,CIK细胞还可分泌大量细胞因子,通过调节机体免疫反应间接杀伤肿瘤细胞。CIK治疗安全性好,不良反应少,且能改善患者一般情况[2]。刘鹏英等[3]研究发现,CIK细胞联合多西紫杉醇可抑制SPC-A1/DTX细胞的生长,增强化疗疗效。邓琦等[4]通过CIK与ADR对K562/ADR先后作用,测得肿瘤细胞内P-gp表达降低,K562/ADR对ADR的敏感性增加。本实验表明, A549/DDP细胞与人肺腺癌A549细胞相比,对DDP耐药,RI=2.391。经CIK预处理后的A549/DDP细胞对DDP的敏感性增加,RF=3.967。本结果与以往的研究报道一致,进一步证实了CIK可能是一种理想的肿瘤耐药逆转剂。
通常,一种肿瘤细胞的耐药有多种耐药机制参与,CIK有可能通过多种机制完成对耐药的逆转。熊艳娟等[5]已证实CIK细胞通过分泌IFN-γ下调A549/DDP细胞中GST-γ逆转DDP耐药的作用。蒋东霞等[6]发现CIK能使P-gP、mdr-l表达下调,逆转耐药。现有的报道多从药物外排增加和细胞解毒系统功能增强两条途径来研究,针对CIK是否通过调节DNA修复途径来逆转耐药,尚未见文献报道。本实验从DNA修复途径来探讨CIK逆转耐药的可能机制,ERCC1作为参与DNA修复的关键基因,目前已有很多研究报道ERCC1的表达与铂类化疗敏感性相关。
ERCC1是一种高度保守的 DNA 核酸内切酶,在清除铂-DNA加合物以及修复DNA双链断裂中扮演了重要的角色。郑玲等[7]报道,ERCC1阳性表达的非小细胞肺癌患者对铂类耐药。有学者通过各种途径封闭、干扰、降低或沉默肿瘤细胞中ERCC1的表达后发现细胞对铂类敏感性增加。
综上所述,ERCC1的表达与肿瘤耐药有关。本研究中Real-Time RT-PCR/Western Blot结果显示,ERCC1 mRNA和蛋白在A549/DDP细胞中的相对表达量明显高于A549细胞(P<0.05),与夏莹等[8]的报道一致,推测ERCC1可能参与了耐顺铂人肺腺癌A549/DDP细胞耐药机制的形成。然而,本研究发现CIK预处理和未加CIK处理组的A549/DDP细胞相比,杀瘤率增加而ERCC1 mRNA和蛋白的表达无明显差异,提示ERCC1可能不是CIK细胞逆转A549/DDP细胞耐药的靶基因。CIK细胞的加入使A549/DDP细胞对顺铂的敏感性增加,亦有可能CIK与顺铂之间存在协同作用,已有研究证实顺铂能提高A549细胞NKG2D配体的表达,增强A549细胞对CIK细胞杀伤的敏感性[9],顺铂对A549/DDP细胞是否也具有同样作用,有待进一步研究。
[参考文献]
[1] Zhang T,Guan M,Jin H Y.Reversal of multidrug resistance by small interfering double-stranded RNAs in ovarian cancer cells[J].Gynecol Oncol,2005,97(2):501-507.
[2] 罗利琼,王继红,霍丹.CIK细胞治疗恶性实体瘤的临床疗效评价[J].中国医药指南,2013,11(8):34-36.
[3] 刘鹏英,陈龙邦.CIK细胞联合多西紫杉醇对肺腺癌耐药细胞SPC-A1/DTX的体内外杀伤作用的实验研究[J].中国免疫学杂志,2008,24(12):1079-1083.
[4] 邓琦,白雪,肖霞,等.CIK逆转K562/ADR细胞多药耐药作用及其机制探讨[J].中国血液学杂志,2011,32(1):52-56.
[5] 熊艳娟 ,杜春娟,于津浦,等.CIK分泌的细胞因子对逆转耐药顺铂肺腺癌细胞系A549/DDP耐药性的研究[J].中国肿瘤临床,2013,40(12):685-689.
[6] 蒋东霞,杨晓博, 赵婷茹, 等.CIK细胞体外逆转多药耐药性的研究[J].河南医学研究, 2008, 17(1):20-22.
[7] 郑玲,伍建蓉 ,白娟 ,等.ERCC1预测晚期非小细胞肺癌患者化疗敏感性的临床研究[J].实用癌症杂志,2013,28(1):38-41.
[8] 夏莹,胡成平,张梅春,等.靶向ERCC1 RNA干扰对人肺腺癌细胞顺铂耐药的逆转[J].中国肿瘤生物治疗杂志,2007,14(6):531-535.
[9] 张晓娟,梅家转 ,赵继智 ,等.顺铂与CIK细胞对A549细胞杀伤协同作用机制的初步研究[J].中华肿瘤防治杂志,2013,16(20):1229-1231.



