付少彬,文福来,闫 松,张 芸,李 义,岳昌武
(1.遵义医学院 药学院,贵州 遵义 563099;2. 遵义医学院 医学与生物学研究中心暨贵州省特色微生物资源及药物开发重点实验室,贵州 遵义 563099)
技术与方法
微生物转化氧化槐定碱活性菌株的筛选
付少彬1,文福来1,闫 松1,张 芸1,李 义1,岳昌武2
(1.遵义医学院 药学院,贵州 遵义 563099;2. 遵义医学院 医学与生物学研究中心暨贵州省特色微生物资源及药物开发重点实验室,贵州 遵义 563099)
目的 通过微生物转化方法对氧化槐定碱进行结构修饰和改造,以期得到结构新颖或活性更强的衍生物,从中筛选出对氧化槐定碱有催化活性的微生物菌株。方法 采用稀释法分离土壤微生物菌株,表面消毒法分离植物内生菌,通过薄层色谱法(TLC)对转化反应进行筛选;通过表型和基因型鉴定活性菌株。结果 从遵义医学院土壤分离得到土壤微生物菌株26株,从植物分离得到内生真菌60株;17株土壤微生物具有催化活性,其中菌株T003表现出强的选择性,经显微结构和16S rDNA 序列分析,鉴定其为Escherichiacoli。结论 微生物转化法为氧化槐定碱的结构修饰和改造提供了一个很好的选择方法。
生物转化;生物碱;土壤微生物;选择性
氧化槐定碱 (OSR) 和槐定碱 (SR) 是从豆科槐属植物苦豆子(SophoraalopecuroidesL)中提取到的重要的生物碱。 研究表明槐定碱在兴奋中枢神经系统、抗青霉素诱发的癫痫、免疫调节、抗肿瘤、抗病毒等方面表现出显着的药理活性[1-4]。氧化槐定碱和槐定碱在化学结构上非常相似,其差别在于N(氮)原子,氧化槐定碱是槐定碱的氮氧化物形式,近年来关于氧化槐定碱的研究也受到越来越多的关注。多项研究表明氧化槐定碱显示出良好的镇痛、消炎、镇静、抗心律失常、免疫调节活性、保护脑缺血等药理活性[5-6]。
氧化槐定碱由于环系稳定,所以可改造的位点较少,利用传统的有机催化的方式对该类化合物的化学活泼位点进行结构修饰有很大的局限性,对于不活泼的位点用传统的有机化学的方法进行修饰和改造相对较难,而微生物转化反应却可以催化非活泼的C-H或 N-H位点,其作为化学合成的有效补充正广泛应用于合成反应中,进而可以为新药研发提供更具价值的先导化合物[7-8]。此外,被称之为“绿色化学”的微生物转化法具有反应选择性强(区域选择性和立体选择性)、反应条件温和、副产物少、不造成环境污染和后处理简单等优点,所以近年来通过微生物转化方法对结构复杂的天然产物进行结构修饰研究受到越来越多的关注[9-10]。但是,通过微生物转化法对氧化槐定碱进行结构修饰的文献少见报道。本文从土壤中分离土壤细菌及放线菌26株,植物内生菌60株来筛选具有对氧化槐定碱有催化活性的微生物酶催化剂,为寻找更具价值的先导化合物奠定基础。
1 材料与方法
1.1 材料
1.1 .1 底物 底物氧化槐定碱购自北京元宝山色谱科技有限公司(纯度≥98%)。
1.1.2 培养基 富集、分离及筛选培养基:PDA培养基(去皮土豆200 g, 煮沸20 min;葡萄糖 20 g; 蛋白胨 10 g,加自来水定容至1 L);LB 培养基 (蛋白胨10 g、酵母提取物5 g; 氯化钠 10 g, 自来水定容至1 L, 用5 mol/L NaOH调节 pH至7)。 固体培养基则在相应的液体培养基中1 L加入20 g 琼脂。所有培养基均在121 ℃灭菌25 min备用。
1.2 方法
1.2.1 微生物菌株的分离与纯化 土壤微生物的分离与纯化:选取遵义医学院三宿舍前和学校后两处的土壤,距离地面10~20 cm,装入已灭菌的三角瓶,置于4℃冰箱待用。称取5 g土壤样品于250 mL三角瓶(内装50 mL无菌水以及玻璃珠)中,震荡混匀30 min。静止后量取1 mL上清液至于100 mL三角瓶中(内装40 mL LB液体培养基),在37 ℃,140 rpm黑暗下震荡富集培养12 h,加入底物氧化槐定碱,继续在相同条件下共培养2 d,用等体积乙酸乙酯萃取1次,减压浓缩后经薄层色谱(TLC)检测转化结果。TLC条件:展开剂:三氯甲烷-甲醇=5:1,显色剂:碘以及改良碘化铋钾。经TLC鉴定有阳性转化反应的土壤样品进行浓度梯度稀释(10-1,10-2,10-3,10-4,10-5,10-6,10-7),挑取单菌落,进行划线纯化3次,得到纯培养物,于4℃冰箱保存备用。
植物内生真菌的分离与纯化:选取采自遵义市金鼎山的药用植物松穗卷柏SelaginellalaxistrobilaK. H. Shing的健康组织通过常规的表面消毒的方法进行内生真菌的分离与纯化[11]。
1.2.2 活性菌株的筛选 对分离得到的26株土壤微生物通过LB培养基进行氧化槐定碱转化反应的筛选而植物内生真菌则采用PDA培养基进行筛选。土壤微生物在37 ℃,140 rpm条件下培养4~8 h后加入0.5 g/mL底物(乙醇溶解),相同条件下继续共培养2~3 d后用等体积乙酸乙酯萃取1次,减压蒸发溶剂。经TLC检测转化反应。展开剂:三氯甲烷-甲醇=5:1,改良碘化必钾显色。植物内生真菌在28 ℃,140 rpm条件下培养2~3 d,加入底物氧化槐定碱0.5 g/mL(乙醇溶解),相同条件下共培养5 d后萃取培养物。萃取方法与检测方法同上。
1.2.3 活性菌株T003的鉴定 对于筛选的活性菌株采用表型与基因型相结合的方法进行鉴定。表型通过观察活性菌株的菌落形态与细胞形状(革兰氏染色)来鉴别。基因型则通过测定16S rDNA序列进行比对分析进行种属鉴定,DNA 提取与PCR反应条件参考已有文献[12]。
2 结果
2.1 菌株的分离 从选取的5份土壤样品中,只有三宿舍前的土壤微生物显示阳性转化反应。后续的活性菌株的分离纯化也只针对于此处土壤。通过浓度稀释法共得到土壤微生物26 株。图1所示,10-5的稀释浓度得到的单菌落最多,为最优稀释度。从植物松穗卷柏中得到内生真菌60 株。
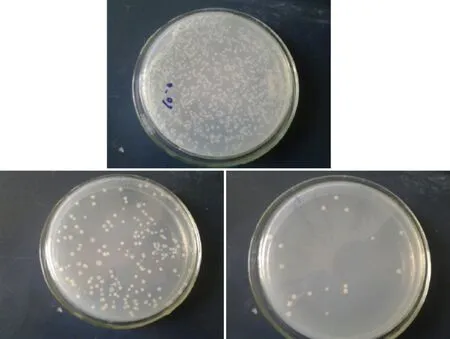
图1 10-4 、10-5 、10-6稀释浓度下的单菌落
2.2 氧化槐定碱转化反应的筛选 在筛选的86 株微生物菌株中,17 株土壤微生物显示阳性反应(见图2)。有趣的是,菌株T003表现出强的选择性,因为只转化出一种产物,且在TLC图谱中底物OSR的点几乎已看不见(见图3)。而植物内生真菌均未发现转化现象。
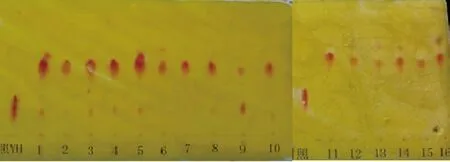
对照代表底物(OSR), 1-16 代表活性菌株,依次为T001, T002, T005, T007, T009, T010, T011, T012, T014, T015, y2, y3, T016, T017, T020, T023。

图3 菌株T003的选择性转化
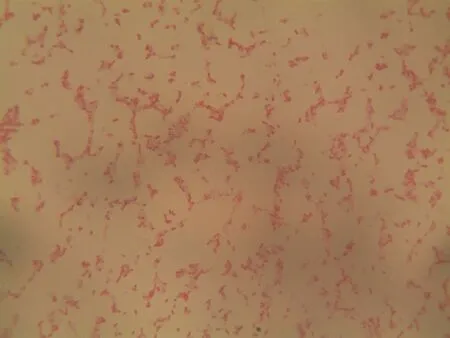
图4 菌株T003的革兰氏染色结果
2.3 活性菌株T003的鉴定 从土壤中分离的细菌T003因为选择性催化生成单产物,所以作为我们后续研究的重点。其菌落形态特征为:菌落表面较光滑、透明状、较湿润、易挑取、粘稠状 ,具有细菌的典型菌落特征。在电子显微镜下观察其细胞形态,如图4所示,细胞呈短杆状,革兰氏染色阴性。
16S rRNA 基因序列见图5,长1416bp,经NCBI的Blast在线比对,与Escherichiacoli相似度100%。经MEGA 5.1软件进行聚类分析构建系统发育树(见图6)。综合表型和基因型分析,活性菌株T003鉴定为Escherichiacoli。

图5 菌株T003的16S rDNA序列
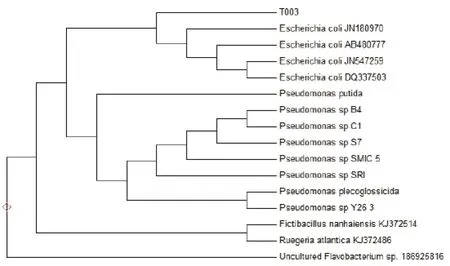
图6 菌株T003的系统进化分析
3 讨论
土壤是微生物的“大本营”。 土壤具有微生物生长所需要的各种条件。土壤中有丰富的有机质无机矿物质,能为微生物提供碳源、氮源和能量。土壤的良好持水性、多孔性、接近中性的酸碱度、相对稳定的温度等,这些都能满足微生物生长繁殖的要求。因而土壤事实上是“微生物天然的培养基”。在这里微生物的种类最多,数量也最大。内生真菌普遍存在于各种陆生和水生植物中,具有分布广、种类多的特点。目前的研究表明,植物内生真菌是一个庞大的特殊真菌类群,几乎所有的植物组织中都发现有内生真菌的存在。按地球目前已知的25万种植物计算,内生真菌的总数可以超过100万种。由此可见,植物内生菌也是一个巨大的资源。
我们通过富集培养、活性检测指导下得出采自遵义医学院三宿舍前的土壤样品含有能够催化OSR的微生物菌株,以此处土壤为样本分离得到土壤微生物26株。通过常规表面消毒得到松穗卷柏内生真菌60株。经TLC检测,在筛选的86株菌株中,17株土壤微生物显示出阳性反应。由此可见,土壤中蕴藏着丰富的活性菌株。但是所有的植物内生真菌均未见转化产物。土壤微生物T003因为较高的选择性催化OSR成单一产物而成为我们研究的重点,经表型和基因型分析将其鉴定为Escherichiacoli。下一步我们将对该菌株进行放大发酵培养,并对其转化产物进行结构鉴定,为新药研发提供更多的化合物。
[1] Yu J Q, Jiang Y X. Effects of sophoridine on central nervous system in mice[J].Chinese Traditional and Herbal Drugs,2006,37 (11) : 1688.
[2] Lu Z G, Hou Y H, Lu N Q,et al. The Epileptic Seizure-like Effect of Sophora Alkaloid Sophoridine on Experimental Animals[J].Journal of Ningxia Medical University, 2009,31 (6) : 723.
[3] Peng X d, Lu Z G, Mu Q C,et al. Epileptic seizure-like effect of Sophora alkaloid sophoridine on experimental animals[J].China Journal of Chinese Materia Medica, 2010,35 (1) :122.
[4] Bai J, Zhang L N, Hu S T,et al. A Study of Oxymartrine and Sophoridine on Seizure Rats Induced by Penicillin [J].Journal of Ningxia Medical College, 2006,28 (6) : 476.
[5] Yang G, Yan L, Gao J X, et al. Analgesic effect of oxysophoridine with intravenous injection andits influence on central GABA_ARα1 receptor in mice [J].Chinese Pharmacological Bulletin,2009,25(11): 1453-1456.
[6] Zhang K, Zhao J, Liu H Y, et al. Protective effects of oxysophoridine on acute cerebral ischemia injury in mice[J].Pharmacology and Clinics of Chinese Materia Medica, 2011,27(3):26-28.
[7] ChenY Z, Yang M, Zhuo J R,et al. Asymmetric synthesis of chiral 4-chlorobenzhydrol by C-H bonds oxidation with microbial enzymes [J]. J Zunyi Med Univ, 2014, 37(1):67-71.
[8] Chen Y Z, Li K, Shan J. Enantioselective hydroxylation C-H bonds of ethlbenzene to (R )-and (S) -1-phenylethanol[J]. J Zunyi Med Univ,2014,37(4):369-372.
[9] Fu S B, Yang J S, Cui J L, et al. Biotransformation of Ursolic Acid by an Endophytic Fungus from Medicinal PlantHuperziaserrata[J]. Chem Pharm Bull,2011, 59(9) :1180-1182.
[10] Feng X,Li D P,Zhang Z S,et al. Microbial transformation of the anti-diabetic agent corosolic acid[J].Natural Product Research, 2014, 28(21):1879-1886.
[11] Fu S B, Yang J S, Cui J L,et al. Multihydroxylation of ursolic acid byPestalotiopsismicrosporaisolated from the medicinal plantHuperziaserrata[J].Fitoterapia, 2011, 82(7):1057-1061.
[12] Wang M,Li Y Y,Shao M Y,et al.Separation and phylogenetic analysis of actinomycetes with activity of againstCandidaalbicansfrom Chishui danxia soil [J]. J Zunyi Med Univ,2014,37(4):404-408.
[收稿2014-10-20;修回2014-12-10]
(编辑:王福军)
Strains screening on microbial transformation of oxysophoridine
FuShaobin1,WenFulai1,YanSong1,ZhangYun1,LiYi1,YueChangwu2
(1. School of Pharmacy, Zunyi Medical University, Zunyi Guizhou 563099, China; 2. Research Center for Medicine Biology, Guizhou Key Laboratory of Characteristic Microbial Resources & Drug Development, Zunyi Medical University, Zunyi Guizhou 563099, China)
Objective The structuture of oxysophoridine(ORS) were modified by microbial transformation to obtain derivatives with novel structure or Stronger activity.The strains with catalytic activity of oxysophoridine were screened.Methods Soil microbes were separated and purified by dilution method while plant endophytic fungi were obtained by surface disinfection. Transformation reaction was detected via TLC. Active stains were identified by phenotype and genotype. Results Twenty-six soil microbes were isolated from soil in Zunyi Medical University and 60 endophytic fungi from plant were purified. Seventeen strains of soil microbes exhibited the catalytic activity. Interestingly, strain T003 with high selectivity was identified asEscherichiacolibasedonphenotype and genotype.Conclusion It provides an alternative for structure modification of ORS by microbial transformation.
biotransformation; alkaloids; soil microbes; selectivity
国家自然科学基金资助项目(NO: 21462057);贵州省普通高等学校微生物资源及药物开发特色重点实验室开放基金(NO: GZMRD-2014-003);贵州省中医药管理局中医药、民族医药科学技术课题研究资助(NO: QZYY-2014-083);大学生创新创业项目(NO: [2014] 5838)。
R284
A
1000-2715(2015)02-0190-03



