荆 晶,黄国凤,魏 敏,张倩茹,王 刚
(遵义医学院 药学院,贵州 遵义 563099)
技术与方法
响应面法优化绿茶多糖的提取工艺及应用
荆晶,黄国凤,魏敏,张倩茹,王刚
(遵义医学院 药学院,贵州 遵义563099)
[摘要]目的 通过响应面法优化绿茶多糖的提取工艺。方法 以绿茶多糖提取率为响应值,在单因素试验基础上,采用响应面分析法优化绿茶多糖的提取工艺,应用所得到最佳提取条件提取不同产地绿茶中的绿茶多糖,并比较提取率。结果 绿茶多糖提取最佳工艺条件为料液比1∶20,提取时间90 min,提取温度80 ℃。MT地区的绿茶多糖提取率最高。结论 该工艺条件稳定可靠,可应用于绿茶多糖的提取生产,为开发和利用贵州绿茶资源提供理论基础。
[关键词]响应面分析;绿茶多糖;提取分离;料液比;工艺优化
我国绿茶资源丰富,每年成品茶约60万吨[1],贵州地区绿茶种植区分布广泛,是我国重要的绿茶产区之一[2-3]。绿茶多糖(green tea polysaccharide,GTPS)是一种与蛋白质结合的酸性糖蛋白[4],属植物多糖。绿茶多糖是茶叶中的一种生理活性物质, 是由糖类、蛋白质、果胶和灰分组成的一种类似灵芝多糖和人参多糖的高分子化合物, 并结合有大量矿质元素[5]。绿茶多糖的蛋白质部分主要由20种常见氨基酸组成[6],糖部分主要由阿拉伯糖、核糖、葡萄糖和半乳糖等组成[7],矿质元素主要由钙、镁、铁、锰及少量稀土元素组成[8]。现已有许多研究证实了茶多糖具有降血糖、降血脂、增强免疫力、降血压、抗血栓和耐缺氧等作用[9-10]。
目前多糖[11]提取多采用水提醇沉或超声、微波等提取方法,由于超声、微波方法设备成本偏高,在绿茶多糖生产中多以水提醇沉法提取多糖产品,进一步加工制成绿茶多糖食品保健品,因此本文采用水提醇沉法提取绿茶多糖。以贵州绿茶为原料,以绿茶多糖提取率为响应值,提取时间、提取次数、提取温度以及料液比等相关单因素试验,选取提取时间、提取温度及料液比3个因素3个水平Box-Benknken实验设计,应用响应面分析法进行绿茶多糖提取工艺优化,为进一步开发利用贵州本地绿茶资源提供理论基础。
1材料与方法
1.1仪器FZ102型微型植物粉碎机(天津市泰斯特仪器有限公司);FA2004N型电子天平(上海精密仪器有限公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);艾科实验室专用超纯水机(成都康宁实验专用纯化水设备厂);KEXI型恒温水浴箱(中国上海科析试验仪器厂成都科析成套公司制造);SHB-ⅢA型循环水式多用真空泵(郑州长城科工贸有限公司);RE-2000型旋转蒸发器(上海亚荣生化仪器厂);80-2B台式离心机(上海安亭科学仪器厂);UV-2102PC型紫外可见分光光度计(龙尼柯〈上海〉仪器有限公司);TU-1901型双光束之紫外可见分光光度计(北京普析通用仪器有限责任公司);98-1-B型磁力搅拌电热套(天津市泰斯特仪器有限公司);101-4型电热鼓风恒温干燥箱(上海市崇明实验仪器厂)。
1.2试剂与药品无水乙醇(成都市科龙化工试剂厂,批号:20100730 )、乙醚(天津市致远化学试剂有限公司,批号:20081028)、葡萄糖:(上海三浦化工有限公司,批号:20020102)苯酚(广东·汕头市西陇化工厂,批号:0402041)、丙酮(上海化学试剂总厂,批号:20081226)、浓硫酸(成都市科龙化工试剂厂,批号:20100524)、正丁醇(天津市致远化学试剂有限公司,批号:20081114)、三氯甲烷(成都市科龙化工试剂厂,批号:20061126)、三氯乙酸(天津市大茂化学试剂厂,批号:20101030)、以上试剂均为分析纯;95%工业乙醇(遵义医学院);所用水为超纯水,贵州绿茶(购于贵州省遵义市)。
1.3实验方法
1.3.1绿茶多糖的提取及纯化贵州绿茶(购于遵义市湄潭县永兴镇)粉碎后过60目筛,称取20 g茶叶粉末于250 mL圆底烧瓶中,95%乙醇(料液比1∶5)回流脱脂1 h,过滤后取滤渣,挥干溶剂后,分别在设定条件下水提2次后过滤,滤液用旋转蒸发器减压浓缩至70 mL,加入4倍量95%乙醇静置过夜(10 h),抽滤后3 000 r/min离心15 min,沉淀物加纯化水溶解,抽滤后取上清液用sevag法除蛋白(按粗多糖溶液:Sevag试剂=5∶1加入),离心后取上清液,减压浓缩至70 mL,用4倍体积95%静置10 h,抽滤后离心,取沉淀物用无水乙醇、乙醚及丙酮依次洗涤2~3次,真空干燥后即得绿茶多糖。
1.3.2溶液的配制葡萄糖标准溶液的制备:精密称取已干燥过的标准品葡萄糖0.020 0 g定容于50 mL容量瓶中,得0.4 mg/mL葡萄糖储备液;苯酚溶液的配制:取苯酚100 g,加入锌粉0.5 g,常压蒸馏,收集182 ℃时馏分,取25 g加水溶解,移入500 mL容量瓶中并定容至刻度,即得5%苯酚溶液。将该溶液置于500 mL棕色瓶内放入4 ℃冰箱保存备用;Sevag试剂:氯仿-正丁醇=5∶1(V:V)。
葡萄糖标准曲线绘制:取6个10 mL容量瓶,编号分别为1~6,分别吸取1.3.1中葡萄糖标准溶液0.5、1.0、1.5、2.0、2.5、3.0 mL分别置于编号为1、2、3、4、5、6、7的10 mL容量瓶中,依次加入5%苯酚1.0 mL、硫酸5.0 mL和适量水,并摇匀、冷却、定容至刻度,于沸水中加热15 min、冷却,在490.00 nm处以0号为空白,用紫外可见分光光度计测定吸光度。以吸光度(A)为纵坐标,浓度(C)为横坐标作图得标准曲线Y=12.301X-0.017(R2=0.999 16),结果表明葡萄糖溶液浓度在20.12~120.2 μg/mL范围内线性关系良好。
1.3.3绿茶多糖提取率计算实验所得绿茶多糖含量与每次实验所使用绿茶质量带入公式(1),求算粗多糖提取率。
绿茶多糖提取率(%)=m/M×100% (1)
式中,m为所提绿茶多糖的质量,M为称取绿茶的质量。
1.3.4单因素实验分为4次系列实验,固定其他条件,提取温度、提取时间、提取次数、料液比采用4水平等比梯度变化提取绿茶多糖,计算多糖提取率。
1.3.5响应面分析结合单因素实验结果,采用Box-Benhnken设计3因素3水平的试验,并用响应面分析法对绿茶多糖的提取条件进行优化。
2结果
2.1单因素试验结果单因素试验按照不同提取次数、提取温度、提取时间及料液比提取绿茶多糖,计算多糖提取率,得到最佳提取条件。以绿茶多糖提取率为响应值,单因素试验结果表明最佳提取次数为提取2次,最佳提取时间为120 min,最佳提取温度为70 ℃,最佳提取料液比为1∶20(见图1)。
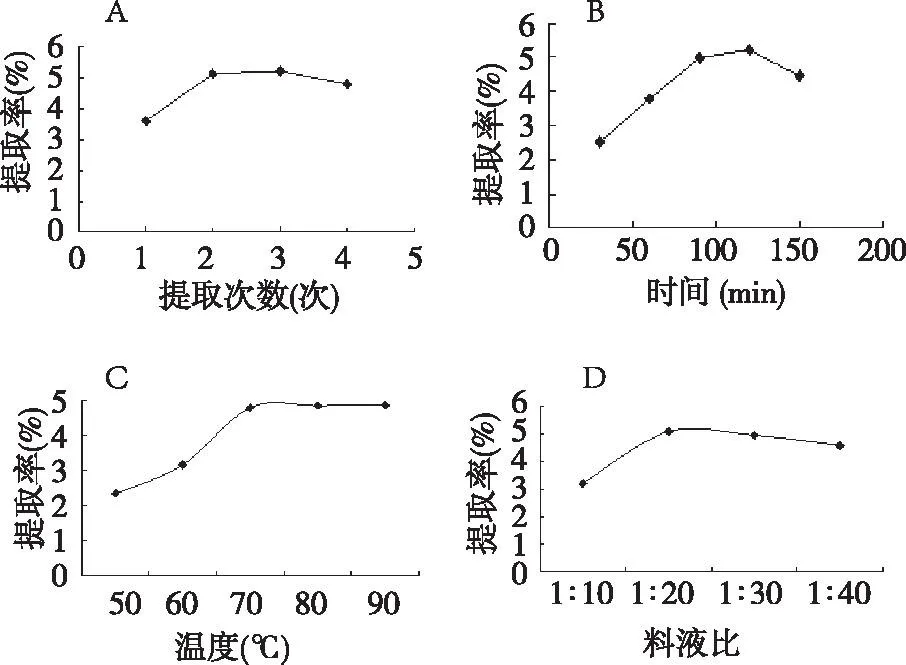
A:提取次数对提取率影响;B:提取时间对提取率影响;C:提取温度对提取率的影响;D:料液比对提取率的影响。图1 单因素试验结果
2.2响应面法优化绿茶多糖提取实验设计及结果
2.2.1响应面分析因素水平选取在单因素试验结果基础上,每次实验提取次数设计为2次,以浸提时间、浸提温度、料液比进行3因素3水平的Box-Benknken实验设计,因素水平以-1、0、1编码,以绿茶多糖的提取率为响应值(见表1)。
表1响应面分析因素与水平
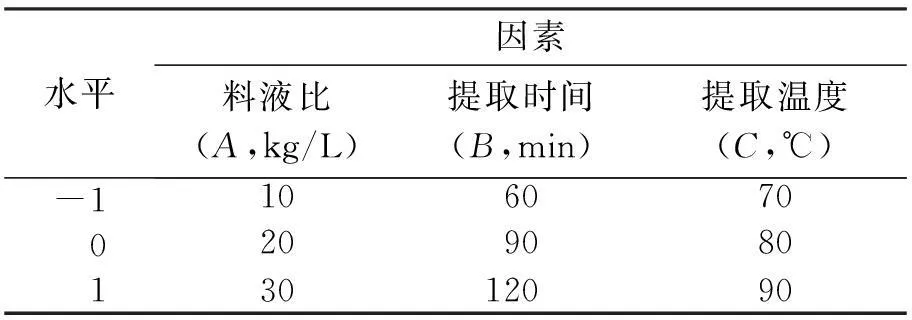
水平因素料液比(A,kg/L)提取时间(B,min)提取温度(C,℃)-1106070020908013012090
2.2.2响应面优化绿茶多糖提取的结果分析以A(料液比)、B(提取时间)、C(提取温度)为自变量,以绿茶多糖提取率为响应值,用DESIGN-EXPERT软件进行3因素3水平的响应面数据分析得到结果(见表2)。综合分析表中数据结果,得回归方程为Y=5.22+0.41A+0.14B-0.038C+0.36AB-0.19AC+0.12BC-0.78A2-0.22B2-0.64C2。
表2响应面优化绿茶多糖提取工艺实验设计及结果
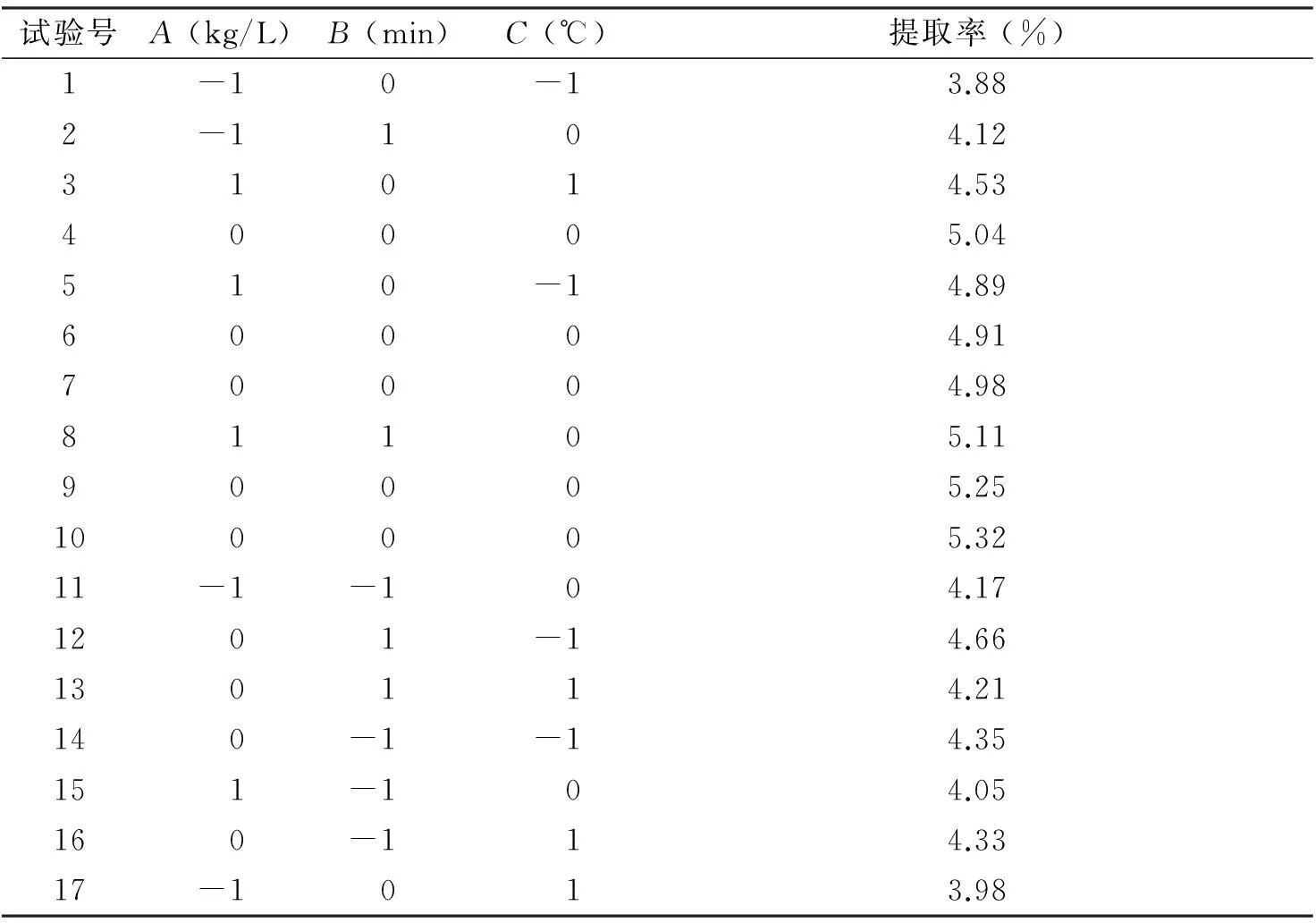
试验号A(kg/L)B(min)C(℃)提取率(%)1-10-13.882-1104.1231014.5340005.04510-14.8960004.9170004.9881105.1190005.25100005.3211-1-104.171201-14.66130114.21140-1-14.35151-104.05160-114.3317-1013.98
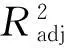
表3响应面回归模型方差分析
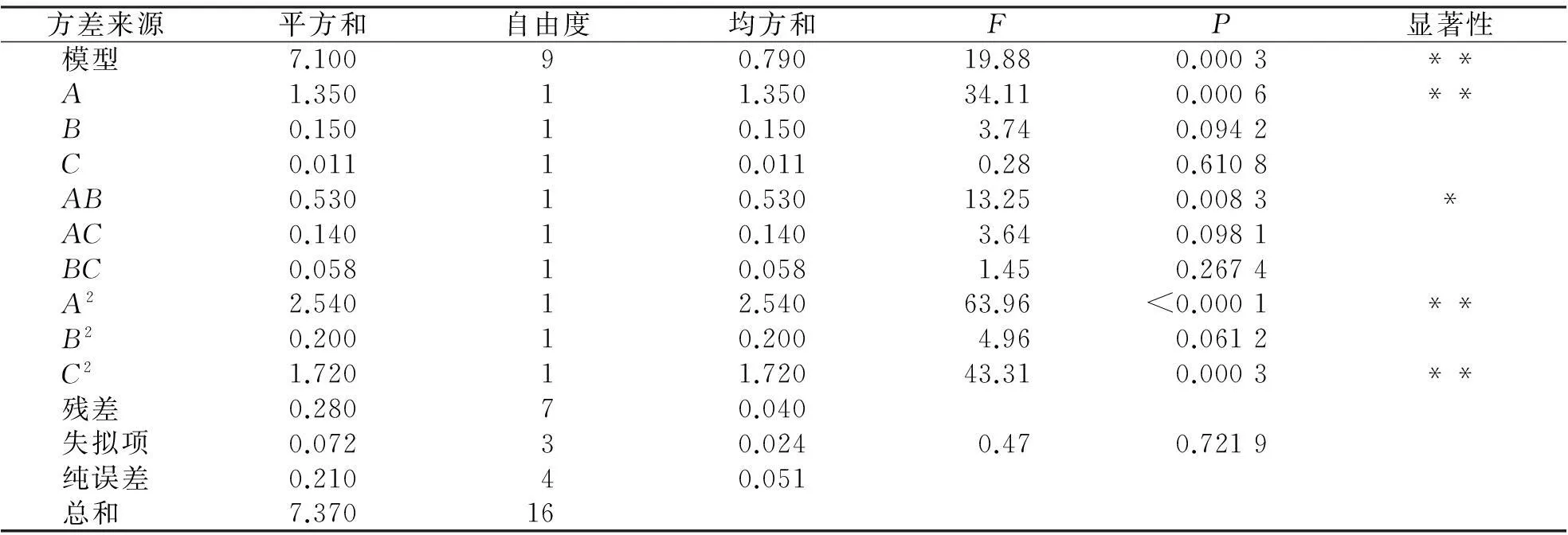
方差来源平方和自由度均方和FP显着性模型7.10090.79019.880.0003**A1.35011.35034.110.0006**B0.15010.1503.740.0942C0.01110.0110.280.6108AB0.53010.53013.250.0083*AC0.14010.1403.640.0981BC0.05810.0581.450.2674A22.54012.54063.96<0.0001**B20.20010.2004.960.0612C21.72011.72043.310.0003**残差0.28070.040失拟项0.07230.0240.470.7219纯误差0.21040.051总和7.37016
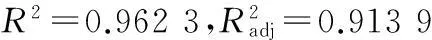
2.2.3响应面图与等高线图分析根据多远回归方程得到料液比(A)、提取时间(B)及提取温度(C)对绿茶中多糖提取率的影响面图和等高线说明AC、BC之间交互影响并不显着,AB之间交互影响效果显着。固定提取温度为中间温度80 ℃,可以做出料液比(A)与提取时间(B)的交互图与等高线图,由图2可知,只随着料液比、提取时间的升高,响应值为以曲面,在料液比1∶20、提取时间90 min时响应值存在极大值。该图中曲线坡度比较大,这表明因素A与因素B之间交互作用明显。
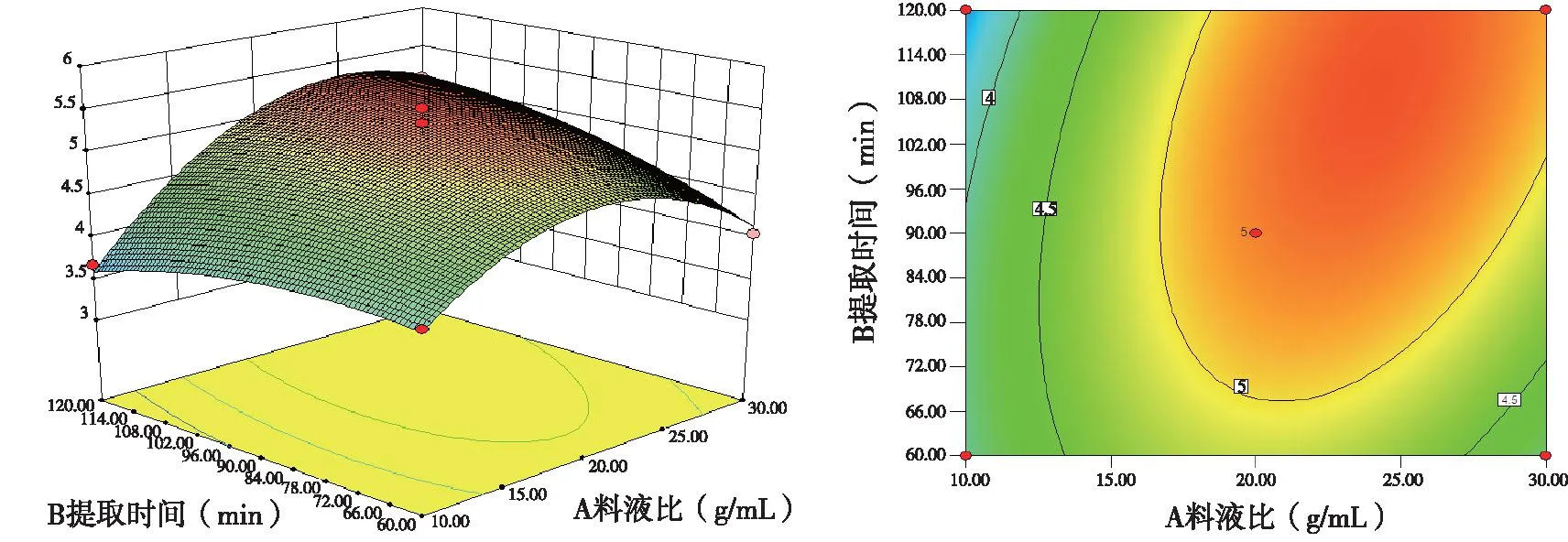
图2 Y=f(A,B)绿茶多糖提取率的响应面及等高线
图3结果表明,料液比和提取温度交互作用显着,当料液比固定,绿茶多糖的提取率随提取时间延长表现为先上升后下降的趋势,当提取时间固定在中间值90 min时,绿茶多糖提取率随着料液比的增大表现为先上升后下降的趋势,响应值极大致出现在料液比1∶20,提取温度80 ℃时。
图4结果表明,当料液比固定在中间值1∶20,提取时间不变时,绿茶多糖提取率随提取温度的升高而出现先增加后降低的趋势;而当提取温度不变时,响应值随着提取时间的延长出现先增加后减少的趋势,但总体上曲面图坡度比较平缓,即提取时间与提取温度,对响应值的交互影响效果并不显着。
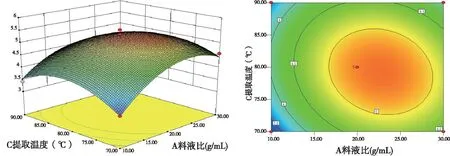
图3 Y=f(A,C)绿茶多糖提取率的响应面及等高线
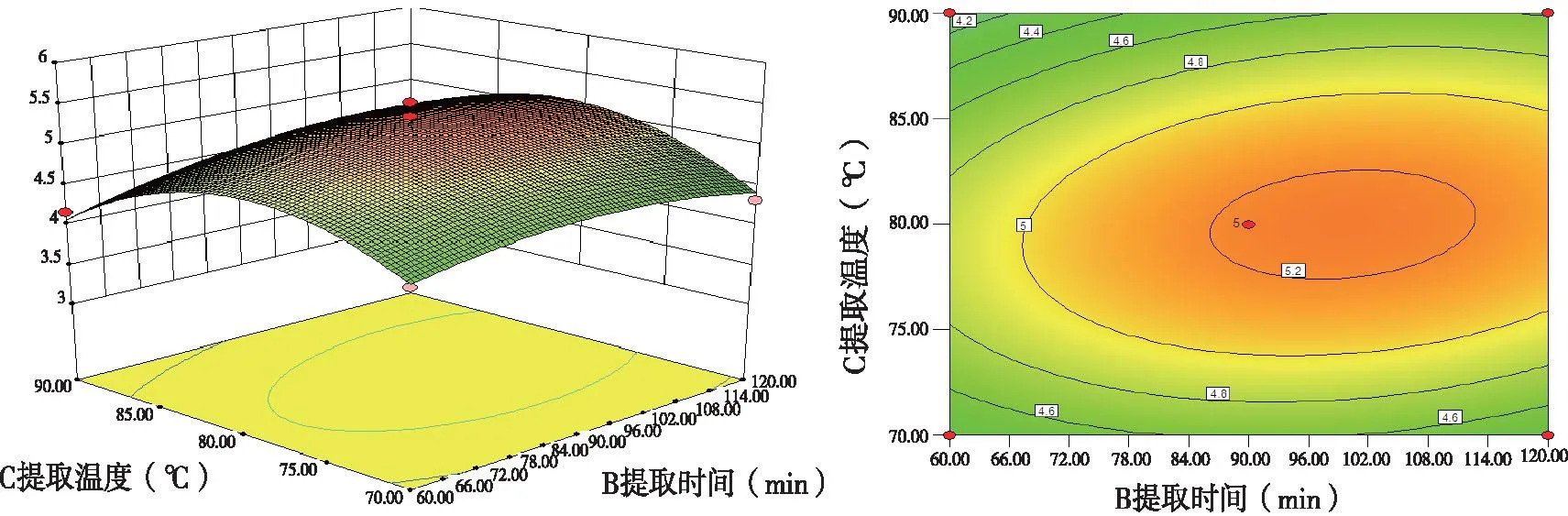
图4 Y=f(B,C)绿茶多糖提取率的响应面及等高线
2.2.4最佳实验条件预测通过Design-Expert 8.0.6软件进行数据分析,得到多糖提取的最佳工艺条件是:料液比(A)为1∶20,提取时间(B)为90 min,提取温度(C)为80 ℃,预计绿茶多糖提取率为5.22%。
2.3最佳实验条件的验证及贵州3个产地绿茶多糖提取率比较在理论最佳提取条件下分别对贵州3个产地的绿茶进行提取,平行提取3次,以考察优化工艺条件的稳定性,3组数据RSD值均少于0.2,所采用工艺稳定性良好。DY产地的茶多糖提取率最高,FG产地的提取率最低。其中样品FG为工艺优化实验所用样品,样品MT、DY为其他产地品种。考察FG样品在最佳工艺条件下提取3个批次,实际提取率为5.17%、5.23%、5.15%,平均值为5.18%,与预测值5.22%接近,略低于预测值(见表4)。
表4不同产地绿茶中茶多糖提取率比较
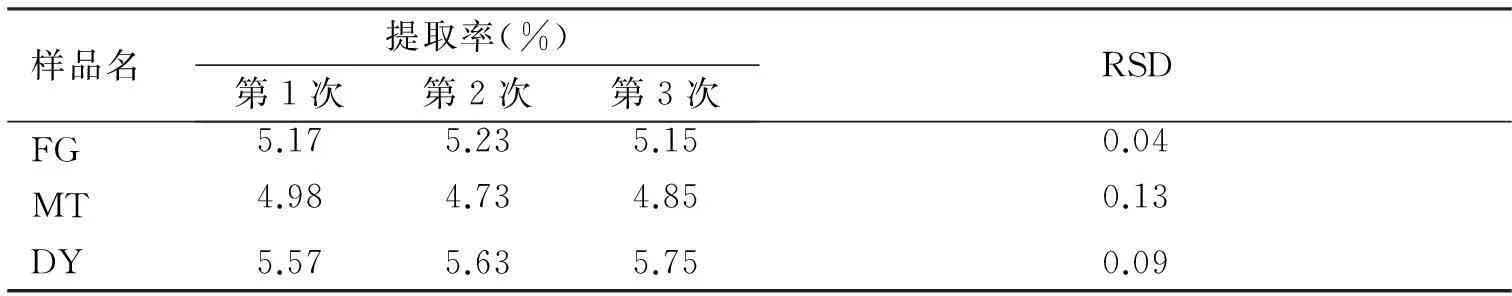
样品名提取率(%)第1次第2次第3次RSDFG5.175.235.150.04MT4.984.734.850.13DY5.575.635.750.09
FG:贵州遵义凤岗地区绿茶(采用工艺优化实验所得样品);MT:贵州遵义湄潭地区绿茶;DY:贵州省都匀市绿茶。
3讨论
目前关于绿茶多糖提取工艺的优化方法,主要通过正交试验设计方法,正交实验设计的目的在于如何合理开展实验工作,而本文采用的响应面分析法侧重于比较各相关因素之间的交互对响应值的综合影响,与实际生产之间的拟合度更高。因此本文以响应面分析法优化绿茶多糖的提取工艺,并对该提取工艺进行验证试验,以期得到最优良最稳定的绿茶多糖提取工艺,为进一步开发贵州绿茶深加工食品保健品提供理论基础。
本实验首先采用单因素试验确定因素水平,并依据单因素试验条件结果,应用响应面分析法将料液比、提取时间、提取温度等因素进行交互考察其对多糖提取率的影响,采用二次回归设计得到绿茶多糖提取率的回归模型,进而得到最佳工艺条件,并对该条件进行了验证实验,表明了该模型的可靠性。
应用该提取条件,选取贵州3个不同产地的绿茶品种进行多糖的提取,比较其提取产率,DY产地的茶多糖提取率最高,FG产地的提取最低,从产品开发角度来说,MT产地的绿茶用于开发绿茶多糖相关产品利用价值较高。
[参考文献]
[1] 谷维娜,肖颖,王红娟,等.柿叶多糖提取工艺研究[J].湖北农业科学,2010,49(8):1953.
[2] 周杨,段红萍,胡小静,等.云南普洱茶多糖提取工艺及翻堆样中含量测定的研究[J] .食品科技,2007,34(6): 110-112.
[3] 王淑如,王丁刚.茶叶多糖对心血管系统的部分药理作用[J]. 中药草,1992,23(8):4-5.
[4] 孙晓雪,孙卫东,史德芳,等.仙人掌多糖提取过程中脱蛋白方法的研究[J].天然产物研究与开发,2007,19(5):117-119.
[5] 苏冰霞,葛会林,张艳玲,等.山苦茶多糖浸提和抗氧化研究[J].食品工业,2013,34(10):175-178.
[6] Habibi Y,Heyraud A,Mabrouz M,et a1.Structural features of pectic polysaeeharides from the skin of opuntia ficus-indca prickly pear fruits[J].Carbohydrate Research,2004,39(3):1119-1127.
[7] 肖代敏,吕纯莉,张志敏,等.打孔吸附树脂分离纯化戴氏虫草多糖工艺研究[J].遵义医学院学报,2015,38(5):536-540.
[8] 陈仕学,代鸣,赵成刚,等.梵净山3种茶叶茶多糖的含量比较分析[J].安徽农学通报,2013,19(2):23-24.
[9] Park J,Kim B C.Conventional versus ultrasonic Synthesis of zeolite 4A from kaolin[J]. Journal o f Materials Science Letter,2012,32(2):531-533.
[10]易帆,彭勇.大叶苦丁茶的研究进展[J].中国现代中药,2013,10(8):711-717.
[11]龚其海,余兰,石京山,等.两种党参多糖对小鼠免疫功能影响的比较[J].遵义医学院学报,2012,35(4):267-270.
[收稿2015-12-10;修回2016-01-10]
(编辑:王福军)
Optimization of extraction of polysaccharides from green tea by response surface methodology
JingJing,HuangGuofeng,WeiMin,ZhangQianru,WangGang
(School of Pharmacy, Zunyi Medical University, Zunyi Guizhou 563099, China)
[Abstract]Objective The reponse surface methodology was used to optimize the best polysaccharides extraction technological conditions for Green Tea. Methods Set the extraction rate of polysaccharide from green tea as the response value,on the basis of single factor experiment, the extraction technological conditions of polysaccharide from green tea were optimized by response surface methodology, the best extraction conditions were used to extract green tea polysaccharides from different habitats. Results The optimum extraction technological conditions for polysaccharides from green tea were material to solvent 1∶20, extraction time 90 min, extraction temperature of 80 ℃. The extraction rate of polysaccharide from green tea was the highest in Meitan (MT) producing area. Conclusion The process is stable and reliable, and can be applied to the extraction and production of green tea polysaccharides, which provides theoretical basis for the development and utilization of Guizhou green tea resources.
[Key words]response surface analysis;green tea polysaccharide;extraction and separation;solid-liquid ratio;process optimization
[中图法分类号]TS244
[文献标志码]A
[文章编号]1000-2715(2016)01-0076-05
[通信作者]王刚,男,博士,副教授,研究方向:中药活性成分与食品科学,E-mail:wg8855350@163.com。
[基金项目]国基自然科学基金资助项目(NO:81560569)。



